
逆转衰老是人类长久以来的梦想。图片来源:Tim Flach
本文经授权转载自药明康德团队微信公众号“学术经纬”。
2017年3月23日,《细胞》杂志刊登了一篇里程碑式的论文(Targeted Apoptosis of Senescent Cells Restores Tissue Homeostasis in Response to Chemotoxicity and Aging)。来自荷兰的一支研究团队发现,一种多肽能选择性清除小鼠体内的衰老细胞,重塑它们的青春。
衰老细胞无疑是近年来研究的一大热点。随着我们的逐渐变老,衰老细胞在体内慢慢堆积。研究人员们相信,这些细胞是导致心血管疾病、关节炎与糖尿病的元凶。去年,《自然》与《科学》杂志分别在上半年与下半年刊发文章,表明通过清除体内衰老细胞,科学家们能让带有基因突变的早衰小鼠活得更久,或是减少这些小鼠动脉内斑块的堆积。此外,研究人员找到了至少7种有望杀死衰老细胞的化合物,临床试验也正在进行中。
然而,一些科学家们认为这些研究成果可能有一定的局限。首先,这些发现是在基因突变的早衰小鼠中完成的,遗传背景值得考虑。此外,这些化合物大多是癌症药物,有一定的副作用。比如它们会杀死健康细胞,或是造成血小板下降等副作用。因此,科学家们也正在不断摸索新的抗衰老方法,试图让人能常葆青春。

Peter de Keizer 教授在抗衰老领域带来了突破。图片来源:鹿特丹伊拉斯姆斯大学医学中心官网
一支来自荷兰的团队带来了突破。荷兰鹿特丹伊拉斯姆斯大学(Erasmus University)医学中心的细胞生物学家 Peter de Keizer 教授与同事们启动了一项研究,旨在了解为何衰老细胞能在体内存活而不被消灭。要知道,衰老细胞一般都已经累积了大量 DNA 损伤,理论上应该启动 p53蛋白,使其发生细胞凋亡。但出于未知的原因,p53并未起到应有的作用,让大量衰老细胞在人体中逗留,引发一系列与衰老有关的问题。
而 de Keizer 教授的团队发现了这些细胞背后的奥秘。原来,这些细胞内有一种叫做 FOXO4的蛋白质。它能“锁住”p53蛋白,让它失去原有的作用。在 FOXO4的作用下,衰老细胞就能逍遥法外,逃脱凋亡的命运。
那么有什么办法,能够“绑住”FOXO4作恶的“双手”,让 p53蛋白能重新恢复正常功能呢?研究人员们设计了一种多肽,它能够与 p53结合,防止它和 FOXO4蛋白相遇。但与此同时,它却不会影响 p53蛋白的功能。因此,这种多肽有望能让衰老细胞中的 p53执行正常功能,促使衰老细胞凋亡。
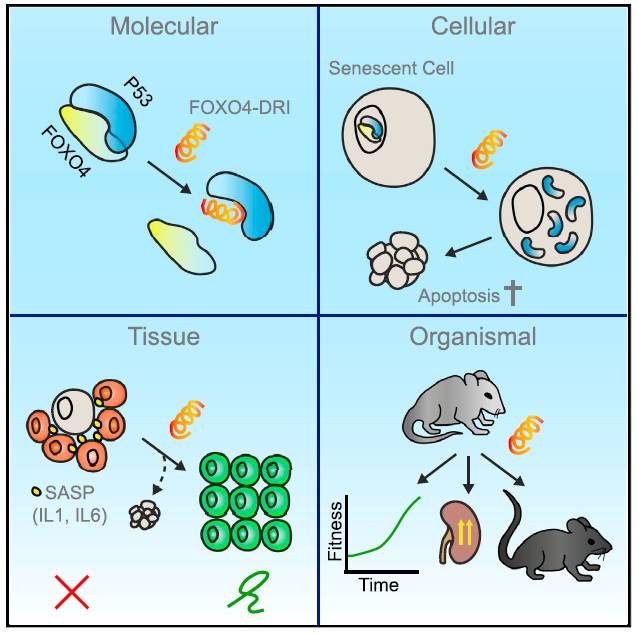
该多肽的作用机理。图片来源:《细胞》
在体外实验中,科学家们的假设得到了验证。他们往培养皿中加入了这种多肽,并发现 FOXO4与 p53的结合果然得到了抑制,而衰老细胞也开始凋亡。更重要的是,它并不影响健康细胞。
“FOXO4在非衰老细胞中几乎不表达,” de Keizer 教授说:“因此这个多肽只会引起衰老细胞的死亡。”
在体外实验得到成功后,科学家们开展了小鼠体内实验。他们选择了一批早衰的突变小鼠,并将这种多肽注射入它们体内。在一般的情况下,这些突变小鼠会在出生后几个月内就展现出衰老的症状。它们会开始掉毛,肾脏功能开始下降,运动也变得迟缓。然而在注射入这种多肽后,奇迹发生了。
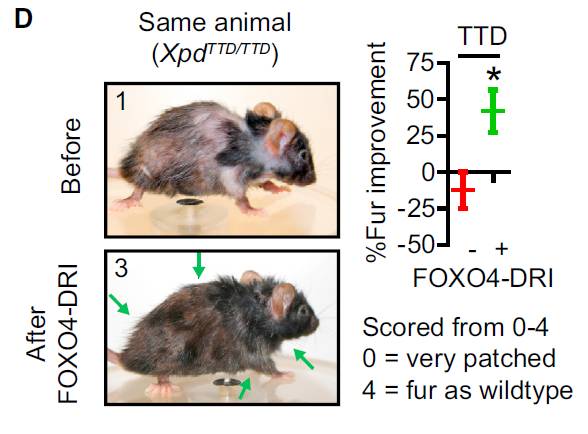
同一只小鼠在接受治疗后,毛发产生了显著的改善。图片来源:《细胞》
仅仅过了10天,这些小鼠身上原本稀疏的毛发就开始增多。大约3周后,小鼠的运动能力开始改善,它们的运动距离几乎是对照组的两倍。此外,通过生物标志物的分析,研究人员确认小鼠肾脏的损伤也得到了逆转。
更关键的是,这种多肽在正常的小鼠中也能起到抗衰老的效果。研究人员寻找了一批正常衰老的小鼠,并为它们提供了这种多肽。同样,它们的毛发状况与肾脏功能得到了显著提高。此外,它们也对外界展现出了更高的探索兴趣,表明它们的精力得到了提高。
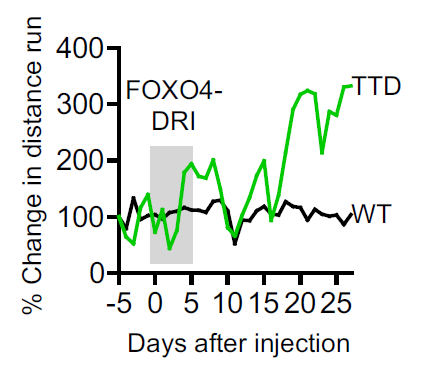
小鼠在注射多肽后,运动能力有了显著提高(绿线)。图片来源:《细胞》
“我们做了一项长达10个月的实验,并每周为小鼠注射3次多肽。我们没有看到任何明显的副作用。” de Keizer 教授认为这种方法的安全性有保障。
“这绝对是个里程碑式的突破,”加拿大蒙特利尔大学的分子生物学家 Francis Rodier 教授说道:“这是首次有人证明,你能消除衰老细胞,但不引起任何明显的副作用。”
在取得的巨大突破面前,de Keizer 教授依然保持着谨慎。他认为在启动人类临床试验前,还需要更多的研究,以确保它的绝对安全。但他认为,抗衰老领域的前途一片光明:“抗衰老研究的未来有三大方向,预防细胞损伤和衰老,安全地清除衰老细胞,以及激活干细胞。无论采取哪一种 方法,我们都希望能增强组织的再生。”
也许,我们这一代人将在这些药物的作用下,寿命将得到大幅的延长。人类离长生不老药,从未如此接近。
点击“阅读原文”,即可获得论文全文。
参考资料:
[1] Molecule kills elderly cells, reduces signs of aging in mice
[2] Peptide targeting senescent cells restores stamina, fur, and kidney function in old mice
[3] Targeted Apoptosis of Senescent Cells Restores Tissue Homeostasis in Response to Chemotoxicity and Aging
论文基本信息
【题目】Targeted Apoptosis of Senescent Cells RestoresTissue Homeostasis in Response to Chemotoxicity and Aging
【作者】Marjolein P. Baar, Renata M.C. Brandt, Diana A. Putavet, Julian D.D. Klein, Kasper W.J. Derks, Benjamin R.M. Bourgeois, Sarah Stryeck, Yvonne Rijksen, Hester van Willigenburg, Danny A. Feijtel, Ingrid van der Pluijm, Jeroen Essers, Wiggert A. van Cappellen, Wilfred F. van IJcken, Adriaan B. Houtsmuller, Joris Pothof, Ron W.F. de Bruin, Tobias Madl, Jan H.J. Hoeijmakers, Judith Campisi, Peter L.J. de Keizer
【期刊】Cell
【日期】23 March 2017
【DOI】10.1016/j.cell.2017.02.031
【摘要】The accumulation of irreparable cellular damage restricts healthspan after acute stress or natural aging. Senescent cells are thought to impair tissue function, and their genetic clearance can delay features of aging. Identifying how senescent cells avoid apoptosis allows for the prospective design of anti-senescence compounds to address whether homeostasis can also be restored. Here, we identify FOXO4 as a pivot in senescent cell viability. We designed a FOXO4 peptide that perturbs the FOXO4 interaction with p53. In senescent cells, this selectively causes p53 nuclear exclusion and cell-intrinsic apoptosis. Under conditions where it was well tolerated in vivo, this FOXO4 peptide neutralized doxorubicin-induced chemotoxicity. Moreover, it restored fitness, fur density, and renal function in both fast aging XpdTTD/TTD and naturally aged mice. Thus, therapeutic targeting of senescent cells is feasible under conditions where loss of health has already occurred, and in doing so tissue homeostasis can effectively be restored.
【链接】http://www.cell.com/cell/abstract/S0092-8674(17)30246-5?_returnURL=http%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0092867417302465%3Fshowall%3Dtrue

阅读更多
内容合作请联系
[email protected]















