基因疗法,也叫基因治疗(gene therapy)是指利用分子生物学手段,将核酸导入患者体内,使其表达
基因产物
(如蛋白质)
,或对患者基因进行编辑,从而达到治疗疾病的目的。过去的几年中,基因治疗对遗传疾病和癌症表现出惊人的功效,使得社会公众都加入到了对基因治疗的认知热潮之中。
近日,我国基因治疗领域专家、上海交通大学
蔡宇伽
教授在
Gene Therapy
杂志发表了题为:
An overview of development in gene therapeutics in China
的综述论文,
对我国基因疗法的发展做了详细概述。
由来已久的基因疗法
实际上
,基因治疗的最早
尝试可追溯到1970年的一场未经批准的临床治疗,当时美国医生
斯坦利·科恩
(Stanley Cohen)
试图通过注射含有精氨酸酶的乳头瘤病毒来治疗一对姐妹的精氨酸血症,该尝试以失败告终。
随后科学家们试图通过引入正常基因组替换突变基因组的方式,达到治疗目的。但在基因疗法的早期阶段,一直没有出现将外源基因传递给人类细胞的有效工具。
直到
20世纪80年代末
,病毒载体兴起。相应的公共监管体制也在那时候建立起来,并在90年代起正式批准基因疗法用于人体临床试验。
1990年
,美国国家食品药品监督管理局
(FDA)
正式批准了第一个基因治疗临床试验,美国国立卫生研究院进行了世界上首次人体基因治疗的临床试验。一名年仅4岁患有
先天性腺苷脱氨酶缺乏症
的小女孩,经过基因治疗技术导入正常的腺苷脱氨酶基因,患儿的免疫能力得以提高,获得了明显的治疗效果。
这项临床试验的成功成为当今生物医学发展最重要的篇章
。此后,世界各国都掀起了基因治疗的研究热潮。
直到
2012年
,欧洲药品管理局
(EMA)
批准UniQure公司的基因治疗药物
Glybera
。尽管该药在2014年正式上市后,商业化道路上并不成功,于2017年退出市场,但它作为西方国家第一个基因治疗产品,
彻底打开了基因疗法的大门
。
在之后的几年中,几种基因治疗产品相继涌入市场。2016年,葛兰素史克
(GSK)
的
Strimvelis
在欧洲获批上市;2017年,诺华
(Novartis)
和吉利德
(Gilead)
分别在美国获批上市的CAR-T疗法
Kymriah
、
Yescarta
,以及Spark Therapeutics公司一款基于AAV载体的基因疗法药物
Luxturna
,等等。
全球被批准的基因疗法药物
国内基因疗法的发展布局
尽管基因疗法最初于国外被开发并展开研究,但从上图中不难发现,
世界上首个基因治疗产品其实出现在中国
。在基因疗法发展的历史长河上,中国早在1991年就对B型血友病患者展开了世界上第二次的基因治疗临床试验,并于2003年批准获得了世界上第一个基因治疗产品
今又生
(Gendicine)
。随后在约20年的时间里,中国在基因疗法领域方面做出了不断的努力。
中国基因疗法的里程碑
就目前而言,我国针对基因疗法领域正在进行的临床试验多达20余项
(如下图所示)
;针对的适应症有
A/B型血友病
、β-地中海贫血、转移性非小细胞肺癌、食道癌、Leber遗传性视神经病变(LHON)、自身免疫性缺陷疾病以及各种实体瘤
。
随着基因疗法的布局和发展,运用于基因疗法的各类技术也得到了不断地提升,并实现了突破;与此同时,相应的监管机制和法规条款也在不断更新。
从20世纪70年代起,基因工程技术的发明带动了基因传输、获取和编辑等与基因疗法密切相关的关键技术的开发,一些重要的基因工程技术如基因载体技术、基因克隆技术、基因编辑技术等给现代基因疗法技术带来了深刻的影响。
基因疗法技术的不断突破
目前,基因疗法领域最热门的技术可以说是
AAV载体递送技术
、
CRISPR基因编辑技术
、
单/双碱基编辑技术
以及
溶瘤病毒基因改造技术
等。
(1)腺相关病毒(AAV)载体技术
腺相关病毒
(AAV)
最早于在
20世纪60年代中期
从实验室
腺病毒
(AdV)
制剂中发现,随后很快就在人体组织中被发现。它具有无致病性、高效的长期基因表达、易于基因操作以及免疫反应低
(或在许多情况下缺乏)
的特点,这一系列特性使其成为基因递送的重要工具。
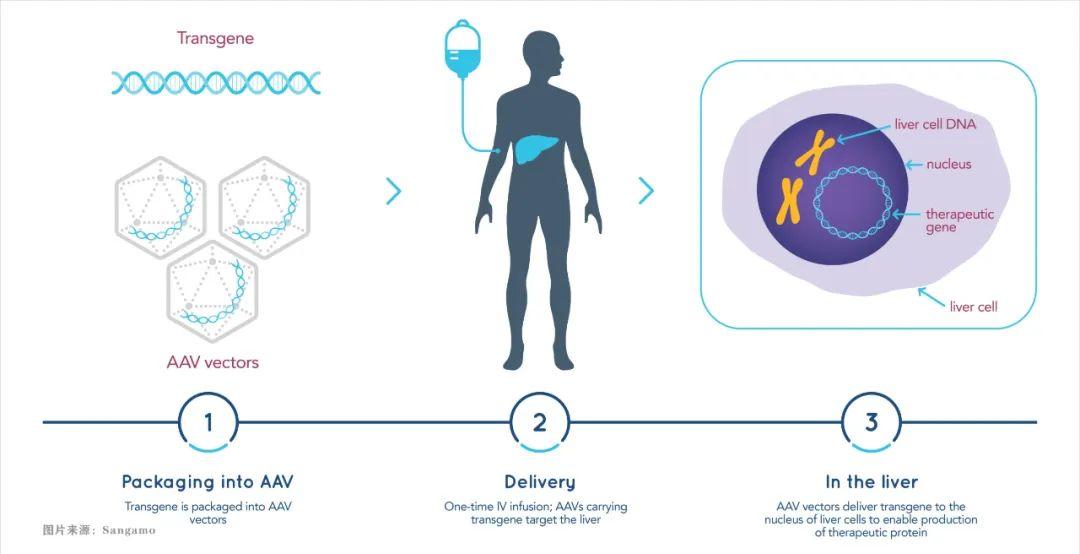
重组AAV载体介导转基因表达的过程
目前,
前沿的AAV基因组设计
能够将衣壳中携带的单链DNA设计成自我互补的序列。这种序列的优点在于它不需要单链DNA复制成为双链DNA的步骤就可以进行转录,与传统的单链AAV基因组相比,它的基因表达更为迅速,而且表达量更高。
至今为止,
全球已有三款以重组AAV为载体的基因治疗药物获批上市
,除了诺华公司的
Zolgensma
(AAV9)
以外,另外两款是UniQure公司开发的
Glybera
(AAV1)
和Spark Therapeutics公司开发的
Luxturna















