
1、关于发布《首批专利权到期、终止、无效且尚无仿制申请的药品清单》的通知
 发布日期:20180129
发布日期:20180129
|
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字﹝2017﹞42号)的要求,引导仿制药研发生产,提高公众用药可及性,我中心筛选出依鲁司他等9个国内化合物专利权到期、终止、无效且尚无仿制申请的国外已上市且具有明确临床价值的药品,现纳入《首批专利权到期、终止、无效且尚无仿制申请的药品清单》并予以公布。
国家食品药品监督管理总局药品审评中心
2018年1月29日
附
首批专利权到期、终止、无效且尚无仿制申请的药品清单
|
序号
|
英文名称
|
中文名称
|
首次上市国家
|
首次上市时间
|
中国化合物专利号
|
中国化合物专利到期日
|
原研公司
|
适应症
|
|
1
|
IngenolMebutate
|
巨大戟醇甲基丁烯酸酯
|
美国
|
2012/1/23
|
/
|
/
|
Leo
|
光化角质病
|
|
2
|
Eliglustat Tartrate
|
依鲁司他
|
美国
|
2014/8/19
|
/
|
/
|
Genzyme
|
戈谢病
|
|
3
|
LaninamivirOctanoate Hydrate
|
辛酸拉尼米韦
|
日本
|
2010/9/10
|
CN1127494C
|
2017/7/22
|
Daiichi Sankyo
|
流感病毒感染
|
|
4
|
Amifampridine Phosphate
|
磷酸阿米吡啶
|
欧盟
|
2009/12/23
|
/
|
/
|
BioMarin
|
肌无力综合征
|
|
5
|
OritavancinDiphosphate
|
奥利万星磷酸盐
|
美国
|
2014/8/6
|
CN1071334C
|
2015/1/27
|
The Medicines Company
|
细菌性皮肤和皮肤结构感染
, 软组织感染, 革兰氏阳性细菌感染
|
|
6
|
LomitapideMesylate
|
甲磺酸洛美他派
|
美国
|
2012/12/21
|
CN1108301C
|
2005/3/30
|
Aegerion
|
纯合子家族性高胆固醇血症
, 高胆固醇血症
|
|
7
|
Tetrabenazine
|
四苯喹嗪
|
美国
|
2008/8/15
|
/
|
/
|
Valeant
|
亨廷顿氏舞蹈症
|
|
8
|
Glycerol phenylbutyrate
|
苯丁酸甘油酯
|
美国
|
2013/2/1
|
/
|
/
|
Hyperion Therapeutics
|
尿素循环代谢障碍
|
|
9
|
Uridine Triacetate
|
尿苷三乙酸酯
|
美国
|
2015/9/4
|
/
|
/
|
Wellstat
|
遗传性乳清酸尿症
, 化疗引起的中毒
|
|

附件
289基药目录中国内特有品种名单
|
序号
|
289
序号
|
药品通用名称
|
剂型
|
规格
|
|
1
|
2
|
盐酸小檗碱片
|
片剂
|
50mg
|
|
100mg
|
|
2
|
45
|
复方氢氧化铝片
|
片剂
|
已批准的所有规格
|
|
3
|
54
|
联苯双酯片
|
片剂
|
25mg
|
|
4
|
68
|
复方利血平片
|
片剂
|
已批准的所有规格
|
|
5
|
73
|
消旋山莨菪碱片
|
片剂
|
5mg
|
|
10mg
|
|
6
|
92
|
制霉素片
|
片剂
|
10
万单位
|
|
片剂
|
25
万单位
|
|
片剂
|
50
万单位
|
|
7
|
97
|
复方甘草片
|
片剂
|
已批准的所有规格
|
|
8
|
110
|
乳酶生片
|
片剂
|
0.15g
|
|
0.3g
|
|
9
|
117
|
甲状腺片
|
片剂
|
40mg
|
|
10
|
162
|
联苯双酯滴丸
|
滴丸剂
|
1.5mg
|
|
11
|
187
|
尼尔雌醇片
|
片剂
|
1mg
|
|
2mg
|
|
5mg
|
|
12
|
207
|
石杉碱甲片
|
片剂
|
50μg
|
|
13
|
218
|
鞣酸小檗碱片
|
片剂
|
50mg
|
|
100mg
|
|
14
|
230
|
石杉碱甲胶囊
|
胶囊
|
50μg
|
|
15
|
236
|
盐酸布桂嗪片
|
片剂
|
30mg
|
|
16
|
253
|
氢溴酸山莨菪碱片
|
片剂
|
5mg
|
|
10mg
|
|
17
|
270
|
复方醋酸甲地孕酮片
|
片剂
|
已批准的所有规格
|
|
18
|
271
|
复方利血平氨苯蝶啶片
|
片剂
|
已批准的所有规格
|
|
19
|
272
|
复方磷酸萘酚喹片
|
片剂
|
已批准的所有规格
|
3、
药审中心发布抗PD-1/PD-L1单抗品种申报上市的资料数据基本要求
 发布日期:20180208
发布日期:20180208
|
为进一步鼓励创新,尽快满足晚期肿瘤患者急迫的临床用药需求,根据我中心组织召开的抗PD-1/PD-L1单抗申报资料要求专题研讨会上,与会企业、专家和CDE审评团队讨论达成的共识,以及会后进一步征求意见,目前已形成了
抗PD-1/PD-L1单抗品种申报上市的资料数据基本要求
,供此类药品的研发和申报资料准备参考。
|

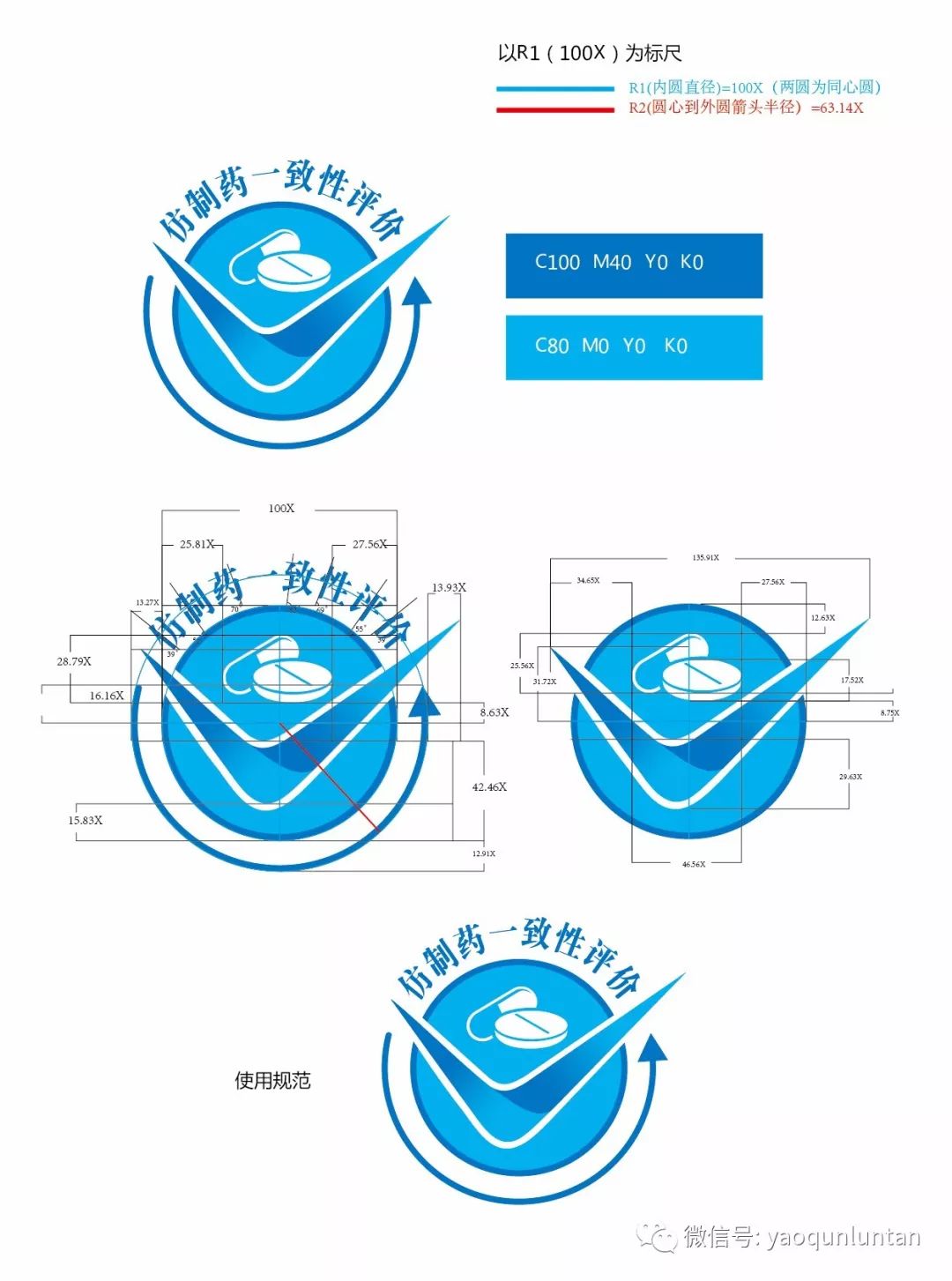
拟纳入优先审评程序药品注册申请的公示(第二十六批)
 发布日期:20180129
发布日期:20180129
|
根据总局《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号),我中心组织专家对申请优先审评的药品注册申请进行了审核论证,现将拟优先审评的药品注册申请及其申请人予以公示,公示期5日。公示期间如有异议,请在我中心网站“信息公开-->优先审评公示-->拟优先审评品种公示”栏目下提出异议。
第二十六批拟纳入优先审评程序药品注册申请公示名单如下:
|
序号
|
受理号
|
药品名称
|
企业名称
|
申请事项
|
理由
|
|
1
|
CXZL1700036
|
苏苏小儿止咳颗粒
|
武汉药谷科技开发有限公司;武汉军谷坊科技开发有限公司
|
新药临床
|
儿童用药品
|
|
2
|
CXSL1700193
|
抗人
CD19 T细胞注射液
|
上海恒润达生生物科技有限公司
|
新药临床
|
使用先进制剂技术、创新治疗手段、具有明显治疗优势的药品注册申请
|
|
3
|
CXSL1700122
|
抗
CD19分子嵌合抗原受体修饰的自体T淋巴细胞注射液
|
成都银河生物医药有限公司;北京马力喏生物科技有限公司;四川大学
|
新药临床
|
使用先进制剂技术、创新治疗手段、具有明显治疗优势的药品注册申请
|
|
4
|
CXSL1700203
|
靶向磷脂酰肌醇蛋白多糖
-3嵌合抗原受体修饰的自体T细胞
|
科济生物医药(上海)有限公司
|
新药临床
|
使用先进制剂技术、创新治疗手段、具有明显治疗优势的药品注册申请
|
|
5
|
CXHS1700024
|
聚乙二醇洛塞那肽
|
江苏豪森药业集团有限公司;上海翰森生物医药科技有限公司
|
新药上市
|
重大专项
|
|
6
|
CXHS1700025
|
聚乙二醇洛塞那肽注射液
|
江苏豪森药业集团有限公司;上海翰森生物医药科技有限公司
|
新药上市
|
重大专项
|
|
7
|
CXHS1700026
|
聚乙二醇洛塞那肽注射液
|
江苏豪森药业集团有限公司;上海翰森生物医药科技有限公司
|
新药上市
|
重大专项
|
|
8
|
CXHS1700021
|
苯环喹溴铵
|
固安世桥制药有限公司;银谷制药有限责任公司
|
新药上市
|
重大专项
|
|
9
|
CXHS1700022
|
苯环喹溴铵鼻用喷雾剂
|
银谷制药有限责任公司;固安世桥制药有限公司
|
新药上市
|
重大专项
|
|
10
|
CXSS1700026
|
利妥昔单抗注射液
|
上海复宏汉霖生物制药有限公司;上海复宏汉霖生物技术股份有限公司
|
新药上市
|
重大专项
|
|
11
|
JXHL1700219
|
Crisaborole
软膏
|
辉瑞制药有限公司
|
新药临床
|
儿童用药品
|
|
12
|
JXSL1700076
|
Emicizumab
注射液
|
罗氏(中国)投资有限公司
|
新药临床
|
儿童用药品,罕见病
|
|
13
|
JXSL1700077
|
Emicizumab
注射液
|
罗氏(中国)投资有限公司
|
新药临床
|
儿童用药品,罕见病
|
|
14
|
JXSL1700078
|
Emicizumab
注射液
|
罗氏(中国)投资有限公司
|
新药临床
|
儿童用药品,罕见病
|
|
15
|
JXSL1700079
|
Emicizumab
注射液
|
罗氏(中国)投资有限公司
|
新药临床
|
儿童用药品,罕见病
|
|
16
|
JXHS1700046
|
奥拉帕利片
|
阿斯利康投资(中国)有限公司
|
新药上市
|
与现有治疗手段相比具有明显治疗优势
|
|
17
|
JXHS1700047
|
奥拉帕利片
|
阿斯利康投资(中国)有限公司
|
新药上市
|
与现有治疗手段相比具有明显治疗优势
|
|
18
|
JYHB1701463
|
普瑞巴林胶囊
|
辉瑞制药有限公司
|
增加新适应症
|
与现有治疗手段相比具有明显治疗优势
|
|
19
|
JYHB1701464
|
普瑞巴林胶囊
|
辉瑞制药有限公司
|
增加新适应症
|
与现有治疗手段相比具有明显治疗优势
|
|
20
|
JYHB1701465
|
普瑞巴林胶囊
|
辉瑞制药有限公司
|
增加新适应症
|
与现有治疗手段相比具有明显治疗优势
|
|
21
|
JYHB1701466
|
普瑞巴林胶囊
|
辉瑞制药有限公司
|
增加新适应症
|
与现有治疗手段相比具有明显治疗优势
|
|
22
|
CXHS1700005
|
苹果酸奈诺沙星氯化钠注射液
|
浙江医药股份有限公司新昌制药厂;太景医药研发(北京)有限公司
|
新药上市
|
专利到期前
1年的药品生产申请
|
|
23
|
CYHS1700332
|
枸橼酸托法替布
|
连云港润众制药有限公司
|
仿制药上市
|
专利到期前
1年的药品生产申请,首家申报
|
|
24
|
CYHS1700333
|
枸橼酸托法替布片
|
正大天晴药业集团股份有限公司
|
仿制药上市
|
专利到期前
1年的药品生产申请,首家申报
|
|
25
|
CYHS1700261
|
拉考沙胺
|
江西青峰药业有限公司
|
仿制药上市
|
申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申请
|
|
26
|
CYHS1700262
|
拉考沙胺片
|
江西青峰药业有限公司
|
仿制药上市
|
申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申请
|
|
27
|
CYHS1700263
|
拉考沙胺片
|
江西青峰药业有限公司
|
仿制药上市
|
申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申请
|
|
28
|
CYHS1700234
|
塞来昔布胶囊
|
江苏恒瑞医药股份有限公司
|
仿制药上市
|
申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申请
|
|
29
|
CYHS1700257
|
多黏菌素
E甲磺酸钠
|
连云港润众制药有限公司
|
仿制药上市
|
重大专项
|
|
30
|
CYHS1700258
|
注射用多黏菌素
E甲磺酸钠
|
正大天晴药业集团股份有限公司
|
仿制药上市
|
重大专项
|
|
31
|
CYHS1700220
|
|

















