癌症干细胞是癌细胞中具有与正常干细胞相关的特征,特别是产生特定癌症组织所有细胞类型的能力。 因此,
癌症干细胞
具有致瘤性(肿瘤形成)
。
使用大量未损伤的细胞治愈受损组织似乎是最有效的修复机制。然而,在通常出现癌症的组织中,例如皮肤,乳腺,肠,脑和血液,
只有少数干细胞群维持和修复组织,而大多数具有复制能力的细胞具有有限的寿命。
为什么多细胞生物会使用这种看似效率低下的组织稳态机制,其中只有少数细胞最终负责修复损伤?答案最有可能是
减少癌症的发病率
。因此,
为了理解癌症,重要的是要了解干细胞的潜在生物学特征以及这些细胞如何分化成组织的成熟细胞。


成体干细胞生物学特征
造血干细胞是最容易理解的哺乳动物成体细胞干细胞, Becker等人的一项开创性研究显示造血干细胞的存在。随后,证明造血干细胞大约是50,000至100,000个有核骨髓细胞中只有1个,并且
单个造血干细胞可在致死辐射的小鼠中再生血液系统。
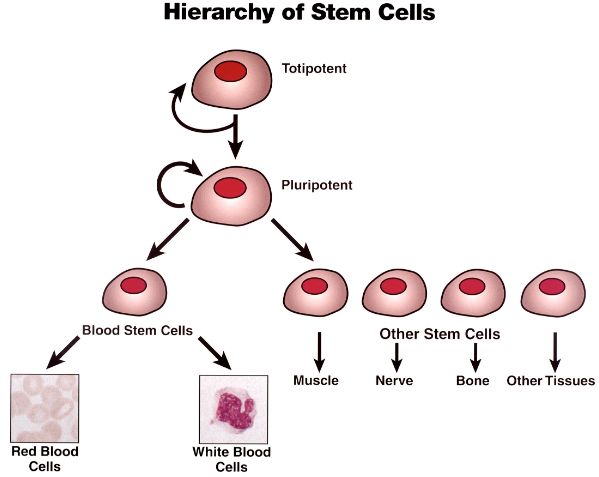
干细胞拓扑图
当造血干细胞分裂时,它们可以产生
祖细胞,最终分化成成熟细胞
,如红细胞,血小板,粒细胞和淋巴细胞;
产生另一种干细胞的细胞分裂称为自我更新
,自我更新细胞分裂产生另一种具有相似能力的干细胞,以在动物的一生中增殖和再生血液系统。
由于不同组织中的干细胞对于特定组织和同一组织产生的癌症是独特的,因此对所有组织中的干细胞进行大量的研究,对于了解特定组织类型的癌症和退行性疾病具有重要意义。细胞外在因子和细胞内在因子均调节每个组织中自我更新的干细胞特性。
干细胞和组织中其他细胞之间的主要区别是表观遗传构成(DNA甲基化和染色质修饰等)
。某些表观遗传调节因子,转录因子和microRNA在干细胞的自我更新中发挥重要作用:例如,染色质修饰因子Bmi1是造血细胞,神经,乳腺和前列腺干细胞自我更新所必需的。 Bmi1通过修饰组蛋白和抑制调控细胞凋亡的基因表达(p19Arf和Tp53途径),衰老( p16ink4a)和干细胞中的差异(Hox基因),但在分化的后代中没有。
干细胞与癌症起始
干细胞是许多组织中存活时间最长的细胞,多种突变必须在癌症中累积。
因此,最初的致癌突变可能发生在干细胞中。对白血病治愈患者的正常造血干细胞进行检查发现,大量造血干细胞携带AML1-ETO突变;这表明原始的白血病前突变发生在血液中的干细胞。
在小鼠和人类中都有证据表明固体肿瘤中最初的致癌突变发生在干细胞中。
在涉及小鼠脑癌,皮肤癌和结肠癌模型的遗传学研究中,单个致癌突变干细胞或更多分化后代表明干细胞突变导致癌症。此外,与AML一样,人脑胶质母细胞瘤突变见于脑室下区的正常神经干细胞,远离原发肿瘤;这表明,与小鼠模型和人类AML一样,人类胶质母细胞瘤的最初突变发生在干细胞中。最初的致癌突变通常涉及控制干细胞功能的表观基因调节因子。
几种关键突变的组合,它们共同激活自我更新程序,同时也使衰老和凋亡失活。
干细胞中的癌前突变
由于致癌突变导致造血细胞克隆性繁殖,因此具有这些突变的患者具有非常高的白血病风险。然而,令人惊讶的是,克隆性造血患者患其他疾病的风险增加,包括心血管疾病和2型糖尿病。其中一些突变发生在IDH1 / 2,DNMT3a / b和TET2等基因中,这些基因与干细胞调节有关。
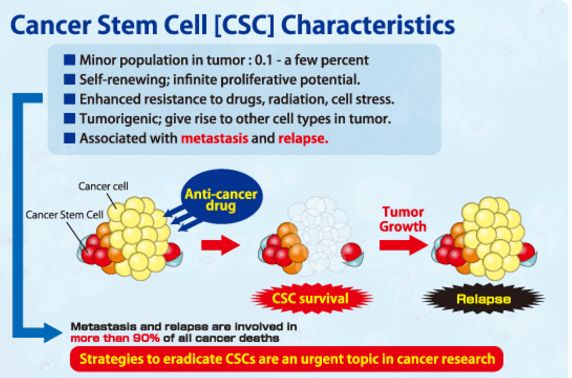
癌干细胞特征
因此,
造血干细胞后代的正常免疫功能的干扰可能导致其他病理状况。
其他组织中正常细胞的基因组测序表明,恶变前突变可能在其他组织干细胞中积累。在胶质母细胞瘤中,大脑中正常的脑室下区干细胞含有明显癌症中的致癌突变。在衰老过程中,食道,皮肤,乳腺和可能的其他组织可能包含癌症中看到的一些突变。
癌症干细胞和预后
癌症干细胞存在于许多骨髓性白血病和实体瘤中
,包括胶质母细胞瘤和乳腺癌,结肠癌和皮肤鳞状细胞癌。实体瘤肿瘤干细胞的初步分离是基于人类样本及移植到免疫缺陷小鼠体内的分析。
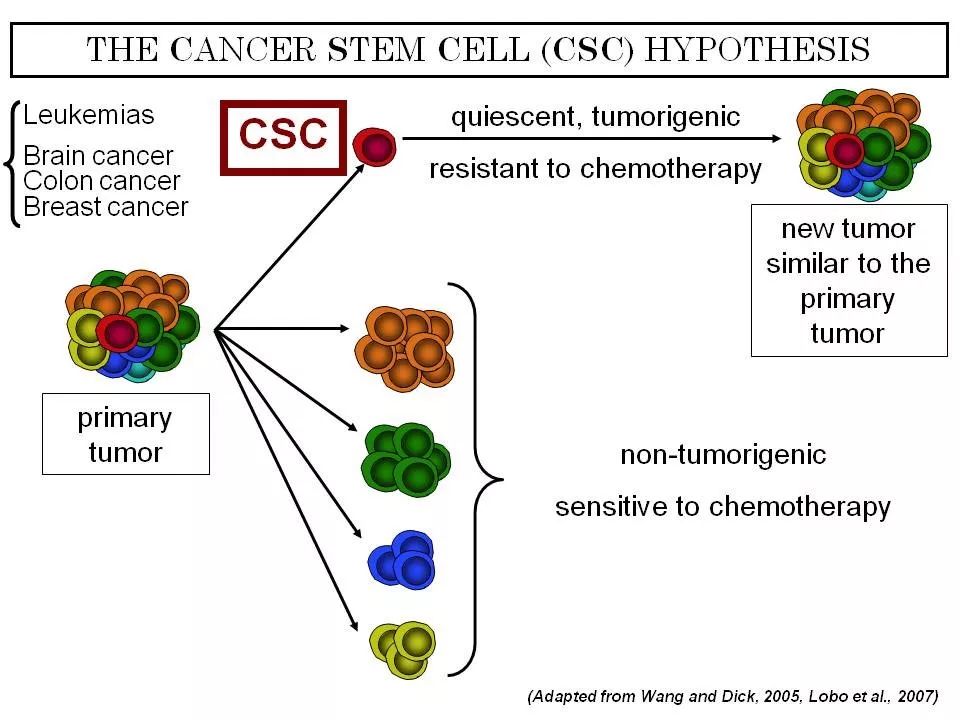
癌干细胞假说
正常干细胞用于调节细胞分化,长期增殖(自我更新),组织修复
,但是分化的表观遗传程序在癌症中被破坏。这导致具有长期生长潜力的细胞的不断扩增。尽管如此,在许多肿瘤中,只有一小部分癌细胞具有在任何时间点自我更新的能力。因此,
术语“癌症干细胞”是功能定义,并不一定表示作为转化的正常干细胞的癌细胞。源自祖细胞的癌症干细胞确实依赖于正常干细胞途径的活化。
此外,
癌细胞经历的突变越多,促进自我更新的途径将被激活的机会越多,抑制自我更新的途径将被抑制。
这与CML进展为急变期以及三阴性乳腺癌和黑色素瘤的观察结果一致。癌细胞长期使用正常干细胞自我更新和组织修复途径;这表明癌症中的干细胞与预后相关。其中,乳腺癌,结肠癌和AML确实如此。
癌症干细胞生物学特征和临床性质
关于癌症干细胞领域的一个主要问题是它是否具有任何临床相关性。
过去几年产生的数据表明它确实如此。例如,使用新的生物信息学方法,发现CDX2是一种生物标志物,可用于量化结肠癌中未分化的原始细胞的数量,大约4%至7%的结肠癌由超过95%的CDX2阴性细胞组成。正如预测的那样,在Dalerba及其同事的研究中,CDX2阴性的II期结肠癌患者的预后非常差。
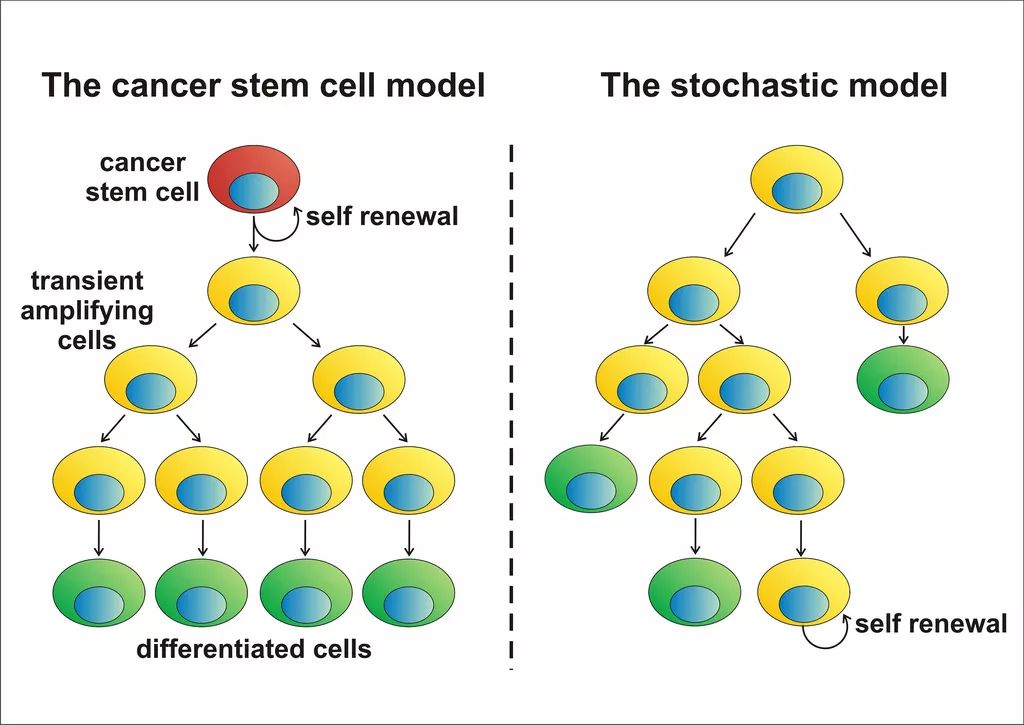
肿瘤干细胞的更新模式
正常干细胞及其癌症干细胞对应物通过多种机制保护自己免受毒素和基因毒性干扰,包括增加DNA修复途径,抗凋亡以及维持低活性氧(ROS)环境。
许多治疗剂,包括放疗及化疗,是通过增加ROS水平来杀死细胞。 KEAP1-NRF2通路是ROS的主要调节因子,肺癌中该通路的突变使细胞耐受辐射。具有KEAP1-NRF2突变的II期或III期肺癌的大多数患者,在放射治疗后复发了他们的疾病,这表明这组患者应该接受替代治疗。
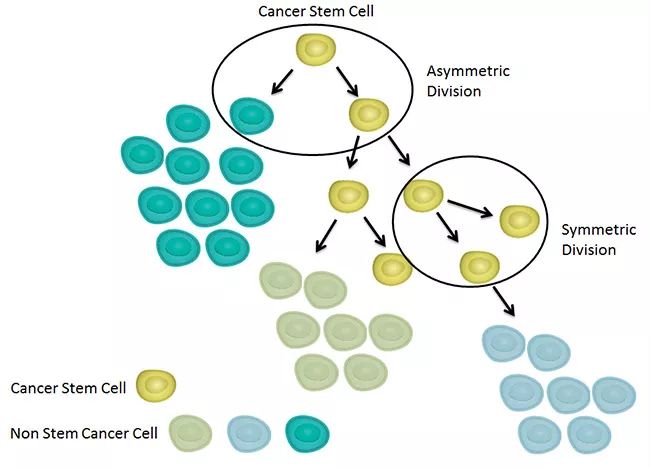
癌干细胞分裂方式
由于癌症干细胞通常对一些标准疗法具有局部抗性,许多针对癌症干细胞的推定药物在临床试验中都失败了
,这种失败有几个原因:错误识别干细胞;失败的另一个原因是许多研究人员认为癌症干细胞是一个单一的,均一的细胞群,并没有考虑到正常和恶性干细胞对环境信号的反应和他们使用的途径不同。
最近,
美国食品和药物管理局批准了三种可以靶向癌症干细胞的新药
。
Vismodegib
是一种hedgehog抑制剂,靶向基底细胞癌中一部分癌症干细胞;
Ivosidenib
是一种抑制异柠檬酸脱氢酶1(IDH1)的基因,被批准用于治疗患者患有复发性白血病。IDH1突变导致(R)-2-羟基戊二酸的积累,其阻断组蛋白去甲基化和细胞分化;
Venetoclax
增加白血病干细胞中的ROS。
干细胞的生物学特征也与免疫疗法有关。
由于干细胞对于修复组织损伤至关重要,因此它们表达保护自身免受免疫损伤的调节因素就不足为奇了。
造血干细胞和可能的其他干细胞表达CD47以保护它们免受巨噬细胞的吞噬作用。
癌细胞可利用CD47保护自身免受巨噬细胞攻击。在最近一项涉及治疗抵抗性非霍奇金淋巴瘤患者的研究中,CD47抑制性抗体在50%的患者中恢复了对利妥昔单抗的敏感性,36%具有完全反应。
癌症干细胞的未来
将癌症干细胞生物学研究转化为临床有很大希望,但尚处于起步阶段。
此外,还有几个问题有待解决,以充分发挥其潜力。首先,需要更好地确定由各种组织引起的肿瘤中的分子和细胞生物学特征。由于致癌突变可以消除癌症干细胞对特定基因的依赖性,显然成功根除癌症干细胞将取决于针对多种癌症干细胞途径的联合疗法。治疗药物必须针对静止和增殖的癌症干细胞,特定突变引起的癌症干细胞群,以及已经获得消除对单一干细胞途径依赖的突变的细胞。
很明显,含有大量突变的肿瘤可能导致靶向癌症干细胞的复杂性。
将来,针对癌症干细胞靶标的小分子抑制剂,生物制剂和免疫疗法的组合可能会进入临床并改善患者预后。
参考信息:
https://www.nejm.org/doi/full/10.1056/NEJMra1804280?query=featured_home