组蛋白修饰H3K4me1和H3K27ac一直被认为是活化态增强子(active enhancer)的重要标记。其中,增强子H3K4me1主要被甲基转移酶Mll3和Mll4催化。但斯坦福大学的Joanna Wysocka课题组发现,mESC的活化态增强子的H3K4me1对eRNA和临近基因的转录都不是必要的。Mll3和Mll4对增强子的活化作用并不依赖于其酶活,而是作为转录共激活因子,促进Pol II在增强子和启动子上的加载。文章发表在2017年5月18日的Molecular Cell上。

原文链接:
http://dx.doi.org/10.1016/j.molcel.2017.04.018
增强子是一种重要的顺式转录元件,活化的增强子的染色质开放度高,结合了很多转录因子,转录共激活因子和RNA Pol II,会激活靶基因的表达。通过对多个物种和大量组织的研究发现,增强子的染色质上经常出现H3K4me1,其中,活化态的增强子上常有H3K4me1和H3K27ac共定位;而只有H3K4me1,没有H3K27ac(有些有H3K27me3)的增强子则是沉默态或poised/primed增强子。增强子活性的变化过程经常伴随着这些组蛋白修饰的变化,在细胞分化、细胞癌变等细胞命运变化的过程中,发挥调控作用。
(有关增强子的相关研究,可参考:
Plus
深读 | Nature Biotech: 如何研究基因组中的非编码序列?
Plus深读 | eRNA激活增强子的乙酰化?
【Plus深读】Nature Comm:原发性胃癌的超级增强子异质性分析
)
其中,增强子上的H3K27ac可以招募阅读蛋白BRD4,进而招募Mediators和Pol II,激活靶基因。而H3K4me1在增强子上的功能,仍不明确。
哺乳动物的H3K4me可以被MLL1-MLL5, SET1A, SET1B催化形成。之前的研究发现,Mll3(又叫Kmt2c, HALR)和Mll4(又叫Mll2, Kmt2d, ALR)结合在增强子上,催化H3K4me1
[1-3]
,并招募转录共激活因子p300催化产生组蛋白乙酰化,激活增强子
[2-4]
。Mll3/4缺失会下调增强子活性。基于此,人们普遍认为H3K4me1可调控增强子及其靶基因的活性。
而Joanna Wysocka课题组在mESC中突变Mll3和Mll4的酶活中心,使其不能催化增强子H3K4me1,却发现增强子及靶基因活性几乎不变(增强子H3K27ac略微下调)。但双敲除Mll3/4,则会引起H3K27ac的明显下调,eRNA及附近基因转录活性的显著下降。因此,作者认为,
Mll3/4激活增强子的作用与其催化H3K4me1的活性无关。
一、Mll3/4双敲除及酶活突变体mESC细胞系的构建
首先,作者构建了Mll3/4双敲除(记为dKO)和Mll3 Y4792A, Mll4 Y5477A双酶活突变(记为dCD)的mESC细胞系。(研究者也曾构建切除C端SET结构域的Mll3/Mll4细胞系,但发现这会引起蛋白质不稳定,使得western blot检测不到MLL3/4蛋白。所有的Mll3/4WT及突变结构示意图见图1B。)在WT mESC中,约30%的组蛋白含有H3K4me1修饰,而H3K4me2占约1.4%,H3K4me3约占0.35%。Mll3/4 dKO或dCD会引起H3K4me1下降一倍到15%,而H3K4me2和H3K4me3没有显著变化(图1A)。dCD不影响Mll3/4的蛋白量(图1C),也不影响Mll3/4与UTX和Rbbp5的相互作用(图1D)。dCD不影响Mll3/4在增强子上的定位(图1E),这些增强子在WT mESC中存在H3K4me1, H3K27ac, Pol II的共定位,并且有nascent RNA的转录,他们和Mll3/4的结合正相关。Promoter上的Mll3/4结合较弱,H3K4me1信号也较弱,有Mll2,H3K4me3, H3K27ac, Pol II的共结合,以及nascent RNA的转录(图1F)。
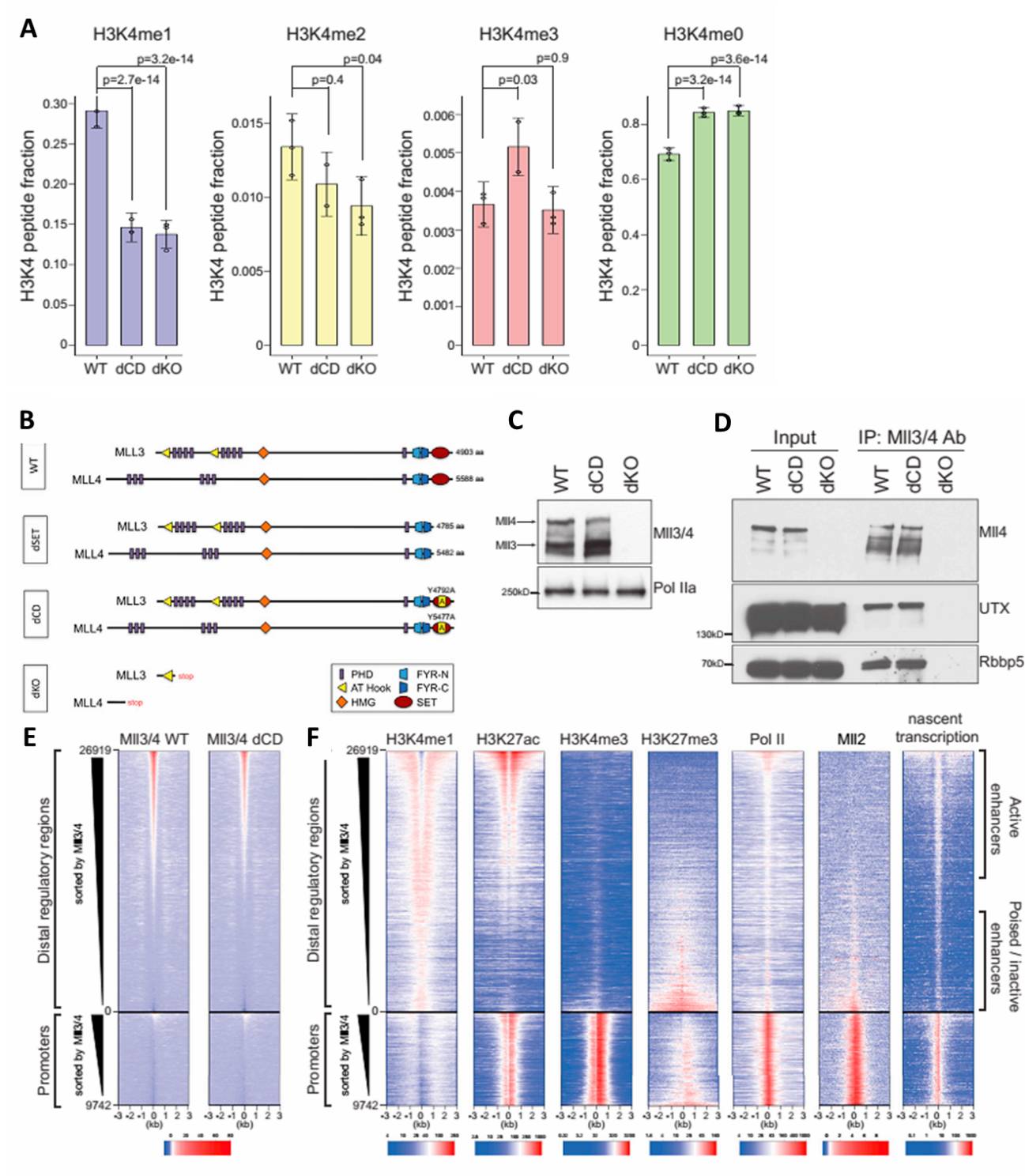
图 1 确认Mll3/4 酶活突变(dCD)及双敲除(dKO)的mESC细胞系构建成功
下一步,研究者检测了Mll3/4双酶活突变(dCD)和Mll3/4双敲除(dKO)对增强子组蛋白修饰的影响。他们发现,dCD和dKO都会使得Mll3/4结合的增强子的H3K4me1降低(其中dCD比dKO更能引起Mll3/4 结合的增强子H3K4me1降低,分析讨论详见延伸思考);而对于H3K27ac来说,dCD只能引起H3K27ac微弱下调,dKO却能引起H3K27ac显著下降。UCSC genome browser tracks见图2A;热图见图2B~2F;Mll3/4结合的增强子的H3K4me1和H3K27ac下降见图2D,图2G;Mll3/4不结合的增强子的H3K4me1和H3K27ac在dCD和dKO中几乎不变,见图2E,图2H。
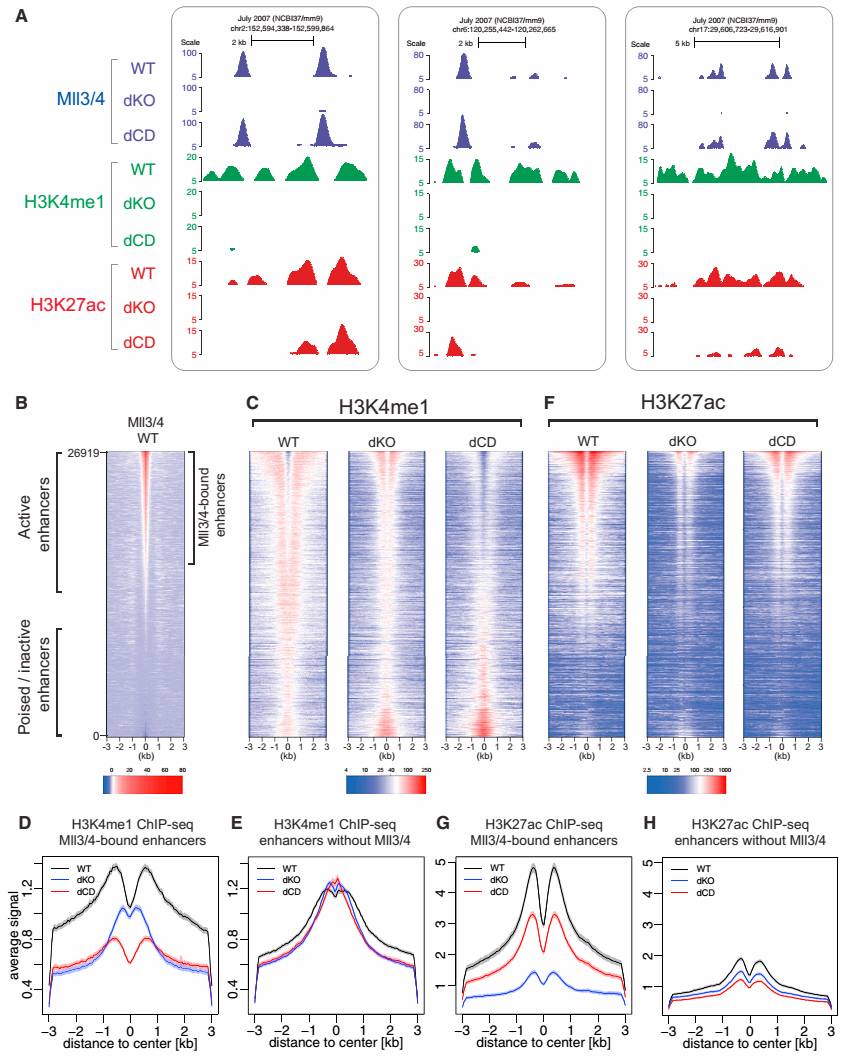
图 2 Mll3/4突变对增强子经典组蛋白修饰的影响
三、Mll3/4双敲除会引起靶基因转录下调和增强子Pol II加载,但Mll3/4酶活突变不会。
研究者发现,敲除Mll3/4后,会使Mll3/4结合启动子的基因,以及Mll3/4结合增强子附近5kb的基因的表达下调(图3A,3C)。但Mll3/4酶活突变体则对这些基因影响不大(图3B,3D)。Pol II ChIP-seq发现,WT mESC中,在Mll3/4结合的增强子上,Pol II和Mll3/4共富集。dKO会使得Pol II在这些位点的结合明显下降,而dCD则不会产生影响(图3D,3F)。在Mll3/4不结合的增强子上,Mll3/4 dKO和dCD对Pol II的加载都不影响(图3G)。这说明Mll3/4的蛋白对靶基因的转录,以及增强子的活性是必要的,但其酶活不是必要的。
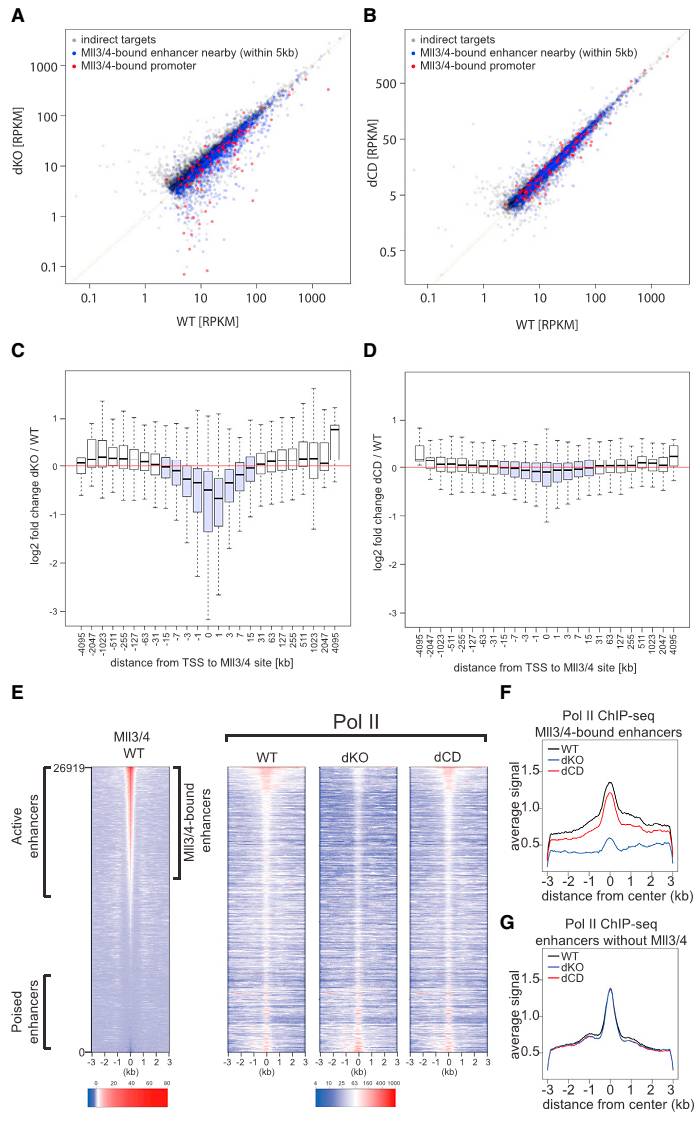
图 3 Mll3/4双敲除会引起靶基因转录下调和增强子Pol II加载,但Mll3/4酶活突变不会。
四、
增强子Mll3/4对eRNA和临近基因的转录是必要的,但不依赖于酶活
研究者在增强子上,进行了start-seq(检测eRNA的技术:将细胞核的小RNA提取出来,去掉cap,分正负链建库测序),发现Mll3/4结合的增强子的正负链eRNA,在dKO中明显下调(图4A, 4C),但dCD对这些eRNA无影响(图4A)。在Mll3/4不结合的增强子上,dKO和dCD都对正负链eRNA没有明显影响(图4B)。这说明Mll3/4的蛋白对其结合的增强子的活性是必要的,但Mll3/4的酶活并不必要。
然后,研究者检测了Mll3/4 dKO对Mll3/4结合增强子的临近基因的转录的影响。研究发现,Mll3/4 dKO虽然不太影响临近基因的Pol II在启动子上的加载(图4E, 4G, 4H),但却使得Pol II难以延伸到genebody中去(图4I),从而下调了临近基因的转录(图4F)。dCD对Pol II在genebody的延伸无影响(图J)。这说明增强子的Mll3/4蛋白对附近基因的Pol II释放到genebody中是必要的。但其酶活不是必要的。
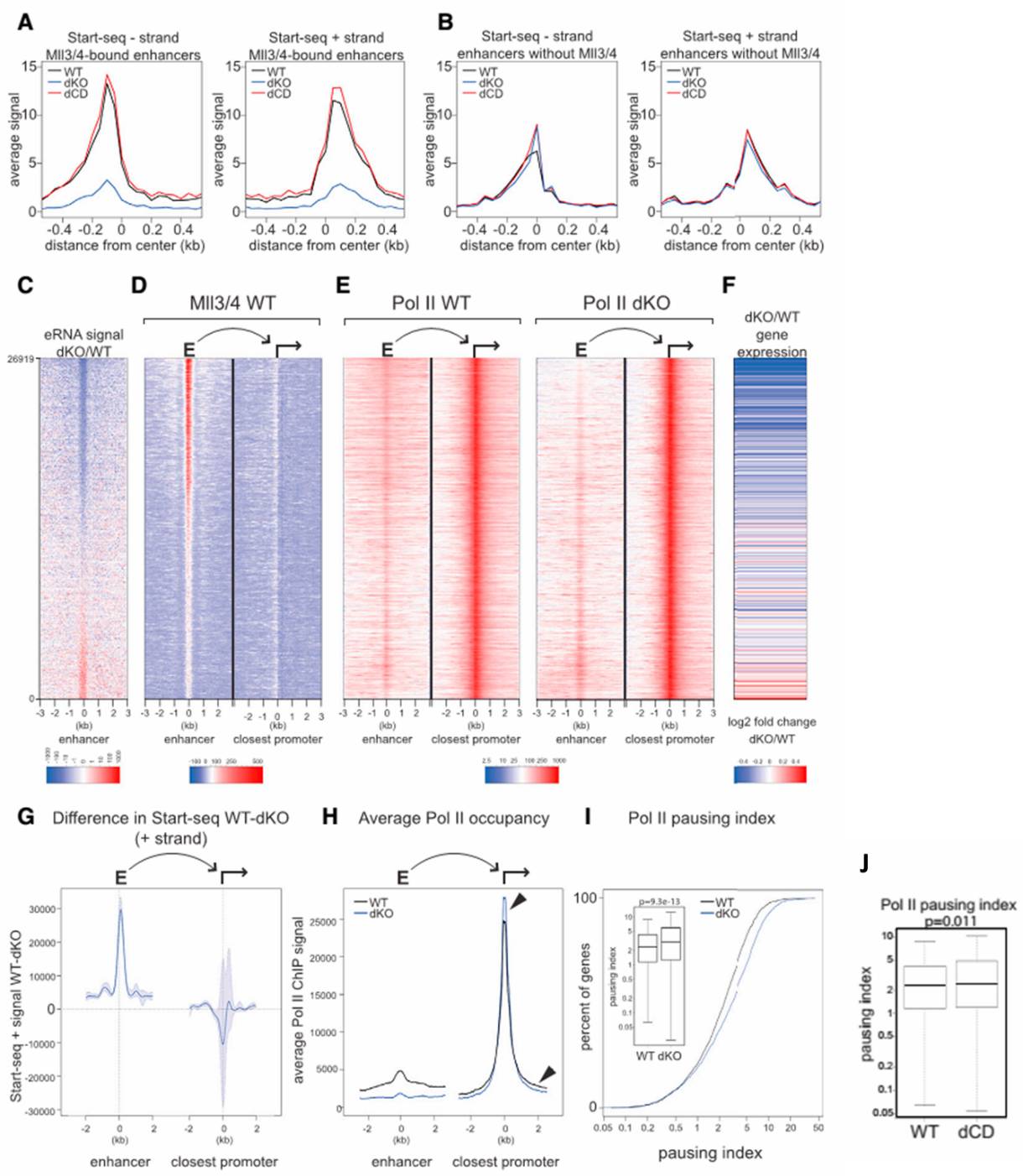
图 4 增强子Mll3/4对eRNA和临近基因的转录是必要的,但不依赖于酶活。
-
活化态增强子经常被H3K4me1和H3K27ac标记,H3K4me1的甲基转移酶Mll3/4又的确介导了活化态增强子的产生,因此,人们普遍认为H3K4me1可调控增强子及其靶基因的活性。而本文发现了Mll3/4激活增强子的作用与其催化H3K4me1的活性无关,H3K4me1对于活化态增强子的活性不是必须的。
这提醒我们需要注意这些酶类转录共激活因子的
非酶活依赖的作用。
并且蛋白或表观修饰在基因组上的
共定位,不代表他们之间存在调控关系。
-
有关Mll3/4在增强子活化过程中的作用,NIH的戈凯课题组利用脂肪细胞分化模型,做出了很详细的工作。他们的研究发现,脂肪前体细胞分化为脂肪细胞的过程中,pioneering factor PPARγ, CEBPα/β首先结合到分化时需要被激活的增强子上,招募MLL3/4, 加上H3K4me1, 并开打染色质。MLL3/4招募p300到染色质上,加上H3K27ac,招募H3K27ac阅读器BRD4。BRD4招募增强子蛋白复合物Mediators,Mediators结合更多转录因子/转录共激活因子和Pol II,产生eRNA 转录及附近的脂肪分化相关基因转录。
[3,5]
可以看到,MLL3/4蛋白在增强子激活过程中的非酶活作用的确很重要。
-
MLL3/4在分化发育过程中扮演了重要角色,MLL3/4对脂肪,肌肉,乳腺,B细胞,T细胞,心脏,精子等多类细胞的发育都是必要的。戈凯课题组的研究也发现,Mll3/4对体细胞重编程为iPSC,以及mESC向三个胚层的方向分化,都是必要的。但Mll3/4敲除不影响mESC的生长维持。
[3,6]
而本文的研究中,并没有检测Mll3/4的酶活对mESC的分化是不是必要的。有可能H3K4me1对
已经活化的增强子的活性
维持不重要(因为H3K27ac已经在那里了)。但
在细胞命运改变的过程
中,H3K4me1在增强子上的建立可能是有重要作用的。
-
按照以上模型,Mll3/4主要在活化态增强子上起作用。但还有很多增强子并不处于活化态,很多增强子上只有H3K4me1,没有H3K27ac,有些还有抑制性的标记H3K27me3。这些增强子有些在分化后才会被激活,有些在分化后会被完全抑制。这些增强子提供了不同细胞分化方向的可能性。那么这些增强子上的H3K4me1是否有作用,有什么作用,是谁催化的,都还有待研究。
值得注意的是,在图2B,2C中,可以看到在Mll3/4结合较弱的增强子上,Mll3/4 dCD或dKO都会引起其H3K4me1上升;在Mll3/4结合最强的增强子上,dKO后仍保留着部分的H3K4me1. 这表明还有其他甲基化酶参与催化增强子H3K4me1,但并不会引起H3K27ac明显上升,该酶可能会代偿或竞争Mll3/4的作用。
-
我们仍不清楚增强子为何有
H3K4me1
的标记。
-
本文只研究了Mll3/4结合的增强子对附近基因的转录调控的作用,发现Mll3/4催化的H3K4me1对附近基因的转录激活没有明显作用,但他们并未检测这些增强子对远端的靶基因调控是否受H3K4me1的影响。
-
本文无法回答增强子
eRNA
的产生与靶基因转录之间的关系。
Mll3/4 dKO
同时影响了增强子上的
Pol II machinery
,
eRNA
转录信号,以及
eRNA
分子。目前还未确认这三者在调控靶基因转录中的具体作用。
[1] Herz H M, Mohan M, Garruss A S, et al. Enhancer-associated H3K4 monomethylation by Trithorax-related, the Drosophila homolog of mammalian Mll3/Mll4[J]. Genes & Development, 2012, 26(23): 2604-2620.
[2] Hu D, Gao X, Morgan M A, et al. The MLL3/MLL4 branches of the COMPASS family function as major histone H3K4 monomethylases at enhancers[J]. Molecular and Cellular Biology, 2013, 33(23): 4745-4754.
[3] Lee J, Wang C, Xu S, et al. H3K4 mono- and di-methyltransferase MLL4 is required for enhancer activation during cell differentiation.[J]. eLife, 2013.
[4] Wang C, Lee J, Lai B, et al. Enhancer priming by H3K4 methyltransferase MLL4 controls cell fate transition.[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(42): 11871-11876.
[5] Cho Y W, Hong S H, Jin Q, et al. Histone Methylation Regulator PTIP Is Required for PPARγ and C/EBPα Expression and Adipogenesis[J]. Cell Metabolism, 2009, 10(1):27-39.
[6] Froimchuk E, Jang Y, Ge K. Histone H3 lysine 4 methyltransferase KMT2D.[J]. Gene, 2017, 627:337-342.















