作者 l
放翁是水货
编辑
l
细胞房间
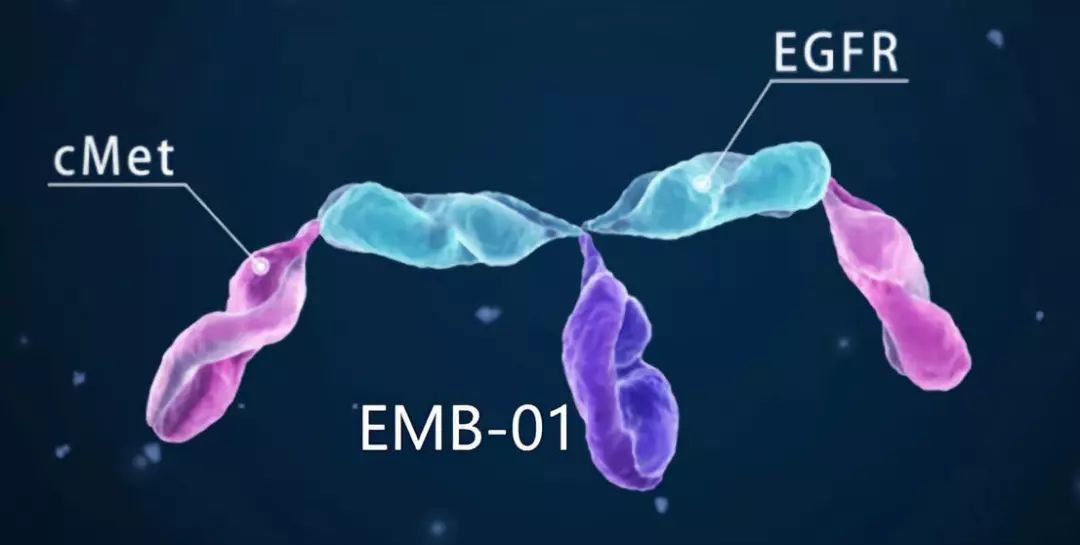
岸迈生物的双特异性抗体临床研究已经完成患者招募
1月28日,中国,EpimAb生物制药公司今天宣布其在研新药EMB01的全球I/II期临床研究已经完成第一阶段的剂量探索研究的患者招募工作,EpimAb初期着重评估EMB01用于治疗晚期实体瘤患者的疗效和安全性。EMB01是一种双特异性抗体,基于其专有的FIT-Ig技术平台开发而成,能够同时靶向两种受体 EGFR和cMET,在多种临床前实体瘤模型中通过同时抑制肿瘤两种生长受体介导的信号转导显示出显著且持久的抗肿瘤活性。这一结果也进一步暗示,这种EGFR/cMet双特异性抑制的新作用机制未来可能用于更广泛患者群体的治疗。
Imbruvica加obinutuzumab的组合疗法给白血病初治患者带来显著生存获益
1月28日,强生和艾伯维公司共同宣布美国FDA已经批准Imbruvica与obinutuzumab联用作为一线疗法治疗未接受过治疗的慢性淋巴性白血病和小淋巴细胞淋巴瘤(CLL/SLL)患者。这是第一款获得FDA批准治疗该病的一线非化疗组合疗法,此次组合疗法的获批是基于一项III期临床试验的结果,Imbruvica加obinutuzumab的组合显著改善无进展生存期,将疾病进展或死亡风险降低77%。Imbruvica是一种口服布鲁顿氏酪氨酸激酶(BTK)抑制剂,通过阻断BTK信号通路,Imbruvica可以抑制B细胞的正常增殖,目前该药已经获批治疗多种血液肿瘤。
ULTOMIRIS治疗非典型溶血性尿毒症综合征的III期临床获得积极进展
1月29日,美国,Alexion今天宣布该公司的长效C5补体抑制剂ULTOMIRIS(ravulizumab-cwvz)治疗非典型溶血性尿毒症综合征(aHUS)初治患者的III期临床研究达到主要终点。试验数据显示,在26周的治疗周期内,53.6%的患者其血栓性微血管病(TMA)症状得到完全缓解,其中通过血小板计数正常化以评估血小板减少症状况,83.9%的患者症状缓解,通过乳酸脱氢酶(LDH)水平正常化比率测得76.8%的患者溶血减少,58.9%的患者血清肌酐水平从基线提高≥25%,肾功能获得改善。ULTOMIRIS的安全性与此前开展的阵发性睡眠性血红蛋白尿症(PNH)的两项大型III期研究中观察到的结果一致。本研究中最常见的不良事件是头痛,腹泻和呕吐,最常见的严重不良事件是肺炎和高血压,在受试重症患者中,有4例患者死亡,均与ULTOMIRIS治疗无关。
非典型溶血尿毒综合征是一种超罕见的慢性补体失调性疾病,补体调控蛋白H因子、以及膜辅助蛋白和血清补体固有成分的基因突变都可参与其发病,病情易反复,预后很差,25%的患者在急性期死亡,50%以上发展为终末期肾病。非典型溶血性尿毒症综合征的最主要特点有三:
微血管溶血性贫血、血小板减少及肾功能衰竭
。
小编点评:
现有的研究数据表明ULTOMIRIS可以为患者带来显著的临床获益,有可能成为aHUS患者的新标准治疗。
Momenta的高唾液酸化免疫球蛋白已经开启I/II期临床研究
1月29日,美国,Momenta制药今天宣布在研新药M254的I/II期临床试验已经完成了第一位受试者的给药。这项
I/II
期研究将招募正常健康志愿者和免疫性血小板减少性紫癜(ITP)患者,以安慰剂作为对照,进行随机双盲交叉试验评估该药物的安全性和初步的临床疗效,其最终的目的是证明在ITP和其他炎症性疾病中高唾液酸化IgG比静脉注射免疫球蛋白(IVIg)更有效。
静脉注射用免疫球蛋白是由健康供体的混合血浆制备的治疗性血液产品,已用于治疗各种急性和慢性自身免疫性和全身性炎性疾病超过30年。尽管IVIg在炎性疾病中具有不错的疗效,但疗效的波动性和给药方式限制了其临床应用。目前的研究已经确定了Fc-唾液酸化的重要抗炎作用,新的体外抗体Fc-唾液酸化技术为高唾液酸化免疫球蛋白的研发提供了新的机会。M254就是运用这一技术开发的具有抗炎活性的Fc-唾液酸化免疫球蛋白,在临床前试验中,M254在各种自身免疫疾病动物模型中的效力至少比IVIg产品高10倍。
Pfizer和Lilly公布了tanezumab治疗骨关节疼痛(OA)III期临床的最新结果
1月29日,美国,辉瑞和礼来公司今日宣布一项评估tanezumab治疗中度至重度骨关节炎疼痛的III期临床研究达到主要临床终点。这是一项正在进行中的评估tanezumab治疗对至少三种不同类型的镇痛药的无应答或不耐受的骨关节炎疼痛疗效的III期临床,在该研究中平均患有OA超过六年的患者,每8周评估皮下注射tanezumab 2.5mg或5mg,进行为期24周治疗。试验数据表明,与接受安慰剂的患者相比,接受tanezumab治疗的患者其疼痛状况和身体运动机能均获得显著改善。初步安全性数据显示,在24周治疗期间,tanezumab具有良好的耐受性, tanezumab组和安慰剂组患者观察到相似的不良事件发生率。
骨关节炎为一种退行性病变,系多因素引起的关节软骨退化损伤、关节边缘和软骨下骨反应性增生。临床表现为缓慢发展的关节疼痛、压痛、僵硬、关节肿胀、活动受限和关节畸形等。Tanezumab是一种人源化单克隆抗体,属于神经生长因子(NGF)抑制剂。目前用于OA疼痛治疗的选择不能满足所有患者需要,tanezumab具有不同于其他镇痛药物的新机制,现有的数据表明tanezumab并不表现出成瘾性,患者对其依赖性较低。
Genentech公司宣布终止crenezumab治疗早期AD的临床研究
1月30日,Genentech公司今天宣布决定停止抗β-淀粉样蛋白抗体crenezumab治疗早期散发性阿尔茨海默病的III期研究。这是一项为期两年的全球、随机、双盲、安慰剂对照研究,主要是在全球1500名早期AD患者中评估crenezumab的疗效和安全性,并期望证实脑β淀粉样蛋白这一病理学假说。Crenezumab是一种在研单克隆抗体,可以优先结合并促进神经毒性寡聚体的去除。此次终止研究的决定是基于此前中期分析的结果,独立数据监测委员会的分析表明crenezumab达到临床痴呆评分这一主要终点的可能性不大,有关该研究的详细数据将在后续的医学大会上进行分享。
Teva公司的fremanezumab有望在2019年获批用于偏头痛的治疗
2月1日,以色列,Teva 公司今天宣布CHMP对于AJOVY®(fremanezumab)治疗偏头痛的上市申请予以积极推荐,欧盟委员会预计2019年上半年将做出最后批复,如果得到欧盟委员会的批准,该药将成为欧洲第一个抗CGRP药物。AJOVY是一种人源化单克隆抗体,可与降钙素基因相关肽配体结合,适用于偏头痛患者的治疗。偏头痛是一种常见的慢性神经血管性疾患,女性多见,常有遗传背景。偏头痛是临床最常见的原发性头痛类型,临床多以发作性或搏动样头痛为主要表现,可伴有恶心、呕吐等症状。
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]















