下篇:立足全球、展望国内的生物药行业投资指南,第9-10章
9 、他山之石:生物药跨国巨头的成长之旅
随着生命科学的发展和生物技术的突破,二十世纪七八十年代,一些不满足于仅在科研单位从事研究工作的美国科学家,看准当代生命科学在健康医疗领域的巨大应用前景,相继成立了一批新型的生物医药公司,开展生物药的研发和商业化生产、销售。
目前全球生物医药产业领头羊当属创建于1980年的安进(Amgen)公司,它拥有强大的研发能力和产品优势,坚持在疾病治疗的生物技术领域内发展,涉及人类基因组、癌症、神经科学和小分子化学等领域,然而其在发展初期并不顺利,由于一直没有产品上市,先后于1983,1986和1987年三次公开发行股票筹集资金才得以维持公司的生存。另一家历史悠久的生物技术公司就是成立于1976年的基因泰克(Genentech)公司,该公司被誉为生物医药产业历史的起点,是一家以科学创新的研究为导向的公司,三十多年来共研发了20多种生物药,实力和规模仅次于安进,最终于2009年被罗氏公司完全收购。生物药新星莫过于成立于1988年的再生元(Regeneron)公司,初始定位于神经生长因子的研究,历经十七年,公司在神经系统领域的研发均以失败而告终,但公司从未放弃过努力,积极调整思路,开发出了两款可以阻断特定细胞表面或分泌蛋白的技术平台,以此开发新药,在21世纪翻转了新的历史界面,取得巨大成功。
以下是这三家代表性医药巨头的详细介绍:
9.1Amgen (安进)
9.1.1 Amgen的起步与发展历程
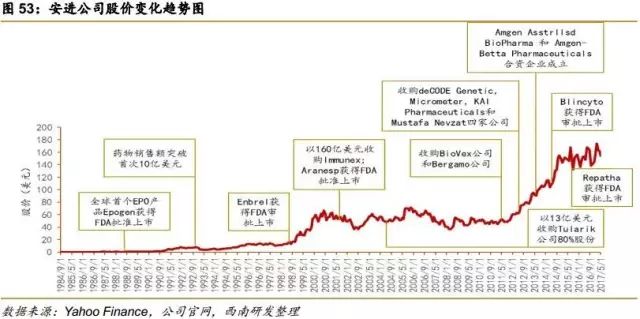
安进公司由三位风险投资家(Bill Bowes,Frank Johnson,Sam Wohlsteader)和一位MIT化工系教授Raymond Baddour于1980年4月8日创立,公司位于学术氛围很浓的加州Thousand Oaks,紧邻加利福尼亚大学和加州理工学院。首任CEO是原供职于雅培公司的George B.Rathmann博士,George在安进公司做了大量贡献:①没有任何产品上市且规模只有7名成员的情况下,为安进拉来1900万美金的风险投资;②在未有产品问世的情况下,凭着实验室研发成果,于1983年把公司包装上市,融来4300万美元;③开发了EPO(Epogen,红细胞生成素)和G-CSF(Neupogen,重组粒细胞集落刺激因子)两大当家药物。
1984年,安进公司与日本麒麟公司合资4450万美元用于EPO商业化生产。1985年,安进与强生达成1000万美元交易,以渡过资金难关。1986年,公司出售股票230万股给Smith Klin公司,获得融资3450万美元。1987年,公司通过增发股票,筹资7500万美元。至此,安进先后融资总计22600万美元。
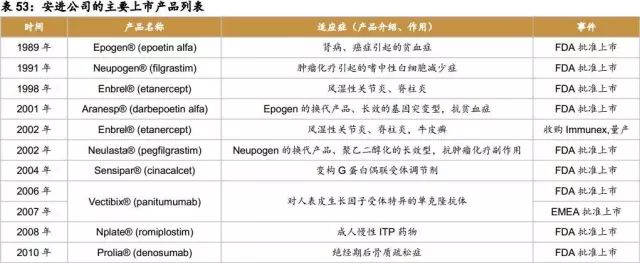
1989年,Epogen®(epoetin alfa) 获得美国FDA批准,用于治疗慢性肾功能衰竭引起的贫血和癌症引起的贫血,上市三个月销售额达到1600万美元。同一年,安进在瑞士卢塞恩设立欧洲总部,公司走向国际化。
1991年2月,公司第二个产品重组粒细胞集落刺激因子Neupogen(filgrastim,G-CSF)获得FDA审批,其适应症为肿瘤化疗引起的嗜中性白细胞减少症。
2001年12月安进公司宣布,以160亿美元并购治疗风湿性关节炎、脊柱炎,牛皮癣的Enbrel的开发商Immunex,以扩大生产和销售。
2001年,Epogen的换代产品、长效的基因突变型的Aranesp获得FDA批准上市,上市第三年,销售额冲上15.44亿美元;
2002年,Neupogen的换代产品、聚乙二醇化的长效型G-CSF Neulasta获得FDA审批,用作抗肿瘤化疗副作用的新药。
2004年,安进以价值13亿美元的股票收购杜拉瑞克公司(Tularik)80%的股份。
2006年9月,FDA批准了靶向人表皮生长因子受体(也称为EGF受体,EGFR,ErbB-1和HER1)的全人源单克隆抗体Vectibix(Panitumumab),同时Vectibix也于2007年获得EMEA批准上市。
2008年,用于治疗成人慢性ITP(特发性血小板减少性紫癜)的药物Nplate(romiplostim)获得FDA批准。
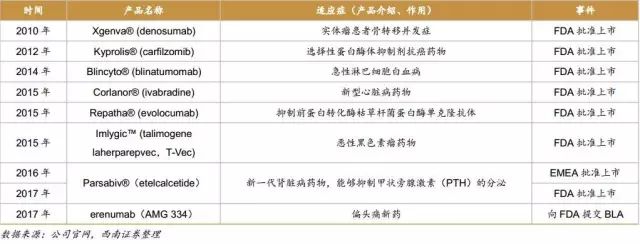
2010年,治疗绝经期后骨质疏松症的药物Prolia和预防实体瘤患者骨转移并发症的药物Xgeva依次获得FDA批准。
2011年,Amgen在爱尔兰都柏林附近收购了一家制造工厂和talimogene laherparepvec的开发商BioVex公司,并扩展了巴西市场,收购了Bergamo公司。
2012年,FDA批准了选择性蛋白酶体抑制剂抗癌药物Kyprolis。同年,安进收购deCODE Genetics,Micromet公司,KAI Pharmaceuticals和土耳其制药公司Mustafa Nevzat。
2013年,Amgen Astellas BioPharma K.K.日本联盟和Amgen-Betta Pharmaceuticals合资企业成立。
2014年,治疗急性淋巴细胞白血病的生物药物Blincyto获得FDA审批上市。随后,抑制前蛋白转化酶枯草杆菌蛋白酶/ kexin 9型(PCSK9)的完全人单克隆抗体Repatha于2015年获得FDA审批上市。Parsabiv,一种用于治疗接受血液透析的患者继发性甲状旁腺功能亢进的拟钙剂,于2016年获得EMEA批准,并于2017年获得FDA审批上市。
9.1.2安进公司产品线
9.1.3代表性重磅产品
Enbrel(恩利,依那西普):是缓解疾病的抗风湿性药物(DMARD),用于治疗类风湿关节炎(RA)和强直性脊柱炎(AS)。目前,恩利在中国被批准用于治疗:①中度至重度活动性RA的成年患者,对包括甲氨蝶呤(如果不禁忌使用)在内的DMARD无效时,可用依那西普与甲氨蝶呤联用治疗;②重度活动性AS的成年患者,对常规治疗无效时可使用依那西普治疗。2014-2016年,恩利的全球销售额分别为47、54和60亿美元。
Neulasta(培非格司亭):是白细胞刺激药物Neupogen的长效制剂,可以刺激抗感染后白细胞(中性粒细胞)的产生,其在每个化疗疗程中只需要使用一次,主要适应症是用于减低化疗过程中感染的发生率,这种感染常常表现为中性粒细胞减少症相关的发热(即发热与抗感染引起的白细胞数量严重下降)。2014-2016年,培非格司亭的全球销售额分别为46、47和46亿美元。
9.1.4安进公司股价表现
9.2 Genentech(基因泰克)
9.2.1 Genentech的起步与发展历程
1976年4月7日,基因泰克公司由风险投资家Robert A. Swanson和生化学家Herbert Boyer教授创建。
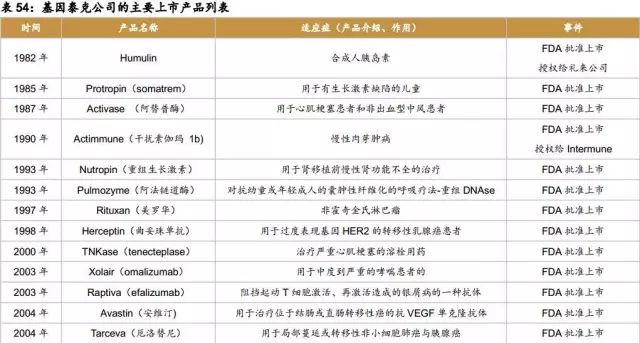
1977年,基因泰克公司通过微生物(大肠杆菌)首次制造出人体蛋白(生长激素抑制素)。
1980年10月14日公司股票公开发行,并在纳斯达克上市,在发行上市中,基因泰克以12%的股份筹集了3600万美元,投入到新药的生产开发中。
1982年,第一种DNA重组药品人工胰岛素产品(Humulin)获FDA核准上市,礼来公司得到制造特许权。
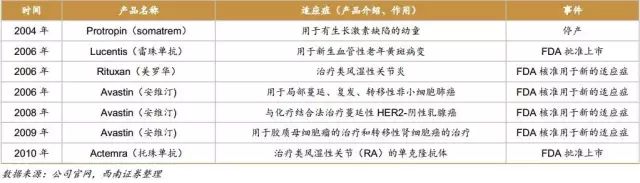
1985年,Protropin(somatrem)获FDA核准上市,该药物是用于治疗有生长激素缺陷的儿童的次级生长激素(已于2004年停产)。
1987年,Activase(阿替普酶)获得FDA核准上市,这是一种重组组织型纤维蛋白溶酶原激活物(tPa),可以溶解严重心肌梗塞的患者的血块,也被用来治疗非出血型中风。
1988年,基因泰克公司的总收入达到3.4亿美元,总资产和净资产分别达到6.7亿美元和4.0亿美元。
1989年,用于急性大块肺血栓治疗的Activase经FDA批准上市。同年,公司和瑞士的贝赛尔罗西有限公司完成了21亿美元的兼并。
1990年,瑞士的罗氏出资21亿美元,购买基因泰克公司60%的股份。
1992年,基因泰克公司和罗西公司达成合作开发、注册和销售Pulmozyme的协议。
1990年,用于慢性肉芽肿病治疗的Actimmune(干扰素伽玛 1b)授权给Intermune公司制造。
1993年,重组生长激素Nutropin和阿法链道酶Pulmozyme获得FDA批准上市,分别用于肾移植前慢性肾功能不全的治疗和对抗幼童或年轻成人的囊肿性纤维化的呼吸疗法-重组DNAse。
1994年,基因泰克公司宣布将耗资1亿5千万美元在加里福尼亚州的 Vacaville新建工厂。同年,公司与IDEC Pharmaceuticals达成开发IDEC的anti-CD20单克隆抗体C2B8的协议,这一产品用于治疗非霍奇金B细胞淋巴瘤。
1995年,基因泰克出资5700万美元收购 Rituxan 65%的股份。
1996年,公司获FDA批准上市治疗急性局部缺血症和脑溢血的Activase,治疗生长激素缺乏的Nutropin,治疗病情恶化的胆囊纤维症病人的Pulmozyme。
1997年,Rituxan(美罗华)经FDA批准上市,用于非霍奇金氏淋巴瘤的治疗,后于2006年被核准用于类风湿性关节炎的治疗。
1998年,Herceptin(曲妥珠单抗)获得FDA批准上市,用于HER2过表达的转移性乳腺癌患者,后来被核准作为乳腺癌的辅助性疗法。
2000年,TNKase(tenecteplase)获得FDA批准上市,治疗严重心肌梗塞。
2003年,Xolair(omalizumab)获得FDA批准上市,用于中度至重度哮喘患者的治疗。
2003年,Raptiva(efalizumab)获得FDA批准上市,是用来阻挡起动T细胞激活、再激活造成的银屑病的一种抗体(2009年此产品撤出美国市场)。
2004年,Tarceva(厄洛替尼)获得FDA批准上市,用于局部蔓延或转移性非小细胞肺癌与胰腺癌。
2004年,Avastin(安维汀) 获得FDA批准上市,用于治疗位于结肠或直肠转移性癌的抗VEGF单克隆抗体,后于2006年被核准用于局部蔓延、复发、转移性非小细胞肺癌。2008年,Avastin与化疗的结合疗法也被核准用于治疗蔓延性HER2-阴性乳腺癌。2009年,Avastin再次被核准用于胶质母细胞瘤的治疗和转移性肾细胞癌的治疗。
2006年,FDA 核准Lucentis(雷珠单抗)用于新生血管性老年黄斑病变的治疗。
2009年3月12,罗氏制药与基因泰克达成友好并购协议,罗氏制药将以每股95美元的价格收购基因泰克44%的剩余股份,交易总额为468亿美元,全部以现金方式进行。至此,基因泰克100%由罗氏制药控股。
2010年,Actemra(托珠单抗)获得FDA 批准上市,该产品是第一个被批准以IL-6为靶点用来治疗类风湿性关节(RA)的单克隆抗体。
9.2.2基因泰克公司产品线
9.3 Regeneron (再生元)
9.3.1 Regeneron的起步与发展历程
1988年,再生元(Regeneron)公司由伦纳德·施莱弗尔和乔治·雅克波罗斯创立于美国纽约,启动资金是来自美林风险投资的100万美元。公司成立之初,伦纳德·施莱弗尔意识到当时没有任何一家生物技术公司在针对神经系统疾病做类似的研究工作,于是把再生元定位为研究神经生长因子的公司,试图开发多款神经类药物,但是先后均以失败而告终。多年来,再生元被认为是一家科研能力强大但却无法推出一款产品的公司。
1989年,Regeneron从事神经生长因子的研究,相继研发了用于神经疾病治疗的蛋白质药物神经生长因子、脑源性神经生长因子、睫状神经生长因子三个产品。随后,公司获得来自日本住友集团的1000万美元投资。
1990年,Regeneron与新兴生物巨头安进签署协议,由安进出资 1500 万美元,收购 7% 左右的 Regeneron 可转换优先股,共同开发神经生长因子,用于阿尔茨海默症或帕金森病的治疗。
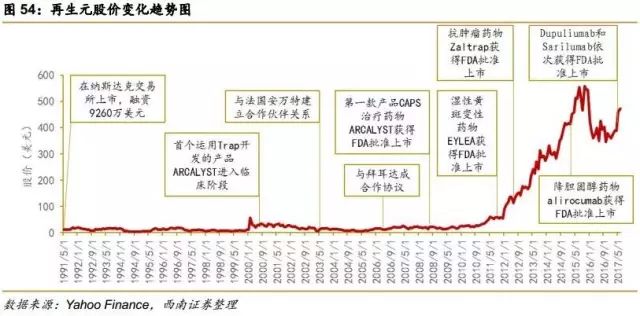
1991年,Regeneron股票上市,募集资金 9160 万美元,为后续研发工作提供了资金保障。
1994年,睫状神经生长因子相关的Ⅲ期临床研究宣告失败,公司裁员200多人。
1997年,公司在研产品脑源性神经生长因子在治疗肌萎缩侧索硬化症的临床试验中失败。
1999年,公司启动在研药物 AXOKINE 用于肥胖症的临床研究。
2000年,公司首个运用Trap 技术平台开发的新产品 ARCALYST 进入临床阶段。
2001年,公司开始运用Trap技术平台对肿瘤治疗的相关研究进入临床试验阶段。
2003年,Regeneron与法国安万特(赛诺菲公司前身,以下简称“赛诺菲”)建立合作伙伴关系,共同开拓 VEGF Trap 用于肿瘤治疗的临床潜力。
2004年,公司开始运用VEGF Trap湿性黄斑变性(AMD)治疗的临床研究。
2005年,用于肥胖症的药物AXOKINE的研发再次失败,宣告了公司十五年来在神经系统领域内的研发“全军覆没”。
2006年,Regeneron与拜耳达成协议,合作推动实现 VEGF Trap 用于眼科疾病治疗的商业化进程。同一年,Regeneron 的第一个全人源化产品—针对 IL-6R 靶点的全新药物 Sarilumab 进入临床试验之中。
2007年,Regeneron 扩大了与赛诺菲的合作,从 2007 年开始,赛诺菲每年支付 1 亿美元的研发资金给 Regeneron,在 2010 年之后将这笔资金提高至 1.7 亿美元直至 2017 年,共同致力于单克隆抗体的研究开发和商业化生产。
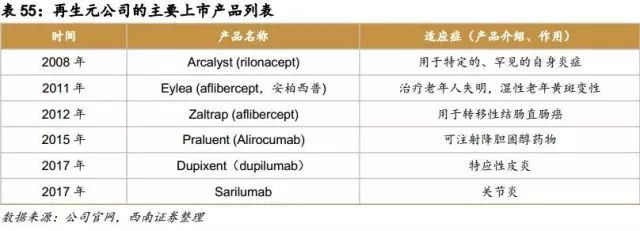
2008年,Regeneron 的第一款产品 ARCALYST 获得美国 FDA 批准上市,用于 Cryopyrin 蛋白相关周期性综合征(CAPS)的治疗,CAPS 是一种十分罕见的自身免疫性遗传疾病。2008 年ARCALYST的销售总额为1100 万美元。
2011年,用于治疗湿性黄斑变性的药物EYLEA获得FDA批准上市, EYLEA 是基于 Regeneron 的 Trap 技术开发的一个 VEGF(血管内皮生长因子)受体抑制剂。
2012年,EYLEA这个全新机理的眼科产品获得美国湿性黄斑变性治疗 22% 的市场占有率,销售额也一举达到了 8.38 亿美元。2013 年,EYLEA 在美国市场的销售突破 14 亿美元。
2012年,Regeneron 与赛诺菲合作开发的药物 Zaltrap 获得 FDA 的上市批准,用于治疗转移性结直肠癌,这款抗肿瘤药物 2013年市场销售约为7000万美元。
2015年,降胆固醇药 alirocumab获得FDA批准上市,alirocumab 是一种被称为 PCSK9 抑制剂的新型生物药,它通过抑制 PCSK9 蛋白来达到降低低密度脂蛋白表达量,从而降低胆固醇水平。
2017年4月,赛诺菲/再生元合作开发的Dupixent(dupilumab)获得FDA批准上市,用于中度至重度特应性皮炎(AD)成人患者的治疗。
2017年5月,赛诺菲/再生元合作开发的Sarilumab获得FDA批准上市,用于二线治疗成人中度至重度类风湿关节炎。Sarilumab是首个直接靶向白介素-6(IL-6)受体的全人源化单克隆抗体。
9.3.2 Regeneron的技术平台
Regeneron开发了两款可以阻断特定细胞表面或分泌蛋白的技术平台:Trap技术平台和VelociSuite技术平台。
Trap:用于阻断细胞因子和生长因子在人体内的过度表达,其作用原理是用两种受体组成一个“陷阱”来捕获人体内细胞因子和生长因子。
VelociSuite:用于发现、开发和生产人的单克隆抗体,以提高生产单克隆抗体的效率,其作用原理是将人类基因植入小鼠体内,生成人体能接受的抗体药物。其中,VelociSuite技术平台由VelociGene、VelociMouse、VelociMab和VelocImmune®小鼠平台四部分组成 。VelociGene用于产生特定目标基因或高度定制化的基因,VelociMouse用于培育原代胚胎干细胞小鼠,VelociMab用于快速筛选抗体和快速生产表达细胞系,VelocImmune®小鼠平台用于生产完整的人体单克隆抗体。
9.3.3 Regeneron公司的产品线
9.3.4 Regeneron公司股价表现
生物医药三大跨国巨头有不一样的成长历程,但是它们都紧跟时代的步伐,抓住机遇,搭上了生命科学高速发展快车道,凭借夯实的基础和实力,在21世纪的头十年均得到了蓬勃发展。20世纪80年代初,曾经有人预言:“21世纪将是生物学的世纪”。三十多年来,我们看到了生命科学取得的重大进展和突破,同时也看到了各种新型疾病的出现和不断爆发,人类依旧面临重重困难和挑战。21世纪的生物学才刚刚开始,对于我们国内新生的生物技术公司而言,只要勇敢地接受挑战,机遇无处不在,找准方向,持之以恒,必然有一批会从中脱颖而出,成为值得我们关注和投资的企业。
10 、投资建议及国内优秀公司概览
生物药是全球制药行业增长最快、空间最大的细分领域之一,也是目前国内研发水平最接近国际水平的领域之一,我们认为投资国内生物药前景巨大。参考全球发展趋势,我们认为生物类似药和Me-too类新药研发领域是国内企业最有望取得突破性进展的领域。目前国内已有多家上市公司和非上市创新性企业投入到这一领域。根据本文中对研发进度、竞争格局、市场空间和销售能力等几个纬度分析,我们重点推荐A/H股恒瑞医药(600276)、复星医药(600196)、丽珠集团(000513)、沃森生物(300142)、康弘药业(002773)、安科生物(300009)和金斯瑞生物科技(1548.HK)及非A/H股上市公司信达生物、君实生物和百济神州等。
10.1恒瑞医药(600276):积极布局创新生物药的国内研发巨头
公司是国内最大的抗肿瘤药和手术用药的研究和生产基地,国内最具创新能力的大型制药企业之一。公司研发费用占公司的营收比逐年上升,2016年达到11.8亿元,占营收比例达10.6%。从2017年开始,公司有多款创新品种有望陆续获批,公司龙头优势愈发突出。
代表性重磅产品简析
PD-1单抗:中国第二个获得WHO非专利药物名的国产生物药,同时也是首个获得WHO非专利药物名的国产单抗药物。目前已进入III期临床。根据第七部分分析,在PD1领域恒瑞医药为最具投资价值的企业。
升白药HHPG-19K(19K):为长效聚乙二醇化重组人粒细胞集落刺激因子(CSF),属于I类创新药。2016 年全球升白药市场约70亿美元,其对标产品Neulasta2016年销售规模达47.9 亿美元。目前该产品已处于保生产阶段,国内进度遥遥领先,有望成为10亿量级重磅品种。
PD-L1单抗:目前已经批准进行临床试验,可与公司PD-1单抗和其他抗肿瘤药物形成。
C-Met ADC:中国第一个获得FDA临床批准的抗体药物偶联物。目前国内外尚无已上市的同靶点的同类型产品,雅培公司的同类产品正处于I期临床研究阶段,Sorrento公司的同类产品也还处于临床前研究阶段。


盈利预测与投资建议
我们预计公司2017-2019归母净利润分别为31.23 亿、39.70亿和51.52亿,同比分别增长20.64%、27.13%和29.75%;预计2017-2019年EPS分别为1.11元、1.41元、1.83元,对应的PE分别为49倍、38倍、30倍。作为一家在国内药物创新领先的高科技生物公司,恒瑞医药的发展前景非常广阔,公司的股票有相当的上升空间。长期看好公司的发展前景,给予“买入”评级。
10.2复星医药(600196):仿创结合,研发即将进入收获期
“三线发力”——复星医药三大板块已具规模
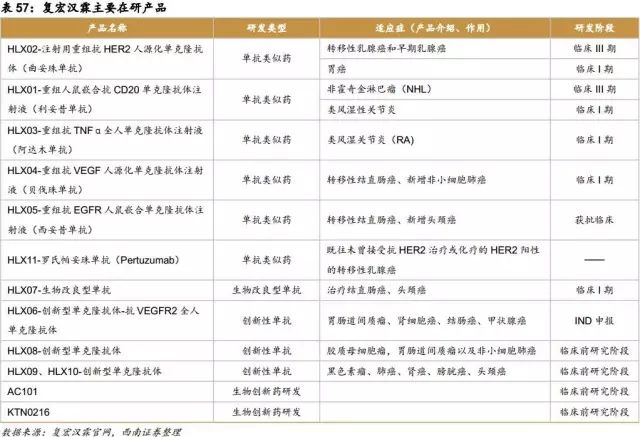
生物制药:在生物制药方面公司抓住全球医药产业的前沿领域,如打造全国领先的生物类似药研发平台、与全球细胞免疫治疗先锋Kite合作打造免疫治疗产业平台。同时公司注重新药的引进和开发,子公司复宏汉霖用2000万美元从Kolltan引入新型肿瘤单抗药物KTN0216的开发权,在2016年也与韩国AbClon签署协议,获得新抗体药物知识产权和商业化权利。
医疗健康服务:在医疗健康服务领域,目前公司控股的医院核定床位达到3018张,预计在三年内将达到1万张。在医疗设备领域创新合作研发“达芬奇机器人”,有望在医疗机器人领域获得收益流。
分销物流:在分销物流领域,复星医药参股投资的国药控股经过10余年的发展,已成为中国最大的药品生产商、医疗保健产品分销商及领先的供应链服务提供商,拥有并经营中国最大的药品分销及配送网络。公司已在这些领域站稳跟脚,并进入投资回报期。
复宏汉霖——单抗领域的领军者
单克隆抗体药物具有靶向性好,疗效确切,毒副作用小等优势,已经成为肿瘤和自身免疫疾病等重大疑难病症的高端首选治疗用药。复宏汉霖的创新型单抗HLX06、HLX08、HLX09及HLX10是国内领先的创新型单克隆抗体(Novel mAb)项目,具有完全自主知识产权,其中HLX06已经完成IND申报,其他创新药也在临床前研究阶段。截止到今年6月,复宏汉霖共完成7个产品、12项适应症IND的申报,已完成临床注册申报的前五个项目HLX01-HLX05,均为全球“重磅单抗”的生物类似药。复星医药中的单克隆抗体业务,也就是复宏汉霖的核心业务的市场估值,在2018年将达到50.28亿人民币,可以说是复星医药增长扩张的发动机。其主要产品利妥昔单抗(预计2018年上市),曲妥珠单抗(HLX02)(预计2019年上市)估计分别可带来现金流的现值为35亿和30亿人民币。
盈利预测与投资建议
复星医药集团通过创新单抗以及新获授权的单抗药物,将实现生物类似药市场的进一步开拓,同时在医疗设备和医疗健康服务领域也站稳跟脚并保持高速发展,实现“三端发力”。预计公司2017-2019归母净利润分别为33.3亿元、39.1亿元和45.7亿元,同比分别增长18.6%、17.7%和16.6%;预计2017-2019年的每股收益EPS分别为1.33元、1.57元和1.83元,对应PE分别为22倍、19倍和16倍,净资产收益率分别为 13.0%、13.6%和14.2%。同时公司也将保持充足的资产现金流,2017至2019年,EBITDA增长率预期分别为26.6%、14.5%和13.4%。公司处于成长上升期,资本结构和营运能力向好,我们给予“买入”评级。
10.3丽珠集团(000513):丽珠单抗——国内一流、国际接轨的创新高科技企业
公司优势力量
人才:世界级水平领导团队,由9名生物技术、医学、化学等相关专业海内外博士和1名拥有MBA学位的化学硕士组成。其中还有两名国家千人计划特聘专家,分别是担任丽珠单抗总经理(丽珠集团执行董事、副总裁)的傅道田博士和丽珠单抗工艺开发和生产副总经理的阮文博士。
研发:公司拥有符合FDA/EMA以及SFDA cGMP要求的新建研发中心170,000平方英尺,配备多个一次性生物反应器以及两条独立的不锈钢生产线(500L和1500L)和来自欧美最先进的研发设备。
政府支持:丽珠集团控股子公司丽珠单抗自2010年成立以来,先后获得国家、省、市级政府资助7次,资助金额合计约1.1亿元。其中2017年3月“I类治疗用人源化抗人肿瘤坏死因子α单克隆抗体新药 AT132的研制及产业化”课题获的“重大新药创制”科技重大专项“十三五”立项支持,获得政府资助1782万元。
精准医疗全产业链基本成型,生物药产品线不断丰富
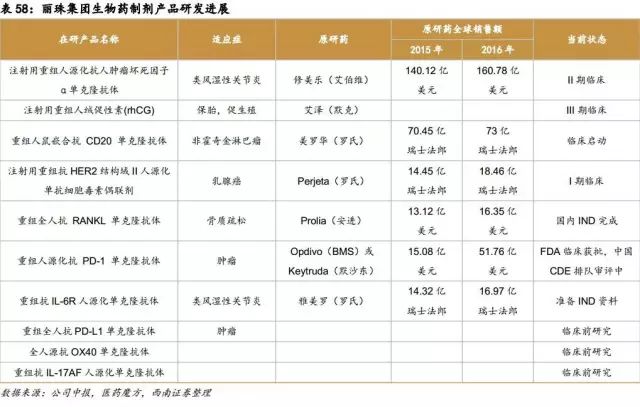
丽珠集团充分利用生物制剂与诊断试剂业务在精准医疗领域的协同优势效应,构建了“丽珠试剂+丽珠单抗+丽珠圣美+丽珠基因”的精准医疗产业链,全面布局精准医疗。丽珠试剂:IVD 产品,分子诊断和化学发光研发加快;丽珠单抗:公司12 个项目在研,包括10个生物药制剂产品,其中CD20、HER2、TNFa 、rhCG和PD-1 分别临床I-III 期,进展迅速,已处于国内第一梯队;丽珠圣美:高端液体活检检测设备及试剂;丽珠基因:第三方实验室服务,落地精准诊断。
随着公司的重要单抗产品注射用重组人源化抗PD-1单克隆抗体于2017年7月获得美国FDA批准开展I期临床试验,我们认为丽珠单抗的研发实力已与国际接轨,在走向国际化的道路上迈出了重要一步,未来前景十分看好。
盈利预测与投资建议
公司2017年上半年实现收入和扣非归母净利润同比增速分别为+13.0%和+25.1%,业绩略超预期。已有主要业务西药、原料药和中间体、中药、体外诊断业绩表现良好,均维持高增长态势;艾普拉唑片新进国家医保,有望快速放量,重磅粉针也有望下半年获批;公司全面布局的精准医疗全产业链已基本成型。综合考虑上述因素,在扣除公司土地收益的情况下,预计2017-2019年EPS分别为1.74元、2.16元和2.58元,对应当前股价PE分别为28倍、23倍和19倍,我们认为中短期内公司重点品种将延续稳健增长、核心二线品种高速增长,在新版医保目录执行和精准医疗布局,尤其是生物药研发进展快速推进的情况下,公司估值有望大幅提升,给予“买入”评级。
10.4沃森生物(300142):疫苗和单抗双管齐下的制药企业
沃森生物是国内生物制药领域集研发、生产、销售为一体的以创新为驱动的生物制药企业,广泛覆盖传统疫苗、新型疫苗、单抗药物和血液制品等诸多领域,为国家认定的高新技术企业和国家企业技术中心。公司研发和管理层有史力、梁小平、周新华、阚子义四位国家“千人计划”专家领衔,子公司泽润生物由史力任CEO,梁小平任CSO,子公司嘉和生物由周新华任CEO,阚子义任CTO,科研人员充足,在疫苗和单抗产品研发领域经验丰富,技术平台完备,为新品研发提供了确切的保障。
公司代表性产品
23价、13价肺炎疫苗和HPV疫苗:2017年,公司新品23价肺炎疫苗获得GMP认证,产品年内上市,将成为公司业务新的增长点,预计3年内可以达到4个亿的市场规模。沃森是全球唯一一家同时拥有13价肺炎疫苗和HPV疫苗自主开发能力的公司,这两个产品都是目前全球销量第一、第二名的超级重磅品种,公司在研产品均已处于III期临床阶段,预计2-3年内能够上市,为公司创造可观收益。
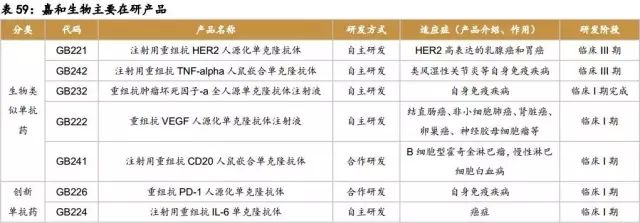
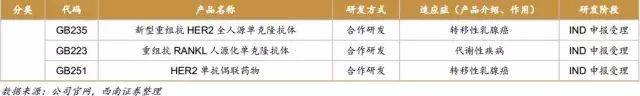
生物药:控股子公司嘉和生物在国内单抗研发领域处于领先地位,在研产品涉及肿瘤、自身免疫性疾病和代谢类疾病等重大疾病的治疗。目前,公司有10余种产品正处于各个研发阶段,其中HER-2单抗GB221与TNF-α单抗GB242均正在进行Ⅲ期临床试验,研发进度国内领先,预计2018年能够申报上市;自主研发的GB232于2014年8月获MFDS临床试验许可,目前在韩国Samsung Medical Center进行的I期临床试验已基本完成。
盈利预测与投资建议
受益于疫苗流通政策改革,我们认为公司传统业务将维持稳定增长;公司新产品23家肺炎疫苗已经上市,我们预测2017年-2019年销量会快速提升;公司在研产品13家肺炎疫苗、2价HPV疫苗、HER-2与TNF-alpha单抗均已进入临床III期,对公司估值可有进一步提高。我们预计公司2017-2019年EPS 分别为0.01元、0.02元、0.11元,对应PE分别为1282倍、641倍、117倍。我们预计公司的重磅在研产品13家肺炎疫苗等在接下来两年内会陆续上市,快速释放利润,给予2018 年PEG 2.8 倍估值,给予“买入”评级。
10.5安科生物(300009):精准医疗龙头企业
安科生物是一家以生物医药产业为主的具有自主创新能力的国家级高新技术企业,长期致力于细胞工程、基因工程等生物技术产品的研究、开发和核心技术能力的构建。公司主要业务涵盖生物制品、现代中成药、化学合成药、多肽药物、核酸检测产品等产业领域,逐步落实精准医疗的发展战略,形成基因检测、靶向抗肿瘤药物开发、细胞免疫治疗技术等一系列精准医疗的全产业链布局。
CAR-T细胞治疗技术领先
公司参股公司博生吉公司由美国 MD 安德森研究中心归国教授杨林领导,致力于肿瘤免疫细胞治疗技术与产品的研发,在实体瘤的CAR-T细胞治疗技术处于领先地位。公司已成功开发出具有国际一流技术水平的CAR-T、CAR-NK 细胞技术平台,构建了CD19、CD138、CEA、HER-2等多个靶点的CAR,并已证明对多种恶性肿瘤细胞均有良好的杀伤作用。另外,博生吉通过自主研发的CD19单克隆抗体基因序列,构建了可以特异性地识别CD19肿瘤抗原分子的新一代CAR,并发现其对套式淋巴瘤细胞具有极强的杀伤能力。目前,博生吉已成功开发出基于新型慢病毒系统以及非病毒的转座子/转座酶系统的新一代CAR-T技术,建立了一流的aAPC技术和相应的CAR-T细胞制备体系,拥有完善的全套CAR-T治疗技术平台,可以为广大临床单位的临床试验提供技术保证。
生物制剂产品丰富
公司的生物制品在研项目聚乙二醇化重组人生长激素注射液、注射用重组人HER2单克隆抗体和冻干重组人角质细胞生长因子-2均已进入临床III期试验阶段,研发进度国内领先。另外,公司的聚乙二醇化重组人干扰素α2b注射液也已进入I期临床阶段,且有多款药物处于临床验证或申请审批阶段。
盈利预测与投资建议
预计2017-2019 年EPS 分别为0.39 元、0.50 元、0.61元,对应PE 分别为44 倍、34 倍、28 倍。考虑到生长激素快速放量和精准医疗产业链持续扩张,维持“买入”评级。
10.6康弘药业(002773):因“康柏西普”成名的药企
康弘药业拥有“国家企业技术中心”、“生物大分子蛋白药物四川省重点实验室”和“康弘博士后科研工作站”等技术平台,已构建起四大重点技术形成自己的核心竞争力:(1)以动物细胞表达体系为平台的生物制品药物的产业化技术;(2)中成药质量标准和控制技术;(3)药物口服、注射制剂,速释和缓释制剂的产业化技术;(4)化学合成药综合指标(质标、成本、安全、环保)领先的产业化技术。
公司主要产品涉及眼科系统、中枢神经系统、消化系统、呼吸系统等多个领域,目前有康柏西普眼用注射液、松龄血脉康胶囊、盐酸文拉法辛缓释片、阿立哌唑口崩片、右佐匹克隆片、舒肝解郁胶囊、胆舒胶囊、枸橼酸莫沙必利分散片、一清胶囊、感咳双清胶囊、渴络欣胶囊、玄麦柑桔胶囊十二个上市品种。
重磅产品“朗沐”及在研产品简介
公司原创I类生物新药康柏西普眼用注射液(朗沐)是新一代抗VEGF融合蛋白,中国首个获得世界卫生组织国际通用名的拥有全自主知识产权的生物I类新药。康柏西普于2013年底获批用于湿性年龄相关性黄斑变性(wAMD),2017年5月扩增适应症用于病理学近视的脉络膜血管新生(pmCNV)。康柏西普还在进一步拓展新的适应症糖尿病性黄斑水肿(DME)和视网膜静脉阻塞(RVO),均已处于III期临床试验中。另外,康柏西普已获得FDA批准在美国直接开展湿性年龄相关性黄斑变性(wAMD)III期临床试验,未来有望在美国市场上市,给公司业绩带来巨大弹性。
基于VEGF 机理的药物平台技术,公司目前还有三个在研生物药产品,KH901是治疗性肿瘤疫苗1类生物药,目前已进入II期临床阶段;KH903用于结直肠及其他器官肿瘤,已处于Ic期临床;KH906用于眼表新生血管相关疾病,已获批临床。这些产品在美国、日本、印度、韩国、俄罗斯等国拥有多项国际专利,未来国际市场开发潜力巨大。
朗沐自2013年上市以来,迅速占领国内市场,2014-2016年的年销售额分别为0.74亿、2.67亿、4.76亿元,增速分别为260.81%、78.28%。2017年,通过国家医保谈判,朗沐已成功进入国家医保,随着新版医保目录落地执行,该产品有望快速放量,给公司带来更多业绩。
盈利预测与投建议
公司2017年上半年实现收入和归母净利润同比增速分别为+17.6%和+30.8%,业绩整体符合预期。分产品线看:1)中药:实现营收5.4 亿元,同比+11.7%,毛利率提升0.3%;2)化药:实现营收5.3 亿元,同比+15.4%,毛利率下滑0.2%;3)生物药:即康柏西普(朗沐)实现营收3.0 亿元,同比+35.0%,毛利率提升1%。我们认为公司的中药和化药能够延续以往的增长态势,而重磅生物药朗沐在新的适应症进一步拓展和进入医保目录的推动下,正处于爆发增长期,在美国开展临床试验也会提升公司估值水平。由此,我们预计公司2017-2019 年EPS 分别为0.95 元、1.26元、1.63元,对应当前估值分别为55倍、41倍和32倍,未来三年归母净利润将保持30%的复合增长率。我们十分看好公司作为国内创新生物药行业典范的突出地位,看好康柏西普的成长性和公司未来发展空间,给予“增持”评级。
10.7金斯瑞生物科技(1548.HK):CAR-T疗法研发领先的全球基因合成服务龙头
金斯瑞瑞生物科技是全球最大的基因合成服务公司。公司已经建立了高通量和高质量的生物学研究服务,包括基因合成,分子生物学服务,多肽合成,定制抗体,蛋白表达,抗体及蛋白质工程以及体外和体内药效学研究。近年来,公司立足于生命科学研发服务,积极开拓新业务。公司2014年开始介入CAR-T细胞疗法研发,目前BCMA靶点CAR-T药物处于全球领先地位。
CAR-T细胞疗法成果喜人,公司计划2017年底提交美国IND
子公司南京传奇生物科技在2017年6月美国临床肿瘤学会年会(ASCO)公布了CAR-T疗法在多发性骨髓瘤治疗上的优异成果。1)公司在研CAR-T药物是一款靶向BCMA(B细胞成熟抗原)和CD38的双靶点CAR-T疗法。BCMA是CD19之外CAR-T中最有希望的靶点之一;2)公司结果显示35名复发性或耐药性多发性骨髓瘤患者(平均已接受过3种疗法治疗)参与的临床试验中,该疗法的客观缓解率为100%。在最早的19名患者中,14名达到了严格的完全缓解,5名部分缓解,并且5名接受治疗超过1年的患者依旧处于完全缓解期;3)同样重要的是,公司数据显示该疗法有较好的安全性。4)主要竞争对手Bluebird虽然入组病人质量(平均已接受过7种治疗方案)及剂量设计方面优于金斯瑞,但是金斯瑞的病人数接近Bluebird两倍,并且试验结果更好。
生命科学服务业务维持高速增长,工业酶业务增长迅猛
1)公司主要业务—生命科学服务业务实现营收5302万美元,毛利3761万美元,同比分别增长19.6%和22.1%。随着全球医药及生物科技领域研发经费的不断提高,我们预计公司生命科学服务业务仍将维持较高速度增长。2)工业酶业务实现营收467万美元,毛利152万美元,同比分别增长235.7%和650.0%。工业酶为公司2014年开始介入的新业务,为公司将来重要发展方向。公司在菌种构建及培育环节具有研发技术优势,同时2016年收购济南诺能生物51%的股权并扩建生产工厂补足生产能力短板。工业酶市场大,我们预计公司将会发挥技术优势开拓市场,维持工业酶业务的高速增长。
盈利预测与投资建议
鉴于公司计划推进CAR-T细胞疗法的研究,我们预计公司未来三年的研发费用支出会有较大幅度的增加,据此预期公司17/18/19年度净利润分别为29/32/33百万美元,EPS分别为1.7、1.9、2.0美分(即0.133、0.146、0.152港元),对应的PE分别为46倍、42倍和40倍。维持“增持”评级。
10.8信达生物(未上市):国内最具潜力的生物技术公司
信达生物制药(苏州)有限公司成立于2011年8月,以“仿制药与创新药研发相结合”为自己的特色道路,致力于做国内最好、国际一流的高端生物药制药公司。
产品链丰富:成立至今,信达生物已建立起一条包括12个新药品种,覆盖肿瘤、眼底病、自身免疫疾病、心血管病等四大疾病领域的丰富产品链,其中两个品种入选国家“重大新药创制”专项,具有全球自主知识产权的创新药物有9个。
生产线完备:公司建成大规模的产业化基地,包括符合CFDA、FDA和EMA的GMP标准的2条1000L(已建成)、6条3000L (建设中)、4条15000L (建设中)产业化生产线。其中,2条1000L生产线已于2016年9月通过了合作方国际制药集团的GMP审计,成为中国第一条符合美国FDA GMP标准的生物药生产线。
资金充足:信达生物凭其强大的研发实力,频频获得国际投资机构的青睐,自成立以来公司共进行了4轮融资,已获来自全球知名创投高达4.9亿美元的投资。
重磅产品IBI301简介
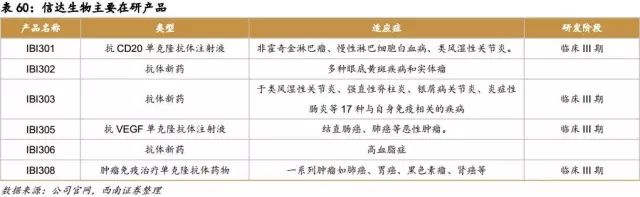
IBI301是一种重组人-鼠嵌合抗CD20单克隆抗体注射液,可用于非霍奇金淋巴瘤、慢性淋巴细胞白血病、类风湿性关节炎,是罗氏“美罗华”的一种生物类似药,有信达生物和礼来制药共同开发。IBI301与CD20抗原有较高亲和力,与CD20抗原结合后可通过免疫效应介导B细胞溶解,介导细胞溶解的可能机制有补体依赖的细胞毒作用(Complement dependent cytotoxicity,CDC)和抗体依赖细胞介导的细胞毒作用(Antibody-dependent cell-mediated cytotoxicity,ADCC)。IBI301可通过CDC及ADCC作用介导肿瘤细胞溶解,从而达到杀灭非霍奇金淋巴瘤的作用。目前,IBI301与美罗华III期疗效对比临床研究已进入攻坚阶段。IBI301在符合国际标准的GMP车间中生产,其生产车间通过了礼来全球GMP专家的审计,IBI301的一级/高级结构、异质性、生物活性、产品和工艺相关杂质、临床前药理、药代动力学和毒性特征与美罗华高度相似,具有极高的安全性,临床I期安全性研究完成3个剂量爬坡,未出现严重不良事件。IBI301是信达生物的重磅产品,中国每年新增非霍奇金淋巴瘤病人6万多,目前没有其他令人满意的国产特效药,所以我们预期该产品能给公司带来巨大的收益。
10.9君实生物(833330.OC):紧跟国际前沿的中国生物药公司
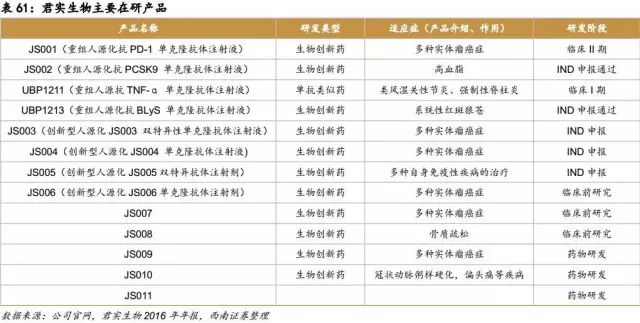
上海君实生物医药科技股份有限公司成立于2012年12月,是一家以开发治疗性抗体为主的研发型高科技公司,专注于创新单克隆抗体药物和其他治疗性蛋白药物的研发与产业化。公司团队成员均有着丰富的科技成果转化和产业化经验,自成立之初就瞄准国际抗体技术研发的前沿进展,搭建了国内一流的涵盖分子抗体药物筛选、高产稳定CHO细胞株的构建及治疗性抗体分析检测等多个核心技术的创新人源化抗体药物产品研究开发技术平台。公司雄厚的科研能力促使科研成果能够得到快速转化,产品开发进程也在业内领先。
全球布局:公司目前在全球四个地方进行了布局,协同创新发展。公司总部位于上海,以抗体开发、评价为主;苏州基地负责生产工艺开发和优化,进行产业化生产和临床试验;在美国旧金山湾区进行新抗体研发和高通量抗体筛选;在马里兰进行新靶点开发和抗体评估。
七大平台:公司建立了抗体药物研发所必须的高通量自动化抗体筛选平台、分子生物学平台、计算机模拟人源化抗体构建平台、高产稳定细胞株筛选平台、CHO细胞培养平台、抗体纯化和制剂工艺平台、抗体质量研究平台等七个关键技术平台,涵盖了单克隆抗体药物从早期开发到工艺放大的整个过程。
丰富的在研重磅产品
公司目前在研的项目有十三个,其中十个是抗肿瘤和抗自身免疫疾病的免疫调控药物,包含国家新药创制重大专项,在心血管疾病和骨质疏松等领域也有覆盖。
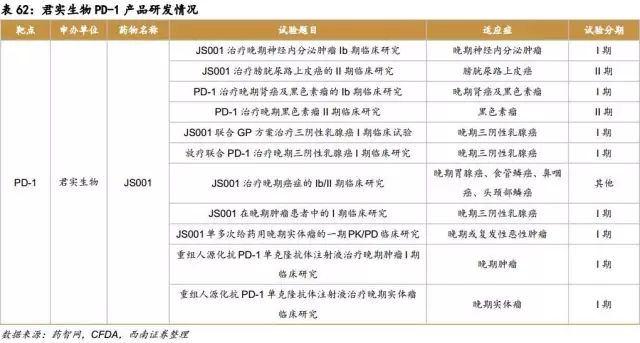
PD-1:产品代号JS001的PD-1新药目前在国内已进入临床II期阶段,预计2019年能够上市。
PCSK9:研发进展全国第一,申报临床已获得批准,相比同行其他公司,具有明显的领先优势。
阿达木单抗(TNF-α单抗):国家重大新药创制,研发进展国内前五。公司对应产品UBP1213已获得临床批件,处于临床I期阶段。该品种为2016年全球销售额第一,销量160亿美元。
BlyS 单抗:研发进展国内第一,已获得临床批件。根据EvaluatePharma测算, 2020年BlyS 单抗全球市场规模为10亿美元,在我国约有100万红斑狼疮患者,国内市场潜在规模约20亿元。
10.10百济神州(BGNE.O):“中国的基因泰克”——强大的创新能力和研发能力
百济神州是首个赴美上市的中国创业型生物制药企业,2010年底由北京生命科学研究所所长王晓东博士和前保诺科技公司(Bioduro)的创始人欧雷强(John Oyler)共同创建,研发全球领先的抗癌新药。公司瞄准国际前沿,从小分子靶向化学新药和大分子免疫抗肿瘤生物新药两路进发,同时布局10多个新药的研发。
2017年3月,百济神州生物制药项目在中新广州知识城正式破土动工,投入资金22亿元人民币,占地10万平方米,预计将于2019年试投产。该项目以单克隆抗体类原创生物制药为主,规模化生产后预计产值将达200亿元人民币。
四大科学研发方向
癌症生物学平台:癌症生物学平台突出了肿瘤免疫系统相互作用的重要性并强化了利用肿瘤活检组织来开发新模型的价值。公司与中国领先的肿瘤中心建立了密切联系,能够更好地选择靶点,并筛选和评估可能具有显著单一或组合疗效潜力的药剂。该平台已成功将可抑制关键肿瘤靶点的BTK、RAF二聚体及PARP抑制剂,以及抑制PD-1的免疫抗肿瘤制剂四个候选药物推入临床阶段。
分子靶向疗法基于分子生物学特征,用于区分出存在HER2、BRCA、BRAF、ALK和EGFR基因及蛋白质突变的癌症,通过特定基因和蛋白质中的突变(如HER2、BRCA和EGFR)识别特定的疾病亚群,是癌症药物开发工作的重要基础。靶向疗法能够起到抑制肿瘤进展、诱导肿瘤缩减的作用,能够在病人中形成较高的抗肿瘤应答率。目前,百济神州有BGB-3111、BGB-283 和BGB-290三种分子靶向候选药物处于临床研究阶段。
免疫抗肿瘤疗法用于开发CTLA-4、PD-1以及PD-L1抗体等免疫抗肿瘤制剂,通过激活免疫系统识别和消除肿瘤的能力获得更高、更持久的疗效。
联合疗法是将肿瘤免疫制剂与靶向疗法结合在一起,针对肿瘤免疫机制多个不同环节,通过可能产生的协同作用,从而起到更强、更持久的肿瘤抑制效果。公司免疫抗肿瘤生物药项目研发的首个候选药物一种PD-1单克隆抗体BGB-A317,是免疫抗肿瘤疗法和分子靶向疗法结合使用的基础。公司目前有BGB-A317结合BGB-3111、BGB-A317结合BGB-283和BGB-A317结合BGB-290三种组合正处于剂量扩增阶段。
百济神州临床试验阶段的在研药物
BGB-3111:用于治疗B-细胞恶性肿瘤的小分子BTK抑制剂
BGB-3111是一种强效、具有高选择性的小分子BTK抑制剂(Bruton酪氨酸激酶抑制剂),百济神州正将该产品作为单一制剂和组合疗法药物开发,治疗各种淋巴瘤(最常见的血液肿瘤类型)。BGB-3111可阻断相关信号传递,从而抑制恶性增殖B细胞的生长并杀死肿瘤细胞。
BGB-A317:针对PD-1的免疫检查点抑制剂
BGB-A317是具有发展潜力的新一类肿瘤免疫单克隆抗体药物,即免疫检查点抑制剂。它能够与T细胞表面阻碍免疫激活的重要受体PD-1结合,抑制PD-1,并清除癌细胞激活免疫系统的阻碍因素,从而恢复T细胞的肿瘤杀伤能力。此外,BGB-A317还具有对PD-1的高亲和力和特异性。临床I期初步数据显示,单抗BGB-A317耐受性良好,在HCC患者中显示了初步的抗肿瘤活性。目前,BGB-A317正作为单药和联合用药组分,在多个临床试验中探索对一系列肿瘤的治疗效果。
BGB-290:具有独特性质的PARP1和PARP2抑制剂
BGB-290是一种针对PARP的强效高选择性抑制剂,具有良好的药物代谢和药代动力学特性。BGB-290已在生化试验中显示出了良好的PARP1和PARP2选择性,跟其他奥拉帕尼之类的PARP抑制剂相比,BGB-290显示出了在细胞增殖方面的改进特异性。增强的选择性可能比现有的PARP抑制剂具有更好的安全性和耐受性。良好的安全性和耐受性非常有利于BGB-290与免疫检查点抑制剂或化疗药物的联合使用。BGB-290在选择性、DNA捕获活性、口服生物利用度和血脑屏障通透性方面,具有区别于包括奥拉帕尼在内的其他PARP抑制剂的潜力。奥拉帕尼是FDA和EMA目前批准的唯一的PARP抑制剂。
BGB-283:用于治疗实体肿瘤的小分子RAF二聚体抑制剂
BGB-283是一种小分子RAF抑制剂,百济神州正在开发其作为单药或联合用药治疗MAPK通路有突变的癌症,包括第一代BRAF抑制剂无效的BRAF基因突变型和KRAS/NRAS基因突变型癌症。由于存在这些突变的癌症类别众多,该产品正在被开发用于治疗包括结肠癌、非小细胞肺癌、子宫内膜癌、卵巢癌、胰腺癌和甲状腺乳头状癌在内的多种癌症。目前已进入市场的BRAF抑制剂仅对BRAFV600E单体有抑制作用。但文献研究显示,二聚体化是对第一代BRAF抑制剂发生耐药性的重要机理之一。BGB-283不仅可抑制单体,也可抑制二聚体形式的BRAF,因此降低了产生抗药性的几率。研究数据表明,BGB-283作为单药和联合用药都可表现出不错的效果。


11、风险提示
1)药品研发的风险
生物药研发难度高、周期长、投入高,研发失败和进度不及预期风险高。
2)销售低于预期风险
生物药价格较高,患者和医生的教育以及医保覆盖进展都会影响到将来药品的销售情况,存在药品上市后销售低于预期的风险。
3)政策变化风险
生物药属于新兴生物科技行业,国内生物药相关政策仍处于摸索阶段,存在政策改变的风险。
 分析师承诺:本报告署名分析师具有中国证券业协会授予的证券投资咨询执业资格并注册为证券分析师,报告所采用的数据均来自合法合规渠道,分析逻辑基于分析师的职业理解,通过合理判断得出结论,独立、客观地出具本报告。分析师承诺不曾因,不因,也将不会因本报告中的具体推荐意见或观点而直接或间接获取任何形式的补偿。
分析师承诺:本报告署名分析师具有中国证券业协会授予的证券投资咨询执业资格并注册为证券分析师,报告所采用的数据均来自合法合规渠道,分析逻辑基于分析师的职业理解,通过合理判断得出结论,独立、客观地出具本报告。分析师承诺不曾因,不因,也将不会因本报告中的具体推荐意见或观点而直接或间接获取任何形式的补偿。

重要声明
西南证券股份有限公司(以下简称“本公司”)具有中国证券监督管理委员会核准的证券投资咨询业务资格。
本公司与作者在自身所知情范围内,与本报告中所评价或推荐的证券不存在法律法规要求披露或采取限制、静默措施的利益冲突。
本报告仅供本公司客户使用,本公司不会因接收人收到本报告而视其为客户。本公司或关联机构可能会持有报告中提到的公司所发行的证券并进行交易,还可能为这些公司提供或争取提供投资银行或财务顾问服务。
本报告中的信息均来源于公开资料,本公司对这些信息的准确性、完整性或可靠性不作任何保证。本报告所载的资料、意见及推测仅反映本公司于发布本报告当日的判断,本报告所指的证券或投资标的的价格、价值及投资收入可升可跌,过往表现不应作为日后的表现依据。在不同时期,本公司可发出与本报告所载资料、意见及推测不一致的报告,本公司不保证本报告所含信息保持在最新状态。同时,本公司对本报告所含信息可在不发出通知的情形下做出修改,投资者应当自行关注相应的更新或修改。
本报告仅供参考之用,不构成出售或购买证券或其他投资标的要约或邀请。在任何情况下,本报告中的信息和意见均不构成对任何个人的投资建议。投资者应结合自己的投资目标和财务状况自行判断是否采用本报告所载内容和信息并自行承担风险,本公司及雇员对投资者使用本报告及其内容而造成的一切后果不承担任何法律责任。
本报告版权为西南证券所有,未经书面许可,任何机构和个人不得以任何形式翻版、复制和发布。如引用须注明出处为“西南证券”,且不得对本报告进行有悖原意的引用、删节和修改。未经授权刊载或者转发本报告的,本公司将保留向其追究法律责任的权利。