本指南仅代表 FDA 对于该领域现在的观点。它不赋予任何人任何权利,对 FDA 或公众不具有约束力。如果满足适用的法规和条例,您可以使用其他方法。如果要讨论替代方法,请联系负责本指南的 FDA 工作人员。
本指南主要列举了人用咀嚼片的关键质量属性(CQAs),代表了 FDA 审评中心(CDER)现在的观点。制造商在开发咀嚼片应对本文列举的CQAs进行评估
[2]
。同时,CDER也对咀嚼片的研究、生产和说明书信息提出了一些建议。这些建议主要在NDAs、ANDAs
[3]
和一些CMC补充申请
[4]
。其中,关于研究方面的建议也适用于INDs。人用咀嚼片均需评估本文建议的CQA,包括未提交申请的产品。
一般,FDA指南不具有法律强制性。相反,仅代表该机构目前的看法,可以视作建议,除非引用了具体的法规或法定要求。本文中的“应该”意味着建议或推荐,但不是必需的。
咀嚼片是速释制剂的一种,患者咀嚼之后吞咽,而不是吞咽整个片子。咀嚼片应该味道较好、易于咀嚼和吞咽。
对于儿科人群、成人或老年患者,由于片剂的尺寸太大或吞咽困难,他们不能或不愿吞咽完整的片剂。咀嚼片应该在以上患者群体中安全、易于使用。
安全和易于使用在临床实践中是重要的。许多非处方药(OTC)和处方药产品都是咀嚼片。
美国药典(USP)将咀嚼片分为两种:
(1)可以咀嚼以易于吞咽
(2)必须咀嚼或破碎以避免窒息和/或确保有效成分的释放[5]。
本指南适用于两种类型的咀嚼片。
咀嚼片的不良反应包括
整个吞咽或未完全咀嚼引起的患者胃肠道
(GI)
阻塞
,片剂硬度过大引起的
牙齿损伤和义齿断裂
[6]
。潜在不良反应是对
食管的刺激
,申请人还应考虑。
对一些已批准的咀嚼片分析,显示在某些情况下关键质量属性(如硬度,崩解和溶出度)没有得到应有的关注。据不完全统计,未列入质量标准的相关 CQAs 或应用范围过宽。此外,还发现分析程序的变化较大
[7],[8],[9]
。
本指南详述了开发咀嚼片时应考虑的关键质量属性,并建议其质量标准应该在整个货架期内都是合适的和有意义的。
咀嚼片应考虑的一系列的物理特性,应具备以下4点:
1. 易与咀嚼
2. 味道可口(掩味或味道可接受)
3. 尺寸及形状适中
[10]
4. 易崩解,尽量降低吸入并利于溶出
咀嚼片的 CQAs 应该包括硬度、崩解、溶出和其他可能影响生物利用度(BA)和生物等效(BE)的因素。另外,应该密切关注
片剂尺寸、厚度、脆碎度和风味
,这些可能会影响到患者服用咀嚼片的能力和意愿。
例如,对于口味较差的咀嚼片,患者可能更愿意整个吞服而不是咀嚼后服用。仅用上述中的一个指标控制咀嚼片质量是不够的,应该开发一个上述质量属性的适当组合,以保证咀嚼片达到预定用途。
咀嚼片的硬度应该能够满足制造、包装、运输和分配的严格考验,且易于患者咀嚼。硬度是指在特定平面上破碎片剂所需的力。硬度有很多单位。
提交给 FDA 的申请应在报告结果和质量标准中使用同一个度量单位。
包括:kilopond(kp),kilogram-force(kgf),Newton(N),和Strong-Cobb Units(scu)。1 kp = 1 kgf = 9.8 N = 1.4 scu。公共标准需包括测量硬度的方法(片剂破碎力
[11]
)。硬度可用于计算咀嚼困难指数(见附录Ⅰ)。
片剂分解成小颗粒所需的时间是其崩解时限。对于咀嚼片,崩解时间应足够短,以防止药片在未被患者完全咀嚼的情况下造成 GI 阻塞。选择正确类型和用量的崩解剂有助于快速崩解
[12]
。
应使用已有的崩解设备(如USP Disintegration Apparatus)和方法,在合适的介质中,使用完整的片剂进行体外崩解实验
[13]
。
咀嚼片中药物的吸收取决于有效成分的释放。其体外溶出实验应与传统的速释片一致
[14]
。咀嚼片的活性成分(API)无论是否咀嚼都应该充分溶出。
研究期间,
体外溶出试验应至少采用 4 种溶出介质
,如水、pH 1.2、pH 4.5和pH 6.8,使用方法如USP装置 1(篮法),USP装置2(桨法)或USP装置3(往复筒法)
[15]
。
应该采用模拟空腹和餐后胃肠道介质(生物相关介质)评价咀嚼片的溶出行为。暴露在人唾液或模拟唾液(1-2 mL)中30-120 s,测定硬度。可以更好的评估咀嚼片的体内行为
[16]
。在与患者一致的特征生理介质中进行的体外实验可以进一步表征药物产品及其关键质量属性。
药物的溶解度和渗透性可用于确定药物的BCS分类。根据BCS分类,可考虑咀嚼片的BE豁免[17]。批准后CMC变更应符合《速释制剂:放大和批准后变更(SUPAC IR)》指南[18]。
开发
咀嚼片
时,需考虑以下基本原则。
产品设计应包括,
崩解剂
:易于API释放;甜味剂和矫味剂用于掩味
[19]
。原辅料之间发生相互作用的可能性及对工艺的潜在影响都应该深入研究。
对于NDAs 申请,在进行关键临床研究时应收集以下信息,并在申报资料中报告:
1.咀嚼片是否完整吞服(即不破裂)或彻底嚼碎后吞服?
2.如果完整吞服,咀嚼片的形状和尺寸是否有引起窒息或肠内梗阻的风险?[20]
3.如果患者可以用水辅助吞服,水量是多少?
4.服药体验怎么样(比如味道、口感和余味)?[21][22]
对于 ANDAs 申请,在进行 BE 实验时,应收集一些信息,如服药体验(可接受的味道,口感和余味),易于吞服——如果整片服用,并在申报资料中报告。
在NDA申请中,应评估药物口腔吸收的可能性
。药物的口腔吸收可能取决于API的溶解度和渗透性,在唾液中的稳定性(pH 范围为 6.0~7.5),以及是否有首关代谢(first pass metabolism)。
可以在体外评估药物在口腔环境中的稳定性
。例如,适当的 pH 值、短时间内(例如<5分钟)药物释放最低或降解很少,可能足以证明颊部环境中的短期稳定性。
咀嚼片的硬度、溶出度和崩解应在研发早期确立。FDA 建议研究多个质量属性以表征咀嚼片并订入质量标准。应该避免只研究一个属性。
对于向 FDA 提交的申请,应在3.2.P.2(药品开发)中提交研究信息。片剂硬度和咀嚼困难指数(见附录I)应在3.2.P.3.4(关键步骤和中间体的控制)或3.2.P.5.1(质量标准)中提供
[23]
。
FDA 鼓励已批准的和未申请的咀嚼片重新评估关键质量属性,并确保制订适当的质量标准。
因为咀嚼困难(例如,对牙齿或义齿造成损坏或GI阻塞),FDA 如果有理由确定市售的咀嚼片对公共卫生构成特殊风险,将采取适当的行动以降低风险。
基于以往的申报资料和文献,FDA 建议将咀嚼片的硬度保持在较低水平(例如<12 kp)。
在咀嚼之前短暂暴露于唾液中(约30秒)使片剂发生的显著崩解和/或硬度降低,则可以考虑较高的硬度(例如> 12kp)。
该项研究可以使用人类志愿者,或者在体外使用1mL模拟唾液中暴露30秒(附录Ⅱ)。
在其他情况下,申请人应评估拟定硬度,包括患者可以安全地咀嚼,而不会损伤牙齿、义齿或与咀嚼有关的其他不良反应。
除了评估硬度外,申请人还应评估暴露于人类唾液前后的咀嚼难度指数(见附录Ⅰ)。
咀嚼片应符合与 IR 片剂相同的崩解和溶出度标准。
有些患者可能会整个吞咽,应使用完整的咀嚼片进行体外溶出实验。
不推荐在进行体外溶出度实验之前对咀嚼片进行破碎,因为迄今为止没有文献报道这种方法的有效性。
这种方法也无法模拟不同患者的咀嚼方式。根据产品特点,可能需要进行更多的溶出实验
[24]
。
可以使用其他方法评价,只要能证明该方法等同或优于现有的方法。
其他CQAs的评估应使用FDA推荐的方法或使用已证明相当于或优于现有的方法。
如前所述,USP 收载了两种咀嚼片:
(1)可以咀嚼,以易于服用;
(2)吞咽之前必须咀嚼和/或咬碎以避免窒息并确保活性成分的释放
[25]
。
这两种类型的咀嚼片有不同的命名和说明书信息。
格式“[DRUG] Tablets”用于可能咀嚼或整片吞下的咀嚼片。这些产品的说明书和标签还将包括一个声明,说明片剂可以咀嚼。
•格式“[DRUG] Chewable Tablets”用于必须咀嚼的片剂,并且没有替代的给药途径。这些产品的说明和标签还将包括一个声明,说明片剂必须咀嚼。
为了防止患者完整吞咽“[DRUG] Chewable Tablets”,强烈建议包装标签和纸箱标签(如果适用)突出显示如下:
“
在吞咽前完全咀嚼或破碎药片
。”
如果空间足够,建议以较小的突出显示以下声明,以加强咀嚼片剂的重要性:
“
不要整个吞咽
。”
此外,说明书中应包括与上述声明类似的表述(处方要点;第2节剂量和用法,以及第 17 节患者咨询信息)以及任何患者应知信息或“用药指南”(如适用)中。
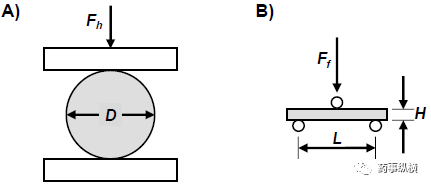
硬度
[26]
指在特定的平面上使片破碎的力。它可以用于计算抗张强度。它考虑到片剂的形状和尺寸。 对于圆形、平面片,使用以下等式计算抗张强度(σh)
[27]
:
公式1
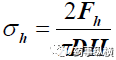
Fh 为破碎片剂需要的力,D 片剂直径,H 片厚(见图A)
片剂的破碎力(Ff)还可以通过图B的方式测定。抗张强度(σf)还可以通过下列公式计算[28]:
公式 2
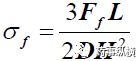
L指2个支点的距离,其他同公式1(见图B)。
上述两种方法计算的抗张强度成比例。
公式 3
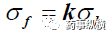
K为常数。
综合公式1、2、3,得到公式4
公式4
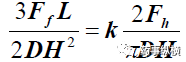
公式 4 变换得到 Ff 和 Fh 的关系。
公式5
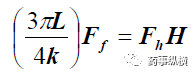
在实验中,“3πL/4”、“k”是常数。
公式5可以定义为咀嚼困难指数,表示咀嚼片的破碎/咀嚼困难程度,即:
咀嚼困难指数=FhH
图