
由创伤、感染、肿瘤和先天性疾病引起的颌面骨缺损已成为一个重要的全球健康问题。理想的引导骨再生(GBR)膜不仅可以作为一种屏障,而且还可以促进骨诱导并成骨。然而,不可吸收膜的生物活性有限,需要二次手术,而可吸收膜往往缺乏所需的机械性能,降解速度太快。为了解决这些挑战,
通过结合纯锌(Zn)和分层矿化胶原蛋白(HMC)的自组装,
北京大学刘云松、郑玉峰等
构建了一个双层自诱导的GBR膜(ss-HMC/Zn)
。Zn层作为一个面向软组织的外部屏障,提供时空支持,而HMC层则创造一个良好的内部自诱导成骨微环境。此外,HMC的骨样纳米结构有效控制锌离子的释放。体外实验表明,ss-HMC/Zn有足够的机械维护,良好的细胞相容性和膜成骨能力。体内结果显示出优越的骨诱导能力,不需要成骨补充剂。此外,ss-HMC/Zn膜具有免疫调节功能,促进血管生成和细胞招募,从而阐明其潜在的成骨机制。总之,这些协调良好的膜为颌面部骨缺损的引导骨再生提供新见解。
相关研究内容以
“
Hierarchical Mineralized Collagen Coated Zn Membrane to Tailor Cell Microenvironment for Guided Bone Regeneration
”为题于2025年1月10日发表在《
Advanced Functional Materials
》。

图1 构建ss-HMC/Zn膜的仿生策略及成骨机制
本研究通过自组装技术开发了一种结合HMC和纯Zn的多功能GBR膜-ss-HMC/Zn。通过整合外部机械和内部生物学特性,ss-HMC/Zn能够诱导干细胞的行为与体内的自然干细胞相似,从而促进血管生成,M2巨噬细胞极化,激活BMP2信号通路,最终结构和功能骨再生(图1)。这种集成设计利用了材料的机械和生物特性,将ss-HMC/Zn区别于传统的单屏障GBR膜,为推进GBR的应用提供新见解。
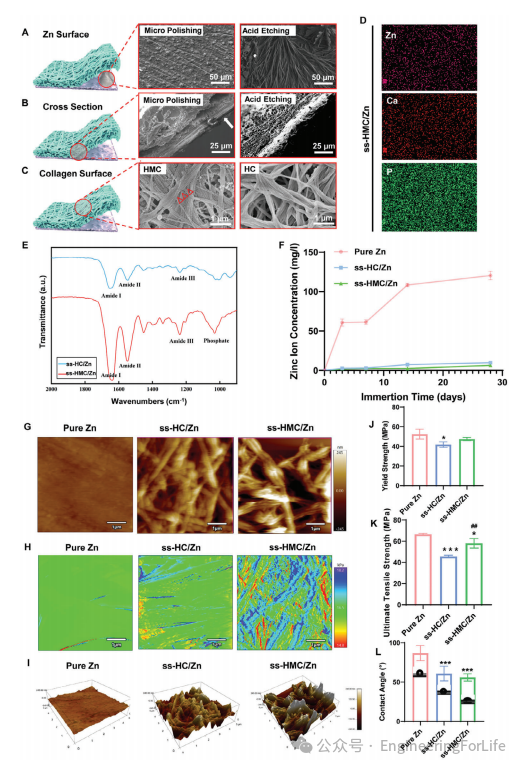
图2 纯Zn、ss-HC/Zn和ss-HMC/Zn的表征
ss-HMC/Zn的制备过程包括两个步骤:纯Zn层的
表面预处
理
,然后是胶原纤维自组装和仿生矿化形成
HMC层
。经过微抛光后,纯Zn的表面根据衬底晶粒内的不同变化体进行堆叠(图2A)。横断面图像显示,经过酸蚀刻后,Zn层和胶原层之间有明确、稳定的界面,而微抛光和未处理的切片显示两层之间有明显的裂缝(图2B)。图2C显示,HMC纤维与天然骨的纳米结构相似。能量色散X射线光谱(EDS)结果表明,在ss-HMC/Zn中存在Zn、P和Ca(图2D),而Bio-Gide膜不含有利于细胞成骨的矿化离子或金属。化学成分分析表明,ss-HC/Zn和ss-HMC/Zn均出现酰胺I、II和III等峰,而磷酸盐(900-1200cm
−1
)峰仅出现在ss-HMC/Zn中(图2E)。浸泡28天后,纯Zn、ss-HC/Zn和ss-HMC/Zn膜的Zn
2+
浓度分别为120.48 ± 5.30、9.76 ± 0.09和6.44±0.23mg L
−1
,表明胶原蛋白结构阻止Zn
2+
爆发释放(图2F)。原子力显微镜(AFM)结果显示,纯Zn相对平滑,而HC和HMC层显示出高度致密、均匀的胶原纤维(图2G)。ss-HMC/Zn在HMC区域表现出良好的纳米力学性能(图2H)。ss-HMC/Zn的表面比ssHC/Zn的表面更粗糙(图2I)。纯Zn、ss-HC/Zn和ss-HMC/Zn膜在宏观水平上的屈服强度分别为52.48 ± 5.00、41.78 ± 2.78和47.45±1.58MPa(图2J)。纯Zn、ss-HC/Zn和ss-HMC/Zn膜的极限拉伸强度远高于Bio-Gide膜(≈3.7MPa)(图2K)。ss-HMC/Zn的接触角明显小于纯Zn和ssHC/Zn,表明ss-HMC/Zn具有较好的亲水性(图2L)。

图3 体外生物相容性和成骨性能
为了验证纯Zn、ss-HC/Zn和ssHMC/Zn的生物相容性,将人骨髓间充质干细胞(hBMMSCs)分别接种到这些膜上。一天后,活/死染色显示,ss-HC/Zn和ss-HMC/Zn组中几乎所有hBMMSCs都存活,而纯Zn组中有死亡的hBMMSCs,表明ss-HC/Zn和ss-HMC/Zn具有更好的生物相容性(图3A)。细胞骨架染色显示,在ss-HMC/Zn和ss-HC/Zn上培养的hBMMSCs显示出完全延伸的伪足,具有明显的肌动蛋白丝,而在纯Zn组中观察到较少的伪足和次优伸长(图3B)。同样,扫描电镜(SEM)结果显示,hBMMSCs牢固附着在ss-HMC/Zn表面(图3C)。此外,CCK-8检测显示,ss-HMC/Zn培养的hBMMSCs的增殖能力优于纯Zn组(图3D)。这些结果表明,
与纯Zn相比,ss-HC/Zn和ss-HMC/Zn具有显著的生物相容性,并促进细胞生长和增殖
。培养7天后,免疫荧光(IF)染色显示,ss-HMC/Zn组的RUNX2的表达高于其他组(图3E)。同时,ALP活性和定量结果显示,与其他各组相比,ss-HMC/Zn显著提高成骨潜能(图3F、K)。qPCR显示,在孵育7天后,ss-HMC/Zn组中ALP和RUNX2的mRNA表达量显著高于其他两组(图3G)。14天后,IF染色显示,三组中ss-HMC/Zn中OCN的表达量最高(图3H)。此外,ARS染色证实ss-HMC/Zn组的钙结节数量最多(图3I、L)。OCN和BMP2的mRNA表达量在ss-HMC/Zn中最高(图3J),表明基质矿化程度显著。综上所述,
ss-HMC/Zn在基因、蛋白和宏观水平上促进成骨分化。
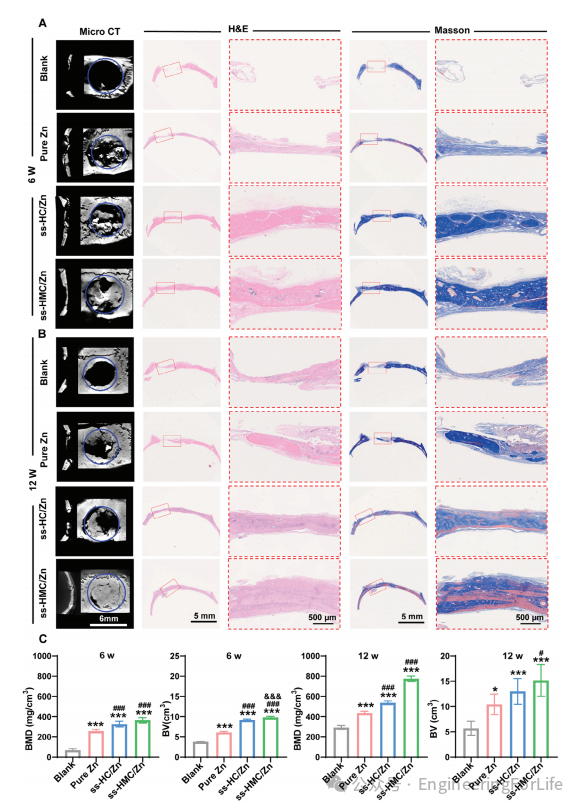
图4 ss-HMC/Zn引导下的体内骨再生
以纯Zn和ss-HC/Zn处理的大鼠为阳性对照,空白组为自愈模型。再生6周后,micro-CT结果显示ss-HMC/Zn组新形成的骨相对成熟和连续,而纯Zn和ss-HC/Zn实验组形成未成熟和断开的新骨(图4A)。将观察期延长至12周,以实现骨组织的完全再生。micro-CT结果显示,纯Zn组和ss-HC/Zn组形成大量新骨,而在颅骨缺损组中,只有ss-HMC/Zn组的颅骨缺损完全充满新形成的骨(图4B)。H&E和Masson三色染色显示ss-HMC/Zn组骨完全成熟,持续骨形成。如图4C所示,ss-HMC/Zn组新生骨体积(BV)显著高于ss-HC/Zn组、纯Zn组和空白组。

图5 体内细胞膜的形态学变化和细胞调控
接着研究不同时间点体内纯Zn、ss-HC/Zn和ss-HMC/Zn膜的形态。ssHMC/Zn在体内保持6周的实质性完整性,并作为屏障膜。而纯Zn降解过快,6周时出现明显裂纹。在6周时,在ss-HC/Zn组中观察到局部降解,降解率在纯Zn组和ss-HMC/Zn组之间(图5A)。随着时间推移,胶原蛋白结构由致密变为松散。植入6周后,在ss-HMC/Zn中仍可观察到胶原纤维的显微结构(图5B)。采用EDS图谱比较有机O和无机Ca、P、Zn的元素含量,表明在ss-HMC/Zn上沉积更多的Ca和P(图5C)。X射线光谱法(EDS)分析证实O、Ca、P、Zn在细胞膜中均匀分布(图5D)。为进一步探索ssHMC/Zn在体内调控细胞的机制,在植入2周后观察材料和缺损区域。在ss-HMC/Zn和ss-HC/Zn膜上,细胞形态的SEM图像显示出更长、更高的分支点,而在纯Zn膜上细胞呈圆形(图5E、H)。IF染色结果显示,ssHMC/Zn组的CD146和RUNX2的表达量高于其他各组(图5F),说明
早期的ss-HMC/Zn可能通过招募更多的宿主干细胞促进成骨
。缺陷区域的免疫组化分析显示,ss-HMC/Zn组中CD146、Ki67和CD34的表达较高(图5G、I),表明
ss-HMC/Zn通过干细胞招募、增殖和血管化促进成骨
。
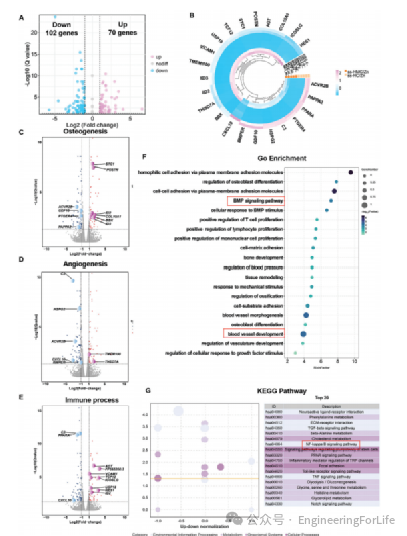
图6 通过转录组学分析,比较ss-HMC/Zn与ss-HC/Zn的成骨分化机制
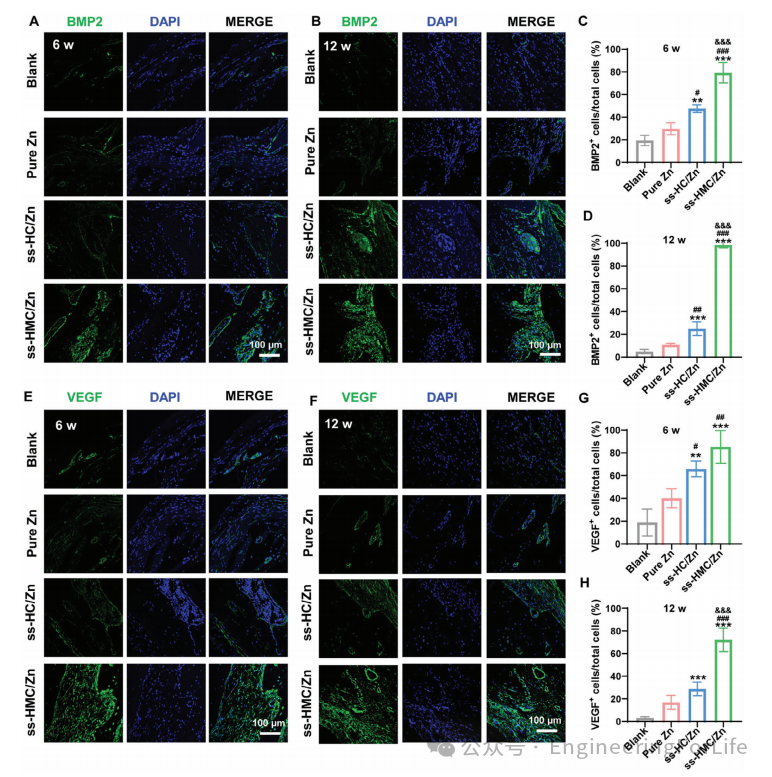
图7 通过BMP2信号通路的激活和血管生成促进骨再生
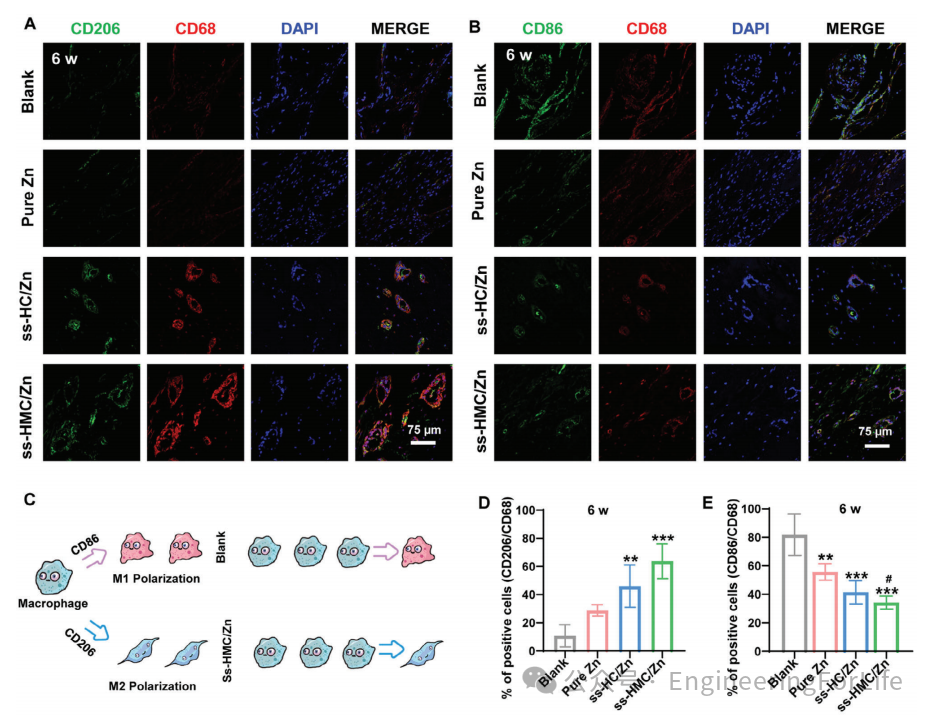
图8 通过M2极化增强骨再生
对ss-HMC/Zn、ss-HC/Zn和纯Zn培养的hBMMSCs进行转录组学分析,以阐明其成骨潜在机制。与ss-HMC/Zn组相比,ss-HC/Zn组有70个基因上调,102个基因下调(图6A)。这些基因中预测的FPKM和总外显子片段的圆形热图以及复杂网络如图6B所示。收集差异表达的基因,并将其分为三类:成骨、血管生成和免疫过程(图6C-E)。与ss-HC/Zn组相比,ss-HMC/Zn组中表达上调的基因在BMP信号通路、血管形态发生和NF-ƙB信号通路中富集(图6F、G)。
为进一步研究ss-HMC/Zn对血管生成和BMP信号通路的影响,对再生骨缺损区域进行IF染色。ss-HMC/Zn组BMP2阳性细胞比例显著高于ss-HC/Zn组、纯Zn组和空白组(图7A-D)。此外,IF染色结果还表明,与ss-HC/Zn,纯Zn和空白组相比,更多的VEGF阳性细胞表达在ss-HMC/Zn组(图7E-H)。
为了阐明宿主对生物材料的免疫反应在决定骨再生结果中的关键作用,检测植入6周后大鼠CD206和CD86的表达水平。与ss-HC/Zn组、纯Zn组和空白组相比,ss-HMC/Zn组CD206表达量升高,是典型的M2巨噬细胞标记物(图8A、D)。此外,与空白组、纯Zn组和ss-HC/Zn组相比,ssHMC/Zn组M1巨噬细胞标志物CD86表达较低(图8B、E)。综上,
Zn与HMC联合促进巨噬细胞向M2型极化,抑制巨噬细胞向M1型极化
(图8C)。
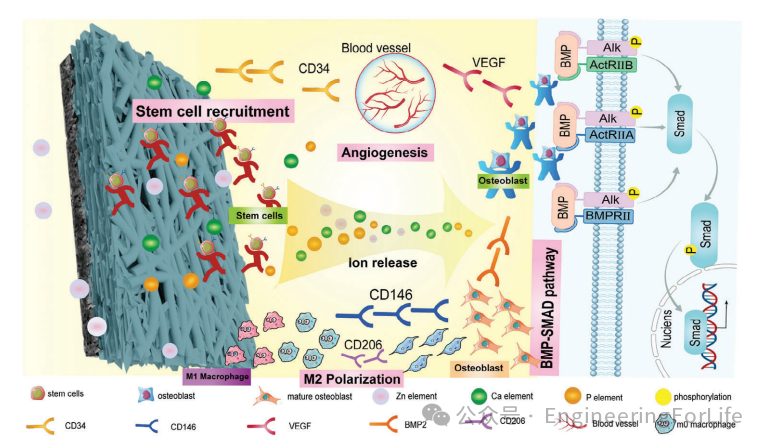
图9 s-HMC/Zn促进骨再生的示意图
在本研究中,巨噬细胞的命运调节是通过锌和胶原蛋白的联合作用来实现的,从而促进细胞分化为M2抗炎成骨表型。具有骨免疫调节能力的生物材料可以通过管理免疫反应增强成骨能力,为重建骨缺损提供另一种途径。总之,
ss-HMC/Zn膜通过招募宿主干细胞、刺激血管生成、促进M2极化、激活BMP信号通路,有效促进原位骨再生
(图9)。
全文小结
综上,
本研究通过自组装整合可生物降解的金属Zn和分层矿化的胶原蛋白,制备一种双层GBR膜
。研究发现,
s-HMC/Zn通过干细胞招募、促进血管生成、M2极化和BMP通路的激活在内源性骨再生中发挥着至关重要的调控作用
。紧凑的Zn层显示出
屏障功能和空间维护能力
。此外,HMC涂层阻止Zn离子的爆发释放,导致相对均匀的降解模式。体内、外实验结果显示,ss-HMC/Zn可显著促进BMMSCs的迁移和成骨分化。此外,ss-HMC/Zn调控巨噬细胞的募集和极化。因此,本研究为生物可降解材料在GBR膜中的应用提供新见解。
参考资料:
https://doi.org/10.1002/adfm.202412695
来源:EngineeringForLife
声明:仅代表作者个人观点,作者水平有限,如有不科学之处,请在下方留言指正!






