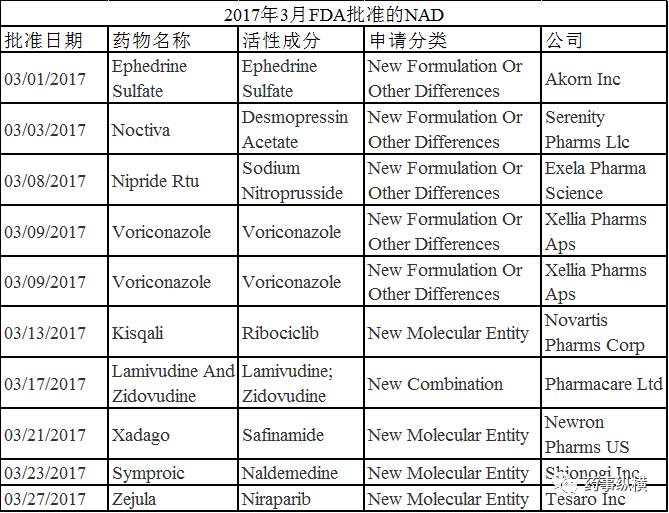
据FDA官方网站显示,2017年3月FDA共批准了11个新药申请(NDA),其中包括5个新分子单体(NME);39个仿制药申请(ANDA),其中包括2个首仿药。
3月FDA批准新药重磅多多,且听小编一一道来。
一、BLA

BAVENCIO
默克和辉瑞公司的BAVENCIO ®(avelumab)于3月24日获批,
用于治疗成人和12岁以上的儿童的转移性
Metastatic MCC
(Metastatic
细胞癌)。
Bavenclo作为一种PD-L1抗体,是FDA批准的第一个用于治疗MMCC的药物。转移性MCC是一种罕见皮肤癌,生存期达5年患者不到20%。
DUPIXENT
3月28日宣布,FDA批准赛诺菲/再生元的
Dupixent(dupilumab)注射液上市,用于局部治疗药物控制病情不佳的成人中重度特应性皮炎(一种常见的湿疹)。
去年12月14日辉瑞的小分子特应性皮炎药物Eucrisa(crisaborole,非甾体PDE4抑制剂)获FDA批准,是15年来首个治疗特应性皮炎的新分子实体。此次获批的赛诺菲Dupilumab是IL-4/IL-13单抗,是FDA批准的首个治疗特应性皮炎的生物制品。
特应性皮炎是一种常见的复发性、慢性炎性皮肤疾病,中重度特应性皮炎患者通常全身绝大部位皮肤长满红疹,引发强烈持续的瘙痒、皮肤干燥、结痂、渗液,治疗药物非常有限。
Dupilumab是Evaluate pharma 分析师最看好的一个产品,2017年最值得关注新药排名榜首,预测2022年的销售额达45.58亿美元。详见:2017最值得关注的top10生物制品+top10小分子新药
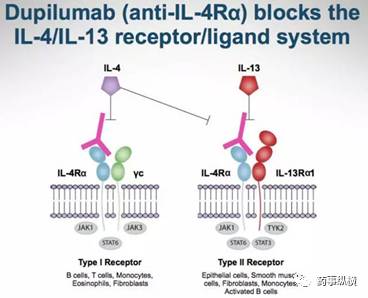
Dupilumbal作用机理(图片来源:SEC)
OCREVUS
3月28日,FD批准了
Ocrevus (ocrelizumab),
用于复发的多发性硬化症以及原发进展型多发性硬化症。然而“
既生亮,何生瑜
”
,就在FDA批准
Ocrevus的当天,FDA也批准了
DUPIXENT,光彩几乎被
DUPIXENT占尽。“亮”固然厉害,“
瑜
”也不是吃素的,它是MS领域第一个获得突破性疗法的产品,Evaluate pharma 预测其2022年的销售额可达39.85亿美元。
多发性硬化症(MS)是最常见的一种中枢神经脱髓鞘疾病。PPMS是多发性硬化症(MS)的一种严重病程类型,自病程开始便持续恶化,无明显的复发或缓解期,预后最差。PPMS约占MS病例的10%,ocrelizumab上市之前尚无任何药物获批治疗PPMS。

Ocrelizumab是一种以CD20(+)B细胞为靶点的人源化单克隆抗体,在疗效上,它比第一代抗CD20单抗Rituxan的治疗较果明显,对疾病活动的控制能力更强,抗体依赖细胞毒性强,免疫原性低。Ocrelizumab的优势是6个月输注一次,每年只需输注2次,有望显著改善MS患者的依从性,并且对RRMS及PPMS两种类型的MS均有治疗作用。
相关阅读:重磅!FDA批准首个治疗PPMS药物ocrelizumab
二、NDA
KISQALI
诺华新药Kisqali(ribociclib,即LEE011)于2017年3月13日获FDA批准,
与芳香化酶抑制剂联合作为一线治疗方案,
用于绝经后女性激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)晚期或转
移性
乳腺癌
的治疗
。
Kisqali是一种选择性细胞周期蛋白依赖性激酶(CDK4/6)抑制剂,此前已获得FDA优先审查资格。Kisqali是继辉瑞靶向抗癌药Ibrance之后,FDA批准的第二款CDK4/6抑制剂。CDK4/6在许多癌症中均过度活跃,导致细胞增殖失控。该药物能够促使细胞从生长期(G1期)向DNA复制期(S1期)转变。
基于III期临床研究MONALEESA-2的数据,在未接受系统治疗(即初治)控制晚期病情的HR+/HER2-晚期或转移性乳腺癌患者中,
与来曲唑单药治疗相比,Kisqali联合来曲唑使疾病进展或死亡风险显著降低了44%。
在中期分析时,该研究就提前达到了主要终点。额外随访11个月后开展的分析显示,
Kisqali联合来曲唑治疗组中位无进展生存期为25.3个月,来曲唑单药治疗组为16.0个月,
此外,Kisqali联合来曲唑治疗组有超过53%的患者其肿瘤体积缩至少30%。
辉瑞2015年2月获批的Ibrance累积销售额已近30亿美元,笑着数钱的辉瑞明年可能笑的不是那么开心了,Evaluate pharma 分析师预测,
Kisqali
在2022年的销售额可达15.02亿美元。
XADAGO
帕金森病患者在服用左旋多巴/卡比多巴过程中可能会出现“开-关现象”。FDA于3月21日批准
沙芬酰胺片剂(Xadago, Newron制药)可以作为伴有“关期现象”的帕金森病患者的辅助治疗。
有志者事竟成,屡败屡战终获得FDA批准,沙非酰胺
作为一个me-too药物,Xadago(沙芬酰胺)和Teva公司的Azilect(雷沙吉兰)和Selegiline (司来吉兰)均为MAO-B(单胺氧化酶B)抑制剂。MAO-B抑制剂通常作为单药治疗早期PD患者,或是补充到晚期PD患者的治疗方案中,以能更好地控制症状并减少所需的其他帕金森病药物的剂量。
SYMPROIC
3月23日,日本盐野义制药及美国普渡制药公司表示FDA已批准
Symproic® (Naldemedine) 0.2mg片剂用于慢性非癌性疼痛成人患者中阿片类药物引起的便秘的治疗。
Symproic由于化学结构类似于纳曲酮,属于美国《物质管制法案》附录 II管制物质,盐野义公司已经向美国禁毒署(DEA)提交了针对Symproic去管制的请求,目前仍处在审查阶段。
类似产品Movantik(naloxegol)已近上市数年,销售额表现并没有预想的那么好。
ZEJULA
自阿斯利康的同类药物Lynparza和Clovis的Rubraca相继上市,
Tesaro的PARP抑制剂niraparib(商品名Zejula)也于3月28日获得FDA批准,用于BRCA变异复发卵巢癌的治疗。
Zejula是第一个用于维持疗法的PARP抑制剂,用于维持处于应答阶段的病人。另外Zejula没有BRCA变异限制,所以适用人群大于前两个PARP抑制剂。临床研究显示,Zejula不仅延长15.5个月BRCA变异病人PFS,对BRCA无变异患者也有一定疗效(延长5.5个月PFS)。

Zejula对于现有的疗法来说,疗效是飞跃性的。对于癌症晚期的患者,没有几个人愿意继续接受化疗,是它给患者带来更长的寿命,更好的生活质量,更光明的希望——或许一天,新的抗癌药开始临床,参加试验或许又能活几年......













