事件
6月28日,盟科医药、信达生物向港交所递交招股说明书,成为歌礼、华领之后第三家、四家申请港交所上市且未有收入的生物科技企业。
【海通医药】赴港上市生物科技企业系列解读
1.
歌礼生物吹响赴港上市号角(附招股书摘要)
http://t.cn/RrQ4c2Z
2.
赴港上市第二家花落华领(附招股书摘要)
(点击打开)
3.盟科医药招股书摘要
http://t.cn/RrQb6c9
4.
信达生物招股书摘要 http://t.cn/RrQbPge
附:赴港上市各公司招股书下载链接(持续更新中,请保持关注)
http://t.cn/RrQc4Bl
(注:相关网址需要复制至浏览器打开)
1. 盟科医药招股说明书摘要
1.1. 公司概况
盟科医药是一家多重资产的处于临床试验阶段的生物制药公司,致力于发现、开发和商业化安全有效的用于治疗耐多药(“MDR”)“超级细菌”感染的抗菌疗法。将为全世界的病人提供安全有效的药物,以治疗耐药菌和其他微生物引起的感染作为自己的使命。

总裁 首席执行官袁征宇博士
袁博士拥有超过25年的药物发现和开发经验,在新型抗生素的研究和开发方面具有很强的专业知识。2007年,他创立了盟科公司,并被任命为总裁兼首席执行官。在盟科成立之前,袁博士是Vicuron Pharmaceuticals Inc.的高级副总裁负责研发,该公司后来被辉瑞成功收购。在Vicuron之前,袁博士曾在Syntex和Affymax 担任过各种管理职位。他在康奈尔大学获得生物化学博士学位,在复旦大学获得化学学士学位。袁博士已经发表了多项专利和30多篇同行评议的论文。
1.2. 大事记
|
2007年3月
|
本公司在开曼群岛注册成立
|
|
2016年2月
|
在中国开展contezolid的三期临床试验
|
|
2018年2月
|
在中国提交了口服contezolid acefosamilin的临床实验申请
|
|
2018年6月
|
从Recida T
herapeutics, Inc. 获得MRX-10的授权
|
资料来源:公司招股说明书
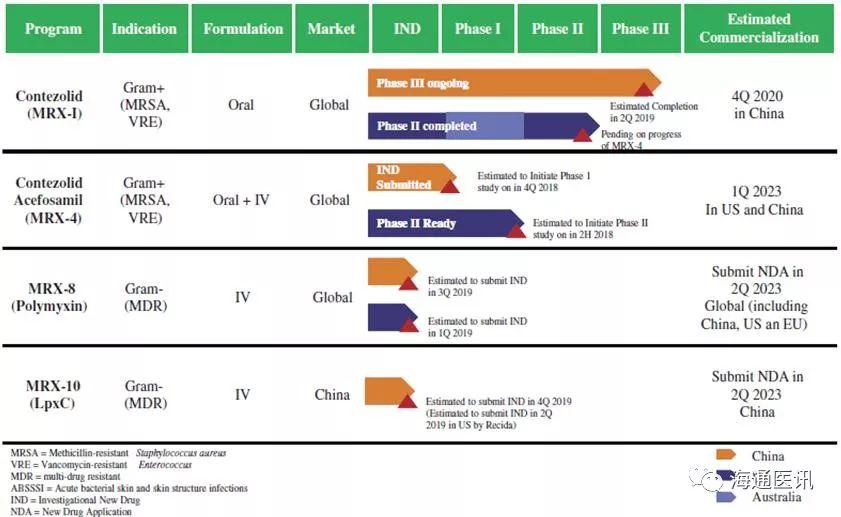
1.3. 研发管线
Contezolid (MRX-I)
该产品是一种潜在的新一代噁唑烷酮类抗生素,用于对抗革兰氏阳性多药耐药细菌引起的感染,包括但不限于耐甲氧西林金黄色葡萄球菌(“MRSA”)、耐万古霉素的金黄色葡萄球菌(“VRSA”)和耐万古霉素的肠球菌(“VRE”)。该产品的III期临床试验即将完成,我们预计将在2019年下半年在中国递交新药上市申请(NDA)。我们认为本品的优势为具有可显著降低噁唑烷酮类抗生素普遍存在的血液学不良反应的潜力。Contezolid被国家药品监督管理局(CNDA)指定为国家一类新药。我们相信,Contezolid的NDA申请将获得优先审评审批,以加速该产品在快速增长的中国医药市场的商业化进程。
contezolid acefosamil (MRX-4)
产品正在被开发成静脉注射和口服两种剂型以供全球范围使用。我们已经在2017年在美国完成了静脉注射和口服contezolid acefosamil (MRX-4)的I期临床试验,目前我们正在美国启动两种剂型产品的II期临床试验,拟用于治疗急性细菌性皮肤和软组织感染(ABSSI)。我们打算在美国、中国和欧盟进行静脉注射和口服contezolid acefosamil的多区域III期临床试验,拟用于治疗ABSSI和糖尿病足部感染(DFI),预计在2021年第四季度完成这些研究。根据这些试验的结果,我们计划在全球范围内,包括但不限于美国、中国和欧盟,提交contezolid acefosamil(包括静脉注射和口服)的NDA申请。
资料来源:
公司招股说明书
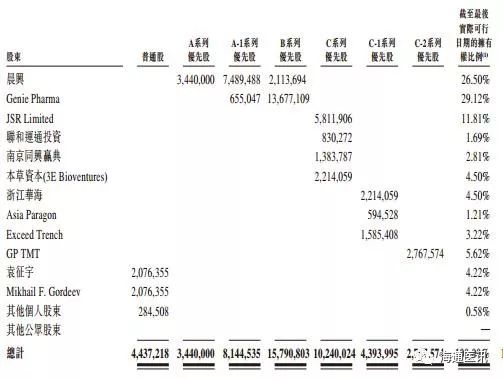
1.4. 股权结构
Genie Pharm是其最大股东,占比29.12%,创始人袁征宇博士持股占比4.22%
资料来源:
公司招股说明书
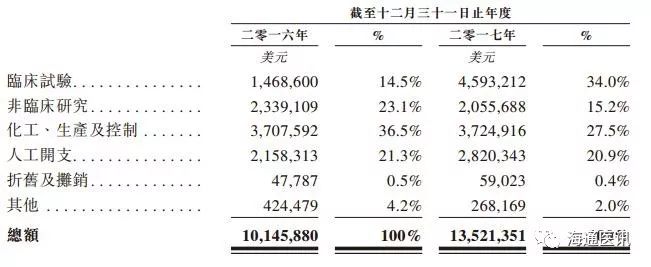
1.5. 财务数据
公司目前基本尚无营收收入,主要开支为研发费用和相关税费和行政开支
资料来源:
公司招股说明书
2. 信达生物招股说明书摘要
2.1. 公司概况
信达生物成立于2011年,致力于开发、生产和销售用于治疗肿瘤等重大疾病的单克隆抗体新药。
自成立以来,公司凭借创新成果和国际化的运营模式在众多生物制药公司中脱颖而出,获得了富达、礼来亚洲基金、美国资本集团、君联资本、淡马锡、国投创新等全球多家知名创投基金资本支持。已建立起了一条包括17个单克隆抗体新药品种的产品链,覆盖肿瘤、眼底病、自身免疫疾病、心血管病等四大疾病领域,其中2个品种入选国家“重大新药创制”专项,7个品种进入临床研究,4个品种进入临床III期研究。
目前,公司按照CFDA、美国FDA和欧盟EMA的GMP标准建成高端生物药产业化基地。产业化生产线已通过合作方国际制药集团产业化生产要求的GMP审计。已组建了一支具有国际先进水平的高端生物药开发、产业化人才团队,包括60多位海归专家。公司立足自主创新的产品与美国礼来制药集团达成了两次总金额超过10亿美元的全面战略合作,创造了多个“中国第一”。
“始于信,达于行”,开发出老百姓用得起的高质量生物药,是信达生物的理想和目标。
2.2. 发展历程
表1 信达生物发展历程
|
时间
|
研发线
|
融资线及其他
|
|
2011
|
8月
|
|
信达生物成立
|
|
10月
|
|
A轮融资500万美元
|
|
2012
|
6月
|
|
B轮融资3000万美元
|
|
12月
|
IBI-301递交IND申请
|
|
|
2013
|
7月
|
与Adimab建立战略合作
|
|
|
2014
|
1月
|
IBI-303递交IND申请
|
|
|
5月
|
|
产业化基地建成投入使用
|
|
9月
|
IBI-301收到IND批准
|
|
|
2015
|
1月
|
IBI-305递交IND申请
|
C轮融资1.15亿美元
|
|
3月
|
与礼来达成战略合作
|
|
|
12月
|
IBI-303、IBI-308递交IND申请
|
|
|
2016
|
5月
|
IBI-305收到IND批准
|
|
|
8月
|
IBI301项目进入临床III期 IBI-308收到IND批准
|
D轮融资2.62亿美元
|
|
9月
|
IBI303项目进入临床III期
|
|
|
2017
|
3月
|
与韩国韩美制药达成战略合作
|
|
|
5月
|
IBI-308进入临床III期
|
|
|
12月
|
IBI-308在美国递交IND申请
|
|
|
2018
|
1月
|
IBI-308到美国IND批准
|
E轮融资1.5亿美元
|
|
4月
|
信迪利单抗(IBI-308)申请上市,并获得优先审评资格
|
|
资料来源:公司官网、招股说明书
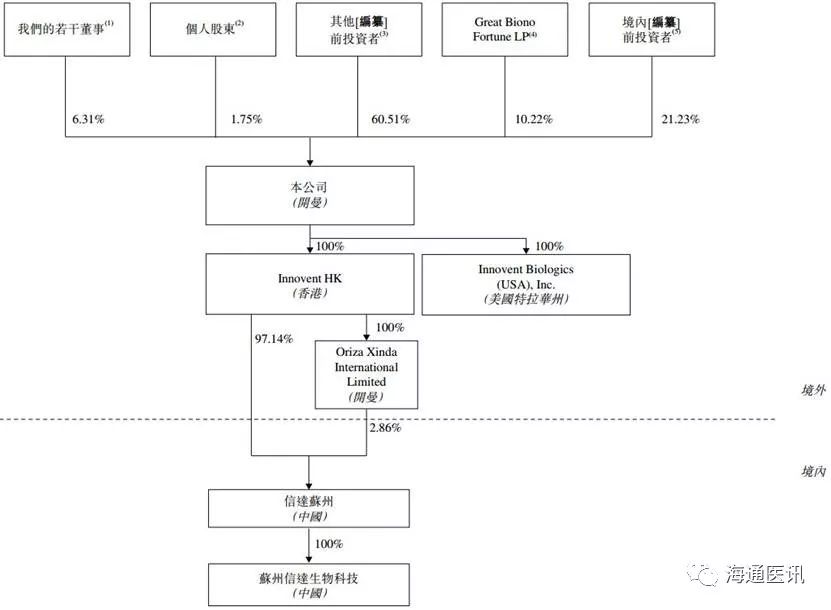
2.3. 股权结构
公司股权比较分散,前五大股东分别是Great Biono Forture LP(10.22%)、Seacliff(Cayman)Ltd(7.46%)、TLS Beta(7.31%)、Asia Ventures(8.86%)、F-Prime Capital(8.86%)。第一大股东Great Biono Forture LP持有的9010万股中,公司CEO俞德超博士持股5951万股(占总股本6.31%),CFO奚浩先生持股954万股(占总股本1.06%)。
图1 信达生物股权架构
资料来源:公司招股说明书
2.4. 研发管线
公司在过去七年建立了一条由17种抗体候选药物组成的产品管线,其中四种在中国进入后期临床开发的核心产品(包括新型的PD-1抗体信迪利单抗(IBI-308)、贝伐珠单抗(阿瓦斯汀)生物类似药IBI-305、利妥昔单抗(美罗华/Rituxan)生物类似药IBI-301和阿达木单抗(修美乐)生物类似药(IB1-303)处于主导地位。此外,在由17种候选抗体药物组成的产品管线中,七种候选药物在中国处于临床开发阶段,包括三种指定一类候选药物(信迪利单抗、IBI306及IBI-302),及四种指定二类候选药物(IBI-310、IBI-301、IBI-303及IBI-305)。
图2 信达生物研发管线
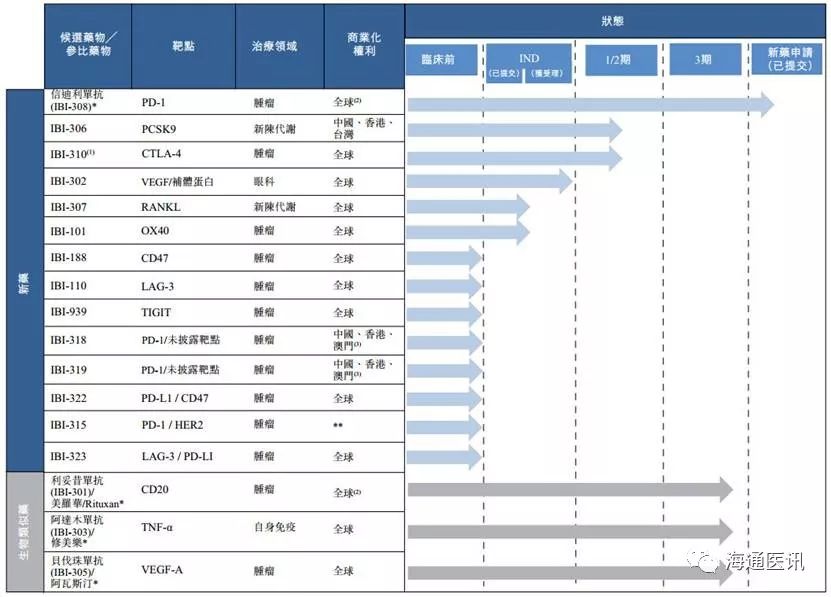
资料来源:公司招股说明书
2.5.技术优势
(1)全面集成的生物药物平台
在自2011年成立以来的七年中,公司已建立一僚由17种单克隆抗体候选药物组成的产品管线,包括四种正在中国进行后期临床开发的核心候选产品。已建立一个涵盖所有关键的生物药物研发功能(包括发现、工艺开发、分析科学、质量控制及保证丶临床开发、制造和商业化)的全面集成的端到端生物治疗平台,并已成功、快速及高效地研发出产品的管线。
(2)有望成为同类中最佳的创新PD-1单克隆抗体新药申请
信迪利单抗是一种创新全人源PD-1单克隆抗体,并为在中国获接纳新药申请并被纳入优先审评程序的首批PD-1单克隆抗体之一。PD-1/PDL1抗体和其他免疫肿瘤药物已彻底改变了许多癌症的治瘰方法,并在多种癌症中显示出具有较化疗及其他疗法显著的临床疗效。根据弗若斯特沙利文的资料,于2017年,PD-1/PD-L1抗体的全球销售额超过101亿美元,但迄今为止仅一种PD1/PDL1抗体(即百时施贵宝的PD1抗体 Opdivo(纳武单抗))已在中国获批淮,并已于2018年6月15日获CFDA批淮用于治疗局部晚期或转移性非小细胞肺癌。公司研发信迪利单抗以治疗多种癌症,目前正在将信迪利单抗作为单一疗法并结合其他疗法进行临床试验。尤其是,部分信迪利单抗形成公司处于〔临床前〕开发阶段的三种双特异性抗体候选药物(包括IBI318IBI319及IBI-315)的抗PD-1部分。
在中国对96例患有复发/难治性经典霍奇金淋巴瘤患者进行治疗的注册临床试验中,信迪利单抗显示出79.2%(第24周数据)的总体缓解率(OR)和17.7%(第15周数据)的完全缓解率,其安全性和毒性特微可与现有获批淮的PD-1抗体相媲美。基于其生化及生物属性,信迪利单抗有望成为同类中最好的PD-1抗体。例如,基于生化测定,信迪利单抗能够分别以高出派姆单抗(默克Keytruda)和纳武单抗(百时美施贵宝Opdivo)10倍及50倍的亲和力更紧密地结合其靶点(称作高亲和力),并基于体内药效学比较数据,信迪利单抗还在给定药物浓度下比纳武单抗占据更多可用PD-1结合位点(称作靶点占有率)。与现有已批淮的PD-1抗体相比,预计信迪利单抗的这些特征将导致在相同或更低的剂量水平及相同或更低的给药频率下取得更好的临床效力。公司将根据有关协议在中国与礼来共同推广及联名销售信迪利单抗,一旦获CFDA批淮,计划于2019年推出信迪利单抗。
(3)中国III期临床试验中的三种候选生物类似物
目前公司在中国有三种生物类似物正在进行III期临床试验,该等类似物均具有巨大的商业化潜力。每种该等药物的参比药品均获准治疗多种适用症:



(4)创新单克隆抗体和双特异性抗体候选药物的强大产品管线
除四种核心产品外,公司拥有创新单克隆抗体候选药物的强大产品管线,专门针对那些病患需求远未被满足且潜在市场范围巨大的药物,包括同时结合两种不同靶点的双特异性抗体产品。该产品管线包括目前正在中国进行临床开发及在中国办理创新药登记手续的三种候选药物,即:
















