正文
相较于2016年8家中国制药企业在美国收获22个ANDA批件而言,2017年31个ANDA正式文号、7个暂时性批准文号的战果,似乎在彰显着中国制药军团进军国际市场的水平已又高一筹。
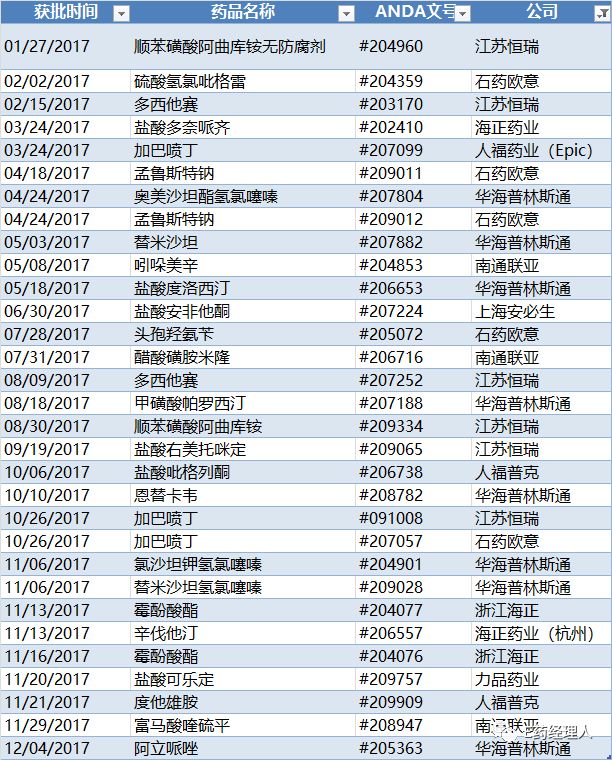
2017在美获得ANDA情况一览
具体来看,2017年在美国取得ANDA正式批准文号的仍然是八家公司,按照获批数量由多至少,依次是华海普林斯通(8个)、江苏恒瑞(6个)、石药欧意(5个)、海正药业(4个)、人福药业(3个)、南通联亚(3个)、上海安必生(1个)、力品药业(1个)。
而取得暂时性批准文号的则涌现出一些新鲜面孔,如瑞阳制药的枸缘酸西地那非、海正宣泰的盐酸二甲双胍、华仁药业的缬沙坦氢氨噻嗪以及杨凌步长药业的他达拉非。
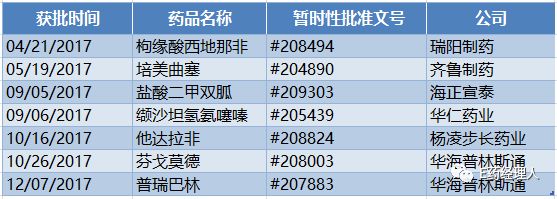
2017年ANDA暂时性批准一览
华海药业:稳居榜首
在所有上榜企业中,一马当先的仍然是华海药业。作为国内首家通过FDA认证的制剂企业以及得到国际认证最多的制剂企业之一,华海药业近年来在制剂出口以及国际化发展领域俨然已经打出了自己的招牌形象。根据上市公司公告统计,自2007年以来,除2009年一年出现空档之外,每年华海药业都有相应的品种在美国获批,且数量近年来基本呈逐年增加的态势,2016年其共有6个品种获批,而2017年则达到历史最高,算上暂时性批准的两个产品,华海一共有10个产品在2017年获批ANDA。
而在所有这些产品中,最值得关注的是2017年8月获批的帕罗西汀胶囊,这是中国第一个专利挑战成功的品种。此前,华海子公司普林斯通与Actavis两家公司均就该产品对帕罗西汀胶囊的原研公司Noven提出了专利挑战,最终华海率先挑战成功。
要知道,这对于华海来说绝对是一件意义非凡的事情。想要成为一流仿制药企业,构建起一个架构完整的专利挑战体系与良好的专利诉讼体系是一件必须的事情,据悉,目前华海上百个仿制药项目至少涉及40个专利挑战项目,而一旦专利挑战成功,无疑就意味着抢占市场的能力进一步增强。帕罗西汀胶囊的成功获批就证明了这一点。
而另外一个值得关注的则是力品药业(厦门)获批的盐酸可乐定缓释片。这款药是由华海美国与力品药业共同投资、力品药业负责产品开发的品种。近年来,技术难度更高的缓释剂型已经成为了华海重点攻克的方向,目前从2013年至今也已有5个缓释剂型获批。
据西南证券测算,华海药业此次获批的11个品种(包括与力品药业共同开发的盐酸可乐定缓释片)于2016年在美国市场的销售总金额为92.28亿美元,如果按照平均10%的市占率测算,在美国的峰值销售将达到9.2亿元。如果按照出厂价为终端售价的20%、净利率为15%进行测算,则将预计给华海带来12.0亿元的收入增量预计1.8亿元的利润增量。
恒瑞医药:厚积薄发
尽管相对于华海药业来说,恒瑞医药2017年6个ANDA似乎不足为道,但对于恒瑞医药自身而言,这绝对是一个爆发。要知道,自2011年恒瑞医药第一个ANDA盐酸伊立替康获批开始算起,到2017年之前,恒瑞医药也一共只有5个ANDA获得了批准。
仍然同此前的特点一样,此次获批的6个ANDA中,有5个都是注射剂,这跟恒瑞医药制剂国际化的战略有关,一直以来恒瑞都将视线集中在注射剂等工艺复杂、技术难度较高的领域,以及抗肿瘤、手术麻醉等市场容量极大的领域,此前获批的5个ADNA之中,也有3个都是注射剂。也正因此尽管数量相对较少,但几乎恒瑞医药获批的产品都是能带来大量利润的重磅产品。
而在国际化与创新并重的战略之下,国际市场也已经成为恒瑞越来越重要的发展动力之一。恒瑞此前便表示,将会加快推进海外市场,力争未来几年内使所有主力品种全部通过美国FDA或欧盟认证,为开拓海外市场打基础。
石药欧意:跃升黑马
实际上,除了华海普林斯通之外,人福医药以及南通联亚的出现都不足为奇。已经顺利完成收购的美国仿制药Epic已经开始为人福医药贡献ANDA,而人福普克2017年也顺利拿下两个ANDA批文。南通联亚作为始终以欧美高端市场为主的非专利药研发和生产企业,近年来也是在美国FDA利好消息不断,尤其是去年在国内也有步长制药就硝苯地平控释片、盐酸二甲双胍控释片等5款药物达成了长期合作,其发展态势也可见一斑。
令人惊喜的是石药欧意在过去一年ANDA方面的表现。早在2016年,石药欧意 就已经拿下了盐酸二甲双胍片的ANDA,而在CDE于2017年4月13日发布的第15批优先审评名单中,该药赫然在列,其被纳入优先审评的理由则为“同一生产线,已在美国上市,申请国内上市的仿制药”,而这时CDE首次以此理由将相关品种纳入优先审评名单。而在2017年,石药欧意则又拿下五个ANDA文号,其中包括硫酸氢氯吡格雷这样市场表现良好的品种,对于石药集团而言,这无疑是个好消息。
海外制剂回归国内
尽管对于制药企业而言,能否通过FDA认证以及ANDA品种数量的多少,在很大程度上代表了企业的国际市场竞争力与影响力,但在如今的政策环境下,必须看到的一点是,海外认证品种的国内价值正日益凸显,石药集团盐酸二甲双胍片被纳入优先审评,就是一个典型的例子。
而这种政策环境,实际上主要还是两点,这也是在企业制剂国际化力量增厚的同时,国内市场不可忽视的两条路径:一是国内转报品种纳入优先审评,二是共线产品快速通过一致性评价。可以看到的是,目前国内政策对已在海外获批的高质量ANDA品种已提供了全方位的支持,从注册到招标到医保都提供了配套政策。
在注册申报层面,目前已经明确指出已在海外获批的ANDA产品可以简化一致性评价相关流程,如国内药品生产企业已在欧盟、美国和日本获准上市的仿制药,可以国外注册申报的相关资料为基础,按照化学药品新注册分类申报药品上市,批准上市后视同通过一致性评价;而在中国境内用同一生产线生产并在欧盟、美国和日本获准上市的,亦视同通过一致性评价。
这就意味着这些产品无需在国内做药学研究和BE试验,既能节约时间又能减少研发支出。一般而言,药学+BE需要一年时间,研发支出则在500万至800万元左右,如此一来制药企业便可以以更快的速度通过一致性评价,抢占国内市场。
仍然以华海药业为例,其申报的8个一致性评价产品于2017年6月7日或2017年7月31日获得注册受理,9月25日进入审评中心,7个产品于12月27日获批成为首批通过一致性评价的国内仿制药并进入中国上市药品目录集,从注册受理到获批仅6个月的时间,真正的审批时间仅3个月时间。此外还有6个ANDA产品转报国内生产的注册申请,已有5个品种进入优先审评。
而快速通过一致性评价则意味着产品在未来的市场招标中将得到巨大的优势。按照当下的政策,同品种药品通过一致性评价的生产企业达到3家以上的,卫生计生部门在药品集中采购等方面不再选用未通过一致性评价的品种。而一致性评价也已在多地被纳入原研竞价层次。















