
DNA
甲基化与2 型糖尿病发病机制研究进展
孙宝
1,2
,张伟
1,2
*
(1. 中南大学湘雅医院临床药理研究所,湖南长沙410008;2. 中南大学临床药理研究所遗传药理学湖南省重点实验室,湖南长沙410078)
[
摘要]
2
型糖尿病(T2DM)的发病机制主要与遗传因素和环境因素相关。而遗传变异和环境因素可通过表观遗传修饰,如DNA 甲基化等影响相关基因的转录与表达,导致胰岛β 细胞的胰岛素分泌异常和机体对胰岛素的耐受,最终影响T2DM 的发生。综述胰腺、骨骼肌、肝脏、脂肪组织和外周血等胰岛素重要靶器官中相关基因DNA甲基化改变及其在T2DM 发病机制中的作用研究进展,为T2DM个体化治疗提供新思路。
[
关键词]
2
型糖尿病;DNA 甲基化;胰岛素分泌;胰岛素耐受;基因
2
型糖尿病(
type 2 diabetes mellitus
,
T2DM
) 是一类由于胰岛
β
细胞损伤和机体对胰岛素耐受引发的慢性代谢性疾病,随着人口老龄化和人们生活方式的转变,其患病率呈逐渐递增的趋势。
2015
年,国际糖尿病联盟(
International Diabetes Federation
,
IDF
)第7 版糖尿病地图数据显示,全世界糖尿病患者近
4.15
亿,预计到
2040
年,糖尿病患者人数可能会增至
6.42
亿。此外,
T2DM
可并发或继发高血压、冠心病、脑卒中、大血管和微血管并
发症等慢性病症,给全球医疗卫生体系带来巨大挑战,因此糖尿病及其并发症的防治已成为全球研究的热点。
流行病学研究表明,
T2DM
的发病机制主要与遗传因素和环境因素相关。而遗传变异和环境因素可通过表观遗传修饰(如
DNA
甲基化等)影响相关基因的转录与表达,最终导致
T2DM
的发生发展。
T2DM
全基因组关联研究也表明,
DNA
甲基化状态的改变在
T2DM
发病机制中可能发挥重要作用。本文就胰腺、骨骼肌、肝脏、脂肪组织和外周血等胰岛素重要靶器官中相关基因
DNA
甲基化改变在
T2DM
发病机制中的作用研究进展作一综述,旨在为
T2DM
个体化治疗提供参考。
1 DNA
甲基化
在哺乳动物基因组中,
DNA
甲基化是指经甲基转
移酶催化胞嘧啶鸟嘌呤二核苷酸(
cytosine-phosphateguanine,CpG
)中胞嘧啶环
5
位上的胞嘧啶转化为甲基胞嘧啶。
DNA
甲基化可能阻碍转录因子与启动子结合或与转录抑制子结合,改变染色质结构,进而对基因表达发挥重要调节作用。人类约
60%
基因的启动子含有
CpG
岛,
CpG
岛由
CpG
位点构成,且是发生甲基化的必要条件;基因表达与其启动子的甲基化呈反比,即低甲基化的基因,表达水平较高,反之,高甲基化的基因,表达水平较低。
DNA
甲基化水平受环境、年龄、性别、疾病及药物等因素的影响,且个体不同的发育时期,其
DNA
甲基化状态和程度均可能存在一定差异。
T2DM
的发生是一个多步骤、多因素参与的复杂过程,环境、年龄、并发症等因素均可能引起与胰岛素敏感和胰岛素耐受相关基因甲基化状态和程度的改变,导致其表达异常,进而促进
T2DM
的发生(见图
1
)。
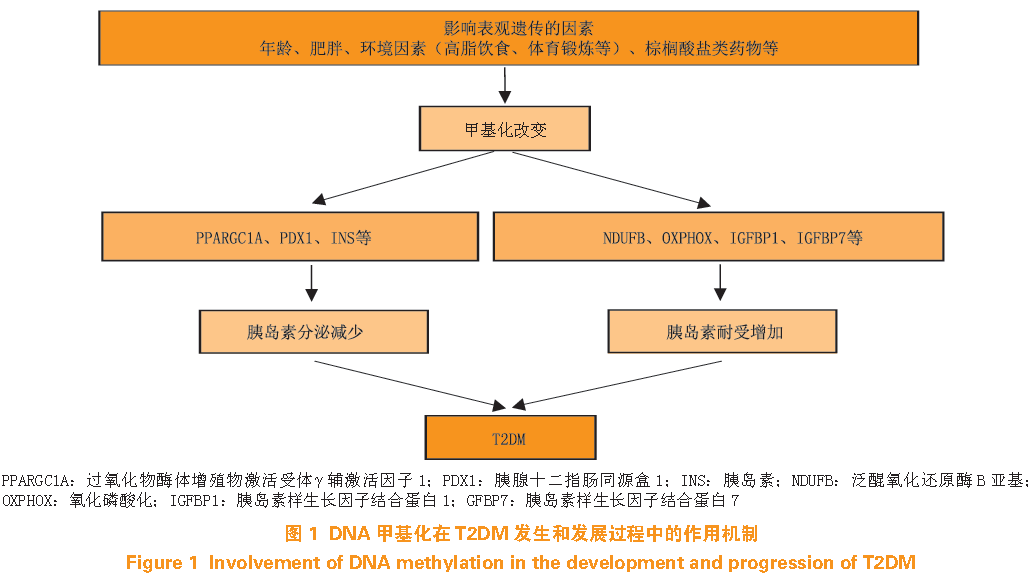
2
不同组织中DNA 甲基化与胰岛素分泌减少
胰岛
β
细胞分泌胰岛素对于维持机体正常的血糖浓度至关重要,而且在
T2DM
的发生和发展过程中机体对胰岛素需求的异常增加常作为胰岛素产生耐受的表现。近年来,随着高通量技术的不断发展,发现并证实胰岛素敏感基因甲基化的改变对其表达产生影响,进而导致胰岛素分泌异常。因此,探究影响胰岛
β
细胞功能的作用机制对于找寻糖尿病新的治疗方法具有重要意义。
2.1
胰岛组织
线粒体产生
ATP
是胰岛
β
细胞分泌胰岛素的重要因素,而
PPARGC1A
是调节线粒体功能的基因,其表达水平的降低将导致
ATP
产生量减少,进而损伤胰岛
β
细胞,使葡萄糖刺激的胰岛素分泌减少。
Ling
等
利用候选基因法证实,在
T2DM
患者胰岛组织中
PPARGC1A
基因高甲基化与胰岛素分泌减少密切相关。
Travers
等
利用同样方法发现,
KCNQ1
(电压门控钾离子通道亚家族成员
Q1
)基因甲基化改变与糖尿病早期发病风险相关。作为胰岛素分泌调节的重要基因,
INS
的甲基化修饰与
T2DM
的发病密切相关。研究发现,
T2DM
患者胰岛
β
细胞中
INS
启动子呈去甲基化状态可能影响胰岛
β
细胞的发育成熟,从而影响胰岛素的分泌。但
Yang
等
发现,
T2DM
患者胰岛组织中
INS
启动子区域
4
个
CpG
位点呈高甲基化状态,且与糖化血红蛋白的浓度呈正相关。
PDX1
是促进胰岛
β
细胞成熟和维持其功能的重要转录因子。研究发现,
PDX1
的高甲基化可抑制其转录活性,导致胰岛
β
细胞功能紊乱。此外,
Hall
等
发现,在
T2DM
患者胰岛组织中
GLP1R
(胰高血糖素样肽
1
)基因的高甲基化与体质量指数、糖化血红蛋白的浓度呈正相关。
随着高通量技术的不断发展,全基因组表观遗传的应用研究也越来越广泛。
Volkmar
等
发现,
276
个
CpG
位点对应的
254
个基因在
T2DM
患者胰岛组织与正常人胰岛组织中的甲基化状态存在差异。
Dayeh
等
发现,
T2DM
患者胰岛组织的转录起始位点附近呈低甲基化状态,而远离转录起始位点的区域呈高甲基化状态。
Olsson
等
通过全基因组表观遗传及功能性分析证实,谷胱甘肽过氧化物酶
(Glutathione peroxidase, GPX7)
、
谷胱甘肽
S
转移酶
θ1
(
Glutathione S-transferase theta 1
,
GST
)和选择连接蛋白
19
(
sorting nexin 19
,
SNX19
)的候选基因能直接影响胰岛
β
细胞的增殖和凋亡。
Hall
等
发现,经棕榈酸盐处理的
T2DM
患者胰岛组织与不处理的组织间
1 860
个基因甲基化存在显著差异,致使其表达异常,损伤胰岛
β
细胞分泌功能。
2.2
外周血细胞
与胰岛组织一样,
T2DM
患者外周血细胞中相关基因甲基化水平的改变也会引起基因表达异常,且可能成为诊断
T2DM
的分子标志物。
Bell
等
发现,
rs8050136
等位基因突变能改变脂肪与肥胖相关(
fat mass and obesity associated
,
FTO
) 基因甲基化状态,增加
T2DM
与肥胖的发病风险。对外周血细胞全基因组甲基化研究发现,
FTO
的低甲基化状态可作为
T2DM
患者早期发病的标志物。
Canivell
等
发现,
T2DM
的另一风险基因
TCF7L2
启动子的甲基化与空腹血糖水平相关。单核细胞趋化蛋白
1
(
monocytechemoattractant protein-1
,
MCP-1
)是一种强效趋化因子,其在
T2DM
患者动脉粥样硬化的形成和发展过程中起重要作用。研究发现,外周血单核细胞中
MCP-1
基因的低甲基化与血糖浓度相关,且在
T2DM
并发心血管疾病中发挥重要作用。
del Rosario
等
提出,青年人中的成年发病型糖尿病(
maturity onset diabetes of theyoung
,
MODY
)和
T2DM
相关基因甲基化的改变,能够影响胰岛
β
细胞的功能,增加
T2DM
的患病风险。
3
不同组织中DNA 甲基化与胰岛素耐受
胰岛素耐受主要发生在肝脏、骨骼肌和脂肪组织中,是指机体对胰岛素的敏感性降低,且利用胰岛素促进葡萄糖代谢能力的下降,是
T2DM
发病的机制之一,也是
T2DM
的主要病理生理特征之一。胰岛素耐受相关基因甲基化与
T2DM
部分发病机制密切相关,针对其相关研究可能为
T2DM
的治疗提供新思路。
3.1
骨骼肌组织
骨骼肌是摄取葡萄糖的重要组织器官,且该过程受机体锻炼的刺激。骨骼肌对胰岛素产生耐受直接影响葡萄糖摄取的过程,进而影响机体血糖浓度。研究发现,老年
T2DM
患者骨骼肌组织中
NDUFB
启动子
rs629566
位点突变与
DNA
甲基化状态的明显降低有关,并且可增加
T2DM
患者对胰岛素耐受。
Rӧnn
等发现,
T2DM
患者骨骼肌组织中
OXPHOS
基因的甲基化与胰岛素耐受相关,且年龄因素会影响
OXPHOS
基因的表达和甲基化状态。
Barrès
等
发现,急性运动能够改变糖尿病患者骨骼肌组织中相关基因启动子的甲基化状态,改善骨骼肌组织的糖代谢。
3.2
肝脏和脂肪组织
作为内分泌器官,肝脏和脂肪组织影响许多代谢通路,且在维持葡萄糖稳态过程中发挥重要作用。全基因组
DNA
甲基化研究表明,
T2DM
患者与正常人脂肪组织间基因存在显著差异,且这些基因可能参与炎症、糖耐受和胰岛素耐受等过程,从而增加
T2DM
的患病风险。
Crujeiras
等
利用全基因组甲基化研究发现,在
T2DM
患者内脏脂肪组织中胰岛素耐受基因和糖尿病肥胖发病相关。
Parrillo
等
证实,高脂饮食的小鼠脂肪组织中同源盒基因
Hoxa5de
高甲基化与糖耐受和胰岛素敏感相关。
Kirchner
等
发现,在
T2DM
患者肝脏组织中糖酵解和胰岛素耐受相关基因的低甲基化与
T2DM
合并肥胖的发病密切相关。
3.3
外周血细胞
近年来研究发现,除骨骼肌、肝脏和脂肪组织外,外周血细胞中基因甲基化状态改变也与胰岛素耐受有关。
Zhao
等
发现,
T2DM
患者外周血白细胞中短片段重复序列的甲基化和胰岛素耐受密切相关。在瑞典人群外周血细胞中
IGFBP1
和
IGFBP7
基因的甲基化导致血清中
IGFBP1
和
IGFBP7
水平的降低,该过程可能与
T2DM
患者胰岛素耐受相关。
Simar
等
发现,
T2DM
患者外周血自然杀伤细胞和
B
细胞
DNA
甲基化和胰岛素耐受呈正相关,且与
T2DM
肥胖患者发生免疫和代谢紊乱相关。
4
结语
T2DM
是由于环境因素和遗传变异因素综合作用引起的多基因遗传复杂性疾病。近年来研究发现,遗
传变异和表观遗传可能共同导致
T2DM
的发病。
Dayeh
等
发现,
T2DM
相关风险基因突变引入或去除
CpG
位点,导致其甲基化状态的改变,进而导致胰岛素分泌异常和胰岛素耐受。尽管遗传变异和表观遗传阐释了
T2DM
的发病风险,但表观遗传修饰(如
DNA
甲基化)在
T2DM
发生发展中的具体作用机制尚未完全阐明,仍有许多问题亟待解决。
Flannick
等
提出,建立
T2DM
基因数据库,可更好地促进对于复杂疾病的研究与治疗。同样,通过建立表观遗传数据库,结合
T2DM
基因数据库,将为
T2DM
的个体化诊疗提供帮助。近年来多篇文献报道,非编码
RNA
(
no-codingRNA
)表观遗传的改变也参与了
T2DM
的发病过程。如对大鼠胰岛敏感器官组织的全基因组
microRNA
表达谱研究发现,
microRNA
与糖代谢调节相关。此外,
Kameswaran
等
发现,
microRNA
如
IAPP
和
TP53INP1
启动子的高甲基化与胰岛
β
细胞凋亡相关。综上所述,基因的表观遗传修饰如
microRNA
、
DNA
甲基化在糖尿病的发生发展中起重要作用,对其深入研究将为
T2DM
预防和个体化治疗提供新的思路。

[
专家介绍]
张伟:
中南大学升华特聘教授,博士生导师。首批国家万人计划“青年拔尖人才”,国家自然科学基金委员会“优秀青年科学基金”获得者。现任中南大学湘雅医院临床药理研究所副所长,中南大学湘雅医学检验所常务副所长,国家卫计委个体化医学培训基地副主任,教育部药物基因组应用技术工程中心主任,教育部新世纪优秀人才,湖南省遗传药理学重点实验室副主任。担任国际药物基因组学倡导组织(
PGENI
)东亚中心副主任,首届中国药理学会药物基因组学专业委员会秘书长、常委,湖南省药学会药物基因组学专业委员会副主任委员,湖南省药学会理事,湖南省生理学会理事等职务,国家新药评审专家。主持
863
计划,国家科技重大专项,国家自然科学基金青年、面上及优青项目,教育部博士点基金,湖南省科技计划,湖南省重点实验室创新课题,新药研究国家重点实验室开放课题等
20
余项。获中华医学会科技进步奖、中国药学会科技进步奖、湖南省科技进步奖、湖南省医学科技奖、教育部霍英东青年教师奖、赛诺菲青年生物药学奖等10 余次。在
Trend Mol Med
、
Kidney Int
、
Lancet
、
Clin Pharmacol Ther
、
Carcinogenesis
、
Clin Pharmacokinet
、
J Pharmacol Exp Ther
等权威期刊发表论文
100
余篇,其中
SCI
论文
70
余篇,申请国家发明专利
10
项、授权
1
项。主编参编教材专著
15
部(含英文专著
4
部),担任
《新编遗传药理学》
主编,
《遗传药理学》
第2 版副主编,
《临床药理学》
全国本科生教材编委,美国本科生选修教材《
Pharmacogenomics and Stratified Medicines
》编者。权威期刊
Pharmacogenomics
杂志编委,
Int J Genomics Proteomics
副主编,
《中国临床药理学与治疗学》
杂志编委,
Mol Pharm
、
Clin Ther
、
PLoS One
等杂志特邀审稿人。
●
感谢您阅读《药学进展》微信平台原创好文,也欢迎各位读者转载、引用。本文选自《药学进展》2017年第8期。
●
《药学进展》是一本专注于医药领域前沿动态的专业媒体,月刊,铜版纸全彩印刷,全年360元,欢迎订阅!编辑部官网:www.cpupps.cn;电话:025-83271227。






