BioArt按:动力蛋白(Dynein)是一类复杂的多亚基蛋白质复合体,可沿微管“行走”进行物质运输,在细胞中的功能至关重要。尽管动力蛋白半个世纪以前就已经被发现,但是和其它一些细胞骨架依赖的分子马达(比如肌球蛋白或驱动蛋白)相比较,其功能机制研究方面一直都充满谜题。由于动力蛋白分子量大而且具有高度的复杂性,再加上过去客观存在的技术瓶颈,所以长期以来都没有获得其完整的结构。在过去几年,冷冻电镜技术蓬勃发展,使得动力蛋白结构研究成为可能。6月8日,来自剑桥MRC分子生物学实验室Andrew Carter组在Cell杂志上发表了题为“Cryo-EM Reveals How Human Cytoplasmic Dynein Is Auto-inhibited and Activated”的论文,对完整人源细胞质动力蛋白的结构研究取得重大突破。该研究利用冷冻电镜技术首次获得了具有高度柔性和多尺度复杂构象的完整人源动力蛋白(dynein-1)超大分子复合物高清结构,以及具有37个亚基的dynein/dynactin/BICD三元复合物中等分辨率结构,并结合突变分析、单分子荧光、在体细胞实验等结果,提出了动力蛋白最深刻的自抑制和激活机制。该研究是继该研究组于2015年发表Science封面文章报道动力激活蛋白(Dynactin)结构之后,在动力蛋白结构和机制研究领域的又一项重要成果。该论文的第一作者是Carter实验室的博士后张凯以及博士生Helen Foster,通讯作者是Andrew Carter。鉴于该成果的重要性,BioArt特别邀请到了北京大学分子医学研究所陈雷研究员和剑桥MRC-LMB的畅磊福博士撰写了相关精彩点评,以飨读者!

论文解读:
Dynein研究背景
生命在于运动,活的生命体必然分秒不停的发生各个层次的运动。生物大分子的精确定位、定量富集或精密组装,各种细胞器、亚细胞结构之间严格的时空关系、有序分布以及它们之间的紧密协作,细胞本身的宏观运动,大型生物体的各种组织、器官乃至整个个体的运动等等,最终都归因或部分归因于细胞内部或表面的一类被称作分子马达(Molecular Motor)的生物大分子。分子马达产生是生命体将化学能转化为动能的大分子机器,这个过程是一种主动的运动。无机或有机小分子的自由扩散或部分转运过程(逆浓度梯度等过程除外),并不一定严格为能量消耗型或主动的过程,一般也不依赖于分子马达。而形成鲜明对比的是,细胞内的物质运输和细胞自身的运动等生命体特有的主动过程更像是一种“被严格设定的、可调控的程序化运动”,这几乎是生命物质运动(活动)和非生命物质运动之间一个至关重要的区别,也正是分子马达作为一类非常神秘的生物分子机器的迷人之处,或许能够暗示生命物质内在的一些深层哲理。
动力蛋白(Dynein)(Bhabha, Johnson et al. 2016)是一类极其重要的分子马达,主要负责细胞内微管依赖的负向物质运输,充当着细胞内重要的交通工具,使得生命物质和信息被高效、准确地运输到目的地,保证生命活动的正常运转。动力蛋白在神经系统中丰度颇高,并且和神经发育异常、神经退化、病毒侵染等诸多疾病相关。尽管动力蛋白半个世纪以前就已经被发现(Gibbons 1963),但是和其它一些细胞骨架依赖的分子马达(比如肌球蛋白Myosin或驱动蛋白Kinesin)相比较,其功能机制研究方面一直都充满谜题。主要有两点原因长期阻碍了动力蛋白的机理研究:一个是其高度的复杂性,动力蛋白一般为12个亚基、1.4MDa的大分子复合物,柔性极高,功能态并不具备固定结构,并且受到细胞里面多达几十种功能和结构各异的辅因子(co-factor)、接头蛋白(adaptor)、货物锚定蛋白(anchor)、货物(cargo)、微管结合蛋白以及核苷酸(nucleotide)、磷酸化(phosphorylation)等等调节,复杂程度远远超过其它马达;另一个客观原因是技术瓶颈,诸如动力蛋白这类完全没有固定构象的超大分子复合物,在过去利用传统的X-射线晶体学(X-ray crystallography)只能研究其亚基或片段结构,研究其完整结构几乎没有任何可能性。在过去几年,冷冻电镜技术(cryo-electron microscopy, cryo-EM)蓬勃发展,使得动力蛋白结构研究成为可能。
发现dynein自抑制和激活现象:
此前Andrew Carter研究小组和其他一些dynein实验室都发现,单独的dynein-1处于自抑制状态,只有形成三元复合物dynein/dynactin/adaptor才能保证这个巨大的分子机器沿着微管做持续的长距离负向运输(Splinter, Razafsky et al. 2012, McKenney, Huynh et al. 2014, Schlager, Hoang et al. 2014)。这一点在过去几年关于动力蛋白的研究中被一再证实,然而动力蛋白如何自抑制,它又是如何被其巨大的辅因子dyanctin激活等问题仍然是个巨大谜题。
早在1989年MRC分子生物学实验室的Linda Amos教授就已经发现动力蛋白一种特殊的被称为Phi-particle的状态(Amos 1989)。这在过去二十多年时间里几乎被人们彻底遗忘,直到最近,这种phi-particle状态才被重新发现并重视(Torisawa, Ichikawa et al. 2014)。但是由于完整的动力蛋白三维结构研究难度极大,这使得过去的一些结论主要是基于生化功能验证和低分辨率二维负染结构分析;同时又因为样品表达纯化方面的限制,过去的研究基本都是基于动力蛋白马达结构域(motor domain),这在一定程度上影响了结论的可靠性;而另外一些实验室则对这种‘性质尚不明确’的phi-particle持怀疑和谨慎态度,一度认为极有可能只是体外重组的假象。
突破技术瓶颈
Andrew Carter博士在过去十几年一直从事并且只从事Dynein相关研究,目前其实验室能够十分成熟地表达和纯化多种类型的Dynein,其中最重要的当属完整人源Dynein-1。经过多年努力,研究人员最终得到了适合电镜结构研究的条件下高比例的Dynein phi-particle;同时,在完全一致的条件下从脑组织中纯化得到的天然状态的Dynein和重组表达相互印证,系统验证了phi-particle存在的普遍性。在这些研究的基础上,最终研究人员通过大量筛选电镜制样、优化成像和数据采集条件,得到了上万张高质量的完整人源动力蛋白冷冻电镜照片;同时通过低浓度交联加多次富集纯化,研究人员最终成功获取了含有足够比例的激活态的三元复合物Dynein/Dynactin/BICD(DDB)的电镜照片。
尽管对于稳定而均一的生物样品,MRC分子生物学实验室的研究人员目前已经能够在一天甚至几个小时之内,伴随着数据收集的同时获得其近原子分辨率冷冻电镜结构,但是动力蛋白Dynein复合物的研究则是一个例外。
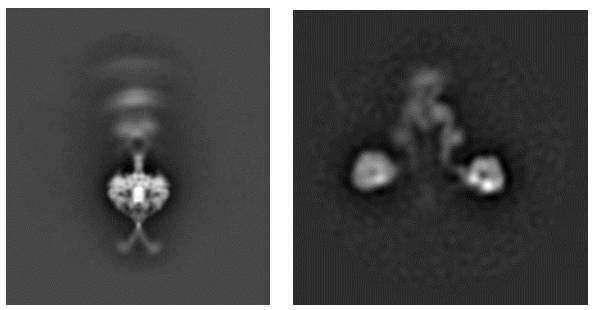
Dynein phi-particle 和典型的开口状态2D分析。(左)未进行多级分类的phi-particle 2D结果;(右)开口状态的dynein典型的2D结果。
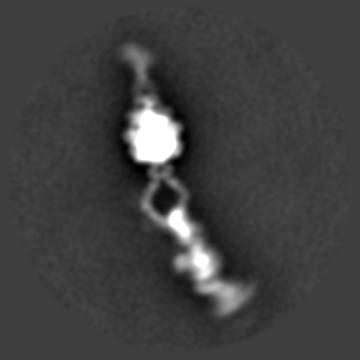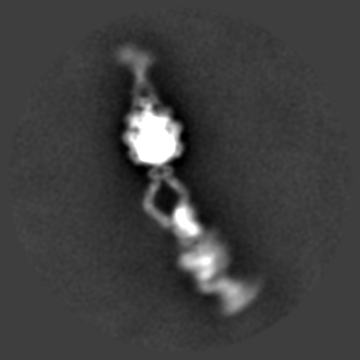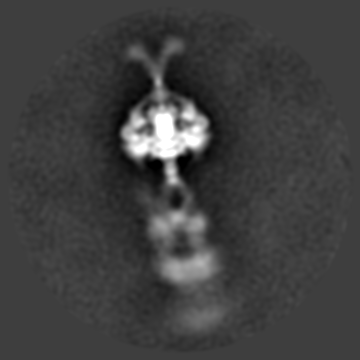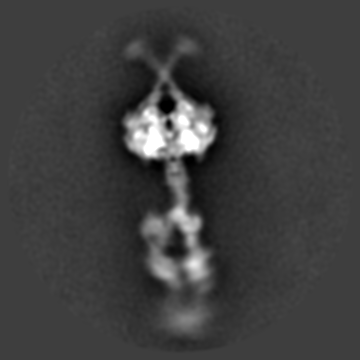
Dynein phi-particle 进行多级分类之后的连续构象变化过程。
Dynein分子巨大、电镜样品成分复杂、呈现极为复杂的多尺度多级构象状态,就连最稳定的phi-particle也几乎没有固定构象(上图);并且在phi-particle状态成细长的棒状,仅有平躺的取向,完全不存在倾斜或正立取向,即使平躺状态也仅有正躺和侧躺两个常见取向(类似于人类的典型卧姿),长轴方向达70nm,浓度稍高就严重重叠,尽管研究人员收集上万张原始照片,但事实上每张照片可用颗粒仅10个左右;加之电镜样品条件极为苛刻,冰层稍不合适就大量解聚或变性,同时交联试剂等的使用则产生大量聚集或扭曲分子,并不能解决问题,必须借助足够厚度的额外碳膜支持稳定,否则电镜样品制备过程中的巨大的水膜表面张力瞬间就可以让脆弱的Dynein彻底变性,而额外碳膜则严重影响成像衬度等等。出于以上种种原因,在过去关于完整Dynein的结构研究甚至连极低分辨率的负染三维结构都难以获取,研究人员只能勉强做一些低分辨率的二维聚类分析;于此同时,一些Dynein领域的竞争者由于长期没有较好的进展,最终选择放弃完整Dynein的结构研究。Andrew Carter实验室最终借助MRC分子生物学实验室得天独厚的冷冻电镜技术优势,针对课题中的每个具体的技术环节各个击破,同时针对复杂样品冷冻电镜结构测定中出现的具体问题自主发展了一系列相关技术方法,最终实现了Dynein相关重要生物学问题和技术的双赢。
研究成果简介
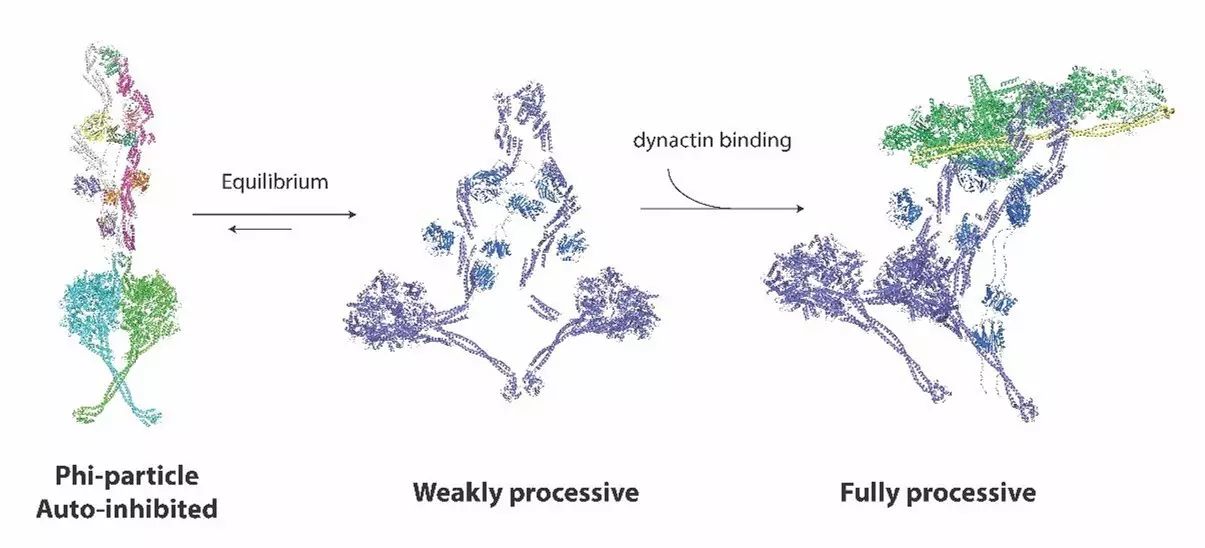
动力蛋白Dynein-1只有结合其辅因子Dynactin和接头蛋白(adaptor)才形成沿着微管做长距离运输的巨大分子机器。但是其自抑制和激活的分子机制一直是个谜题。该项研究中,研究人员获得了足够比例的phi-particle,用充分的生化和细胞证据证明了这种phi-particle作为dynein的自抑制状态存在,并且反复验证了其存在的普适性。经过多年努力,研究人员最终获得了柔性极高的完整Dynein的冷冻电镜结构;其中motor结构域分辨率为3.8埃,从头构建了完整的原子模型;尾部由于没有固定构象,最终总体到8.4埃,但足以成功搭建出绝大部分区域的α-螺旋。
结构分析表明,Dynein这种自抑制的phi-particle状态的两个马达结构域紧紧自锁在一起,迫使其处于低的微管亲状态,并且无法完成ATP结合水解依赖的变构效应,后续的生化功能分析进一步确定了这个结论。研究人员进一步分析了Dynein 自抑制状态motor结构域二聚化的相互作用界面主要由几对带电性的残基介导,非常巧合的是此前其他研究组报道的大量疾病相关突变都分布在这个界面(Strickland, Schabhuttl et al. 2015, Hertecant, Komara et al. 2016);反电性突变导致了Dynein完全丧失了形成phi-particle的能力。这些结果都暗示了phi-particle极有可能是和Dynein生理功能密切相关的功能状态,而非体外重组假象。与此同时,Carter实验室与其德国合作者在体细胞实验表明phi-particle formation的丧失伴随着Dynein在细胞分裂过程中显著的异常分布,大量的Dynein都集中在中心体附近,而非正常情况下的相对均匀的分布;同时细胞分裂过程中形成大量异常的单极纺锤体(Mono-polar spindle),严重影响了细胞分裂的正常进行。这些证据充分表明phi-particle具有重要生理意义。
既然phi-particle代表了Dynein的重要自抑制状态,一个显而易见的想法就是:永久性处于开发状态的突变体是否可以单独激活Dynein?有点出乎研究人员的意料:突变打开自锁的motor结构域依然不能激活Dynein,其沿着微管做负向运输的性质和野生型的Dynein表型上似乎没有区别,而与此同时其它证据表明,突变体除了打开Dynein二聚化界面,并没有对Dynein其它方面的性质造成影响。这使得Dynein的自抑制机理更加扑朔迷离,于是研究人员大胆猜测:除了phi-particle代表的第一层自抑制状态,Dynein极有可能还存在更加神秘的第二层自抑制机制。为了进一步弄清楚深层机理,研究人员一鼓作气,解析了难度更大的激活状态的Dynein/Dynactin/BICD三元复合物中等分辨率8.7埃的冷冻电镜结构,最终彻底阐明了Dynein的自抑制和激活机制。
结构分析表明,独立处于开放状态的Dynein虽然具备更高的微管和Dynactin亲和特性,但是由于这种状态的Dynein结构处于高度松散状态,两个motor结构域构象自由度极大,并且倾向于呈现相反方向,这阻碍了沿着微管做单向平行运输这个过程。而Dynein的两条重链的尾部结合Dynactin核心部分的ARP-1短纤维结构,迫使尾部几乎被整个的翻转以适应平行排列的ARP-1结合凹槽(binding grooves),motor结构域最终顺应了尾部的这种巨大变构作用,更倾向于呈现一种适合沿着平行微管轨道做长距离单向运输的近似平行构象。至此,Dynein的自抑制和激活机制被彻底阐明。
后记:
Andrew Carter博士从博士后阶段到现在一直都从事并且只从事Dynein相关研究,最艰难的时候曾经有7年没有第一或通讯作者文章,但如今在Dynein领域结构相关的研究中,几乎所有关键性突破均出自其手。其中2015年初以Science封面论文形式(Urnavicius, Zhang et al. 2015)发表23个亚基的Dynein激活因子dynactin复合物近原子分辨率冷冻电镜结构,被评审人称为“分子马达领域过去几十年最重要的成果之一,一次性回答了该领域若干悬而未决或有巨大争议的谜题”。本次Cell文章是其研究组继2015年发表Dynactin以来,Dynein领域又一项重要成果。Andrew Carter博士为人低调,在读博士阶段便做出诺奖成果,最早解析了近原子分辨率核糖体晶体结构(为现任英国皇家学会主席Venki Ramakrishnan 09年诺奖的关键成果),但因为目前已经不再从事该领域,对外却一直只字不提这项成就。

Cell论文的第一作者张凯博士
致谢:本文得到了该篇Cell论文第一作者张凯博士的大力支持,张博士对本文的撰写提供了相关素材和图片,并对全文进行了审阅,特此感谢!
专家点评:
陈雷(北京大学分子医学研究所PI,北大清华生命科学联合中心研究员,2016年入选“青年千人计划”)

Comments:结构生物学的魅力在于“眼见为实”,这篇文章向我们再次完美的诠释了这个理念。Dynein 是一类在真核细胞中极其重要的马达蛋白,但其工作机制一直没有得到全面的阐述,而本文通过对多种状态下Dynein 分子及Dynein/dynactin/BICD复合体的电镜分析,从根本上阐明了Dynein是如何自抑制以及如何被其最重要的巨大辅因子dynactin所激活。和众多生物大分子一样,Dynein的柔性非常大,而且具有多种状态和构象。对于这类生物大分子,用传统的晶体学方法来研究非常困难。本文用负染/冷冻电镜的手段,在数据处理中采用多轮二维/三维分类,聚焦分类/修正的方法,将柔性如此之大的分子尾部局部分辨率提高到二级结构清晰可见,马达结构域分辨率甚至达到3.8埃,这充分展示了电镜单颗粒分析手段的强大,为我们研究其它柔性大分子复合物提供了可借鉴的成功案例。同时结合生物化学和分子细胞生物学方面的功能证据,研究人员提出了迄今为止最为精细的动力蛋白自抑制和激活机制。
畅磊福(MRC-LMB博后,入选第十二批国家“青年千人计划”并且拥有欧美多所国际一流高校offer)

Comments:动力蛋白(Dynein)是一类复杂的多亚基蛋白质复合体,可沿微管“行走”进行物质运输,在细胞中的功能至关重要。剑桥MRC分子生物学实验室Andrew Carter组对完整人源细胞质动力蛋白的结构研究取得重大突破,该结果于2017年6月8日在线发表在Cell杂志上。这是该研究组于2015年发表Science封面文章报道动力激活蛋白(Dynactin)结构之后,在动力蛋白结构和机制研究领域的又一项重要成果。
为了解析蛋白质的结构,通常需要先纯化目标蛋白,并使其处于相对稳定的结构状态,然后对大量目标蛋白分子进行分析得到平均结构。例如,用来做X射线衍射的蛋白质晶体通常包含上亿个有序排列的蛋白质分子,冷冻电镜技术(cryo-EM)需要统计分析几万到上百万个相同蛋白质分子的二维投影进而重构出高分辨结构。一般来说越稳定的蛋白质,其结构解析就越容易。因此,结构生物学家通常花费很大的精力制备高纯度和结构稳定的蛋白质样品,用来进行结构测定。
事实上,绝大多数纯化过的蛋白质(尤其是蛋白质复合体)都存在或多或少的不均一性,包括不同的构象状态、局部缺失和局部的结构柔性等。单颗粒冷冻电镜技术的一个重要优势是可以通过三维分类的计算方法,将样品中不同的类别区分开,得到各自结构。该方法目前主要应用于具有几个不同类别的混合体。当样品中的类别非常多并且类别之间的差别非常小时,三维分类的精确度和每一类最终的颗粒数将限制所能达到的分辨率。例如当样品内部存在连续的构象变化时,就不能通过简单的三维分类解决问题。动力蛋白就是这一类样品的典型代表。
动力蛋白由具有ATP酶活性的头部(Motor结构域)和结合货物的尾部构成。尽管该文作者选取了动力蛋白在结构上相对稳定的抑制状态(称为Phi-Particle)作为研究目标,但是电镜图片的二维分类仍然显示尾部相对于头部具有很大的结构柔性,处于连续变化的状态,体现在二维平均图中尾部不能有效叠加使得该区域的密度图很弱,呈弥散状(图A)。为了应对这个问题,作者首先收集了大量的高质量冷冻电镜照片,共得到超过70万原始颗粒图像。但由于其构象非常不均一,按照常规的数据处理方法,将这些颗粒进行若干轮的三维分类,可以得到完整动力蛋白的总体轮廓结构,但是分辨率仅为15埃。
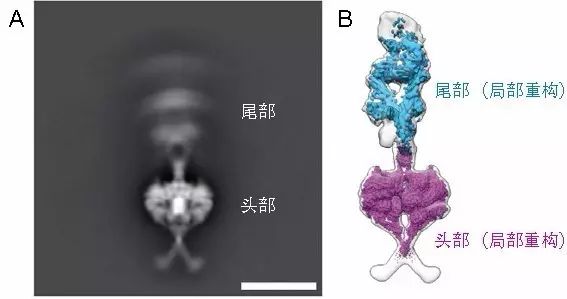
图A:动力蛋白冷冻电镜颗粒的二维平均。改图显示尾部密度图很弱,呈弥散状,反映尾部相对于头部处于连续变化之中。图B:动力蛋白冷冻电镜三维重构密度图。头部的局部重构(粉色,分辨率3.8埃)和尾部的局部重构(蓝色,分辨率8.4埃)拟合到整体重构(半透明灰色,分辨率15埃),得到整体结构。
为了提高分辨率,作者对头部和尾部分别单独处理。通常的处理方法是在三维重构过程中,对每一轮重构的电镜密度图上加上局部的mask作为下一轮重构的reference,而不对原始的颗粒图像做改变。这可以在RELION软件上很容易的实现。对于动力蛋白这个特殊样品,在单独处理头部和尾部时,作者不仅对电镜密度图做了局部的mask,而且对原始颗粒进行了局部的对中,最大可能提高了对中的准确性。
通过这个方法处理,相对致密和稳定的头部可以达到3.8埃的分辨率,能够准确的根据侧链密度图进行建模。相对较小且柔性较大的尾部是整个数据处理最难的地方,作者对用来重构尾部的颗粒进行严格的筛选,最终得到8.4埃分辨率的尾部结构,可以得到可靠的二级结构模型。将单独的头部和尾部的高分辨结构拟合(fit)到15埃分辨率的完整结构中,作者得到了动力蛋白的完整模型(图B)。
该论文的第一作者是Carter实验室的博士后张凯以及博士生Helen Foster,通讯作者是Andrew Carter。张凯博士是冷冻电镜领域杰出的青年代表,本科和博士都为生物背景,但在电镜数据处理的数学原理和计算方法方面颇有造诣。他业余开独立开发的实时CTF(衬度传递函数,contrast transfer function)参数测定和矫正的程序Gctf以及高精度实时自动颗粒挑选程序Gautomatch在冷冻电镜领域被广泛使用。另外,张凯博士建立的“Cryo-EM技术方法讨论微信群”(已满群)是生物电镜领域华人讨论cryo-EM技术方法、原理和最新生物学进展的重要平台。
参考文献:
Amos, L. A. (1989). "Brain dynein crossbridges microtubules into bundles." J Cell Sci 93 ( Pt 1): 19-28.
Bhabha, G., G. T. Johnson, et al. (2016). "How Dynein Moves Along Microtubules." Trends Biochem Sci 41(1): 94-105.
Gibbons, I. R. (1963). "Studies on the Protein Components of Cilia from Tetrahymena Pyriformis." Proc Natl Acad Sci U S A 50: 1002-1010.
Hertecant, J., M. Komara, et al. (2016). "A novel de novo mutation in DYNC1H1 gene underlying malformation of cortical development and cataract." Meta Gene 9: 124-127.
McKenney, R. J., W. Huynh, et al. (2014). "Activation of cytoplasmic dynein motility by dynactin-cargo adapter complexes." Science 345(6194): 337-341.
Schlager, M. A., H. T. Hoang, et al. (2014). "In vitro reconstitution of a highly processive recombinant human dynein complex." EMBO J 33(17): 1855-1868.
Splinter, D., D. S. Razafsky, et al. (2012). "BICD2, dynactin, and LIS1 cooperate in regulating dynein recruitment to cellular structures." Molecular biology of the cell 23(21): 4226-4241.
Strickland, A. V., M. Schabhuttl, et al. (2015). "Mutation screen reveals novel variants and expands the phenotypes associated with DYNC1H1." J Neurol 262(9): 2124-2134.
Torisawa, T., M. Ichikawa, et al. (2014). "Autoinhibition and cooperative activation mechanisms of cytoplasmic dynein." Nature cell biology 16(11): 1118-1124.
Urnavicius, L*., K. Zhang*, et al. (2015). "The structure of the dynactin complex and its interaction with dynein." Science 347(6229): 1441-1446.


BioArt,一心关注生命科学,只为分享更多有种、有趣、有料的信息。关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:fullbellies或邮箱:[email protected]。















