CRISPR/Cas系统是目前发现存在于大多数细菌与所有的古菌中的一种免疫系统,被用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。在CRISPR/Cas系统中,CRISPR是规律间隔性成簇短回文重复序列(clustered regularly interspaced short palindromic repeats)的简称,涉及细菌基因组中的独特DNA区域,也是储存病毒DNA片段从而允许细胞能够识别任何试图再次感染它的病毒的地方,CRISPR经转录产生的RNA序列(被称作crRNA)识别入侵性病毒的遗传物质。Cas是CRISPR相关蛋白(CRISPR-associated proteins, Cas)的简称,Cas蛋白像一把分子剪刀那样切割细菌基因组上的靶DNA。
CRISPR/Cas系统是古菌和细菌的抵抗病毒和质粒侵染的重要免疫防御系统。CRISPR-Cas系统划分为两大类,第一大类CRISPR-Cas系统由多亚基组成的效应复合物发挥功能;第二大类是由单个效应蛋白(如Cas9, Cpf1, C2c1、C2c2 等)来发挥功能。其中,Cas9, Cpf1, C2c1和C2c2(也被称作Cas13a)均具有RNA介导的DNA核酸内切酶活性。目前,Cas9和Cpf1蛋白作为基因组编辑工具被广泛应用,克服了传统基因编辑技术步骤繁琐、耗时长、效率低等缺点,以其较少的成分、便捷的操作以及较高的效率满足了大多数领域的基因编辑需求,并有着潜在且巨大的临床应用价值。
然而,目前得到广泛应用的CRISPR/Cas9系统经常会发生脱靶效应,导致科学家们不想要的结果。而新发现的CRISPR-Cas13a似乎具有更强的特异性,或许有助克服这一点。
为了让读者更好地了解CRISPR-Cas13a系统的研究脉络,谷君在http://www.ncbi.nlm.nih.gov/pubmed网站上以CRISPR和(Cas13a or Cas13 or C2c2)为关键词,除去不相关的检索结果和综述论文类型的检索结果,获得11项相关的检索结果。接下来,谷君对这11项检索结果,进行如下解读。
1.Nature:大牛张锋教授证实CRISPR–Cas13可靶向哺乳动物细胞中的RNA
2017年10月4日, doi:10.1038/nature24049
Cas13a结合和切割单链RNA。图片来自Stephen Dixon。
如今,在一项新的研究中,来自美国麻省理工学院(MIT)的研究人员对CRISPR-Cas13a系统进行调整,使之在哺乳动物细胞中发挥作用。相关研究结果于2017年10月4日在线发表在Nature期刊上,论文标题为“RNA targeting with CRISPR–Cas13”。
在这项新的研究中,来自MIT的张锋(Feng Zhang)教授和他的同事们证实切割RNA的Cas13a酶(之前称作C2c2)能够特异性地降低哺乳动物细胞中的内源性RNA和报告RNA水平。 这些研究人员已从多种细菌物种中寻找一种能够切割大肠杆菌报告基因的Cas13a酶。张峰教授和他的同事们着重关注来自细菌Leptotrichia wadei的Cas13a酶,这是因为经证实它最为高效地切割它的RNA靶标。
他们随后构造出一种双质粒RNA靶向CRISPR系统,该系统在不同的质粒上表达向导RNA(gRNA)和Cas13a基因,其中Cas13a基因含有一种经过改造的核定位序列(nuclear localization sequence)。在人细胞系中,这种CRISPR-Cas13a构造物高效地切割报告质粒(reporter plasmid)中转录的RNA和三种内源性基因转录的RNA。
这种RNA靶向系统能够类似地抑制体外培养的源自水稻(Oryza sativa)的原生质体(移除细胞壁的细胞)中的内源性基因。
鉴于张峰教授和他的同事们最初已在细菌中证实在切割它的靶序列之后,Cas13a作为一种非特异性的RNA切割酶发挥作用,在它的途中切割RNA,如今,他们解决了Cas13a的这种相同的性质是否也存在于哺乳动物细胞中。利用RNA测序,他们证实与在细菌中不同的是,在人细胞系中,Cas13a仅靶向gRNA指定的RNA,而让细胞中测序的所有其他的RNA保持完整。
这些研究人员构建出一种缺失核酸内切酶活性Cas13a版本,它能够结合到序列特异性的单链RNA上,但不会对其进行切割。利用偶联到一种荧光蛋白的Cas13a酶版本,他们能够在细胞中追踪Cas13a结合的RNA从细胞核迁移到细胞质中。
2.Nature子刊:新研究破解RNA靶向CRISPR酶Cas13a的作用机制
2017年9月11日, doi:10.1038/nsmb.3466
来自加州大学伯克利分校的研究人员在最新研究中报道了一个毛螺科菌(Lachnospiraceae bacterium) crRNA结合Cas13a (LbaCas13a)的晶体结构,分辨率为2.0Å,通过解析这一结构,研究人员描述了Cas13a酶如何产生功能性crRNAs,以及在靶标RNA识别之前,其催化活性如何被封闭,这将有助于解析细菌免疫系统,以及临床诊断治疗。这一研究成果公布在9月11日的Nature Structural & Molecular Biology杂志上,文章的通讯作者是基因组编辑技术变革的先驱之一Jennifer A. Doudna教授。
这篇文章报道了一个毛螺科菌(Lachnospiraceae bacterium) crRNA结合Cas13a (LbaCas13a)的晶体结构,分辨率为2.0Å,这是最近发现的Cas13a酶亚型。研究人员通过结构分析,以及生化实验定义了直接负责crRNA突变的Cas13a催化残基,而且这种蛋白上外源靶向RNA特异性序列的发现也解释了Cas13a核酸酶活化的构象门控。
这些研究结果描述了Cas13a酶如何产生功能性crRNAs,以及在靶标RNA识别之前,其催化活性如何被封闭,这将有助于解析细菌免疫系统,以及临床诊断治疗。
3.Cell:中科院生物物理所王艳丽/章新政课题组从结构上揭示Cas13a切割RNA机制
2017年7月27日, doi:10.1016/j.cell.2017.06.050

图片来自Cell期刊。
作为一种VI-A型CRISPR-Cas系统的一种RN引导的RNA核酸酶,Cas13a降解crRNA靶向的入侵性RNA,在RNA技术中具有广泛的潜在应用。
如今,在一项新的研究中,为了理解Cas13a如何被激活和切割靶RNA,中科院生物物理所中国科学院核酸生物学重点实验室创新课题组组长王艳丽(Yanli Wang)课题组和中科院生物物理所生物大分子国家重点实验室创新课 题组组长章新政(Xinzheng Zhang)课题组解析出来自口腔纤毛菌(Leptotrichia buccalis)的Cas13a(以下称LbuCas13a)结合到crRNA和它的靶RNA上时的晶体结构,以及LbuCas13a-crRNA复合物的冷冻电镜结构。他们证实 crRNA-靶RNA双链结合到LbuCas13a中的核酸酶叶(nuclease lobe, NUC)的一种带正电荷的中心通道内,而且一旦结合靶RNA,LbuCas13a和crRNA经历显著的构象变化。这种crRNA-靶RNA双链形成促进LbuCas13a的HEPN1结 构域移向HEPN2结构域,从而激活LbuCas13a的HEPN催化位点,随后LbuCas13a就以一种非特异性的方式切割单链靶RNA和其他的RNA。
这些发现揭示出VI型CRISPR-Cas系统的Cas13a抵抗RNA噬菌体的作用机制,这就为将它作为一种RNA操纵工具加以应用铺平道路,如将它的RNA切割和附带切割活性用于基础研究、诊断和治疗。
4.Bioinformatics:首次开出CRISPR-RT程序,用于设计具有改善的靶标特异性的CRISPR-C2c2 crRNA
2017年9月14日, doi:10.1093/bioinformatics/btx580
CRISPR-Cas系统已被成功地用于基因组编辑。近期,人们报道了CRISPR-C2c2系统是一种RNA编辑工具。
在一项新的研究中,来自美国迈阿密大学的研究人员描述了CRISPR-RT(CRISPR RNA-Targeting),这是首个有助生物学家们设计用于改善CRISPR-C2c2系统靶标特异性的crRNA的网络应用程序。CRISPR-RT允许用户设计一系列参数,这就使得它在当前的和未来的基于CRISPR的RNA编辑研究中具有高度的灵活性。CRISPR-RT涵盖了主要的模式生物,而且可以很容易地经扩增后涵盖其他的物种。CRISPR-RT将有助科学家们开展RNA编辑研究。
5.Mol Cell:发现10种用于疾病诊断的CRISPR酶
2017年5月4日, doi:10.1016/j.molcel.2017.04.008
最近来自加利福尼亚大学的研究人员通过研究描述了10种新型的CRISPR酶,这些酶一旦被激活其行为就像“吃豆人”一样能够“嚼碎”RNA,因此这些酶类或许能作为诊断传染性病毒的敏感检测器。这种新型的酶类是CRISPR蛋白—Cas13a的突变体。
当伯克利和博德研究所的研究人员发现使用的原始的Cas13a酶仅能够在特定核苷酸位点(尿嘧啶)对RNA进行切割时,本文中研究者发现了其中三种新型的Cas13a突变体则能够在腺嘌呤位点切割RNA,这种差异性就能够实现同时检测两种不同的RNA分子,比如来自两种不同病毒的RNA。研究者Alexandra East-Seletsky表示,我们通过深入研究发现了具有不同核苷酸的Cas13a家族的其它同系物,这就能够对携带红色和绿色荧光信号的不同受体分子进行同时检测,从而帮助研究者开发多通道的酶类检测系统。
研究者East-Seletsky表示,把Cas13a与RNA靶点结合看作一种开关,靶向作用该开关就能够开启酶类的表达使其成为细胞中的“吃豆人”来切割附近的RNA分子。
随后研究人员对细菌基因组数据库进行搜寻,发现了10个其它的Cas13a样蛋白,随后研究者对这些蛋白进行了合成,并且评估其切割RNA的能力,其中有7个蛋白类似原始的Cas13a,另外3个则能够对RNA进行切割。基于前期的研究结果,研究人员表示,他们或许能够多元化地使用这些酶类,并且扩展该技术的使用范围,CRISPR-Cas13a家族或许还有其它多种用途,比如进行RNA检测等。最后研究者Doudna说道,我们未来的研究目的就是开发用于多个医疗点诊断的强大Cas13a酶类家族。
6.Science:基于CRISPR/Cas13a的诊断平台可检测任何RNA分子,灵敏度增加一百万倍
2017年4月13日, doi:10.1126/science.aam9321
在一项新的研究中,来自美国哈佛大学-麻省理工学院布罗德研究所(以下简称布罗德研究所)、麻省理工学院麦戈文脑研究所、麻省理工学院医学工程与科学研究所、哈佛大学怀斯生物启发工程研究所(Wyss Institute for Biologically Inspired Engineering)的研究人员将一种靶向RNA(而不是DNA)的CRISPR相关酶(即Cas13a)改造为一种快速的、廉价的和高度灵敏的诊断工具,从而有潜力引发研究和全球公共卫生变革。相关研究结果于2017年4月13日在线发表在Science期刊上,论文标题为“Nucleic acid detection with CRISPR-Cas13a/C2c2”。
在这项研究中,布罗德研究所成员Feng Zhang、Jim Collins、Deb Hung、Aviv Regev和Pardis Sabeti描述了这种靶向RNA的CRISPR相关酶如何被用作一种高度灵敏的检测器---能够指示最少至一个靶RNA或DNA分子的存在。论文第一作者Omar Abudayyeh和Jonathan Gootenberg将这种新的工具称为“SHERLOCK(Specific High-sensitivity Enzymatic Reporter unLOCKing)”;这种技术可能有朝一日被用来应对病毒性和细菌性流行病爆发、监控抗生素耐药性和检测癌症。
在2016年6月,Zhang和他的同事们首次描述了这种靶向RNA的CRISPR相关酶(之前被称作C2c2,如今被称作Cas13a),而且能够经编程后切割细菌细胞中的特定RNA序列(Science, Published online:02 Jun 2016, doi:10.1126/science.aaf5573)。不同于靶向DNA的CRISPR相关酶(如Cas9和Cpf1),Cas13a能够在切割它的靶RNA之后保持活性,而且可能表现出不加区别的切割活性,而且在一系列被称作“附带切割(collateral cleavage)”的作用当中,继续切割其他的非靶RNA。在其发表的论文和申请的专利中,该团队描述了这个CRISPR系统的广泛生物技术应用,包括将它的RNA切割和附带切割活性用于基础研究、诊断和治疗。
在这项新的研究中,这种SHERLOCK方法的灵敏度增加了一百万倍。这种增加是由于Zhang团队和布罗德研究所成员Jim Collins合作开展研究取得的结果。Collins之前一直在研究寨卡病毒的诊断方法(Cell, 19 May 2016, doi:10.1016/j.cell.2016.04.059)。在2014年,Collins和他在怀斯生物启发工程研究所的团队开发出一种快速的基于合成纸的埃博拉病毒测试方法,该方法所使用的试剂能够在室温下运输和储存。他们随后对这种测试系统进行修改来检测寨卡病毒,并且证实他们能够通过加入低水平热量来提高RNA在样品中的浓度来提高这种系统的检测灵敏度。 通过一起合作,Zhang团队和Collins团队能够采用一种不同的依赖体温的扩增过程来提高他们的测试样品中的DNA或RNA水平。一旦这种水平增加,他们利用第二个扩增步骤将DNA转化为RNA,从而使得他们将这种靶向RNA 的CRISPR工具的灵敏度增加了一百万倍,而且这种工具能够在几乎任何环境下使用。
另外,这种CRISPR工具还包括一种RNA报告分子。当该报告分子被切割时,它会发出荧光。当Cas13a检测到靶RNA序列时,它的无区分的RNA酶活性(即附带切割活性)也会切割这种RNA报告分子,从而释放可检测到的荧光信号。
7.Mol Cell:张锋发现靶向RNA“新魔剪”,CRISPR家族再次壮大!
2017年2月16日, doi:10.1016/j.molcel.2016.12.023
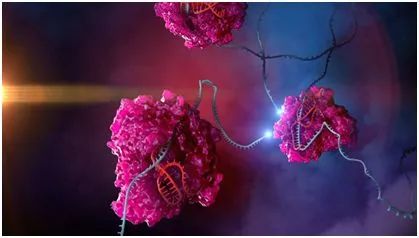
近日,发表在Molecular Cell杂志上题为“Cas13b Is a Type VI-B CRISPR-Associated RNA-Guided RNase Differentially Regulated by Accessory Proteins Csx27 and Csx28”的研究中,张锋带领的研究小组发现了两个新型的RNA靶向CRISPR系统。这类新系统利用了一种新的Cas酶——Cas13b。
研究发现,Cas13b具有靶向和编辑RNA的能力。仅靶向RNA的这一能力使得研究人员能够以高通量地方式特异性地操纵RNA,从而用于研究广泛的生物过程。
这一新发现的酶与张锋研究组去年6月在Science杂志上(论文:C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector)提出的Cas13a(先前被称为C2c2,一种RNA靶向酶)有一些共同的特性。
像Cas13a一样,Cas13b仅需要单个向导RNA就能找到靶标,并且从遗传学的角度是可编码的。此外,Cas13b能够同时靶向多个RNA转录本。但Cas13b也有一些独特的特点,表明它与Cas13a是不同的。这些特性使得Cas13b更适用于微调基因功能。
8.Cell:王艳丽课题组解析Ⅵ型CRISPR-Cas系统C2c2-RNA复合物结构
2017年1月12日, doi:10.1016/j.cell.2016.12.031
2017年1月12日,Cell 杂志发表了中科院生物物理研究所王艳丽课题组关于Ⅵ型CRISPR-Cas系统的效应蛋白C2c2的结构研究。标题为“Two Distant Catalytic Sites Are Responsible for C2c2 RNase Activities”。该研究解析了Leptotrichia shahii(Lsh)细菌中C2c2与crRNA (CRISPR-RNA) 的二元复合物以及C2c2在自由状态下的晶体结构,揭示了LshC2c2通过两个独立的活性结构域来发挥其两种不同的RNA酶切活性,这为研究C2c2发挥RNA酶活性的分子机制提供了重要的结构生物学基础。
2015年,一种全新的第二类CRISPR-Cas系统-Ⅵ型系统被发现,该系统中的效应蛋白被命名为C2c2。而后的研究进一步发现,Ⅵ型CRISPR-Cas系统是一种新型靶向RNA的CRISPR系统,而C2c2是一种以RNA为导向靶向和降解RNA的核酸内切酶,有望被开发作为RNA研究的工具,扩展CRISPR系统在基因编辑方面的运用。
王艳丽课题组通过深入的研究,解析了C2c2与crRNA的二元复合物的晶体结构以及C2c2蛋白的晶体结构,揭示了C2c2包含一个crRNA识别的叶片即REC叶片,和一个核酸酶叶片即NUC叶片。REC叶片包含NTD结构域(N-terminal domain)和Helical-1结构域,NUC叶片包含了两个HEPN结构域、Helical-2结构域以及连接两个HEPN结构域的连接结构域。负责切割前体crRNA和靶标 RNA的活性口袋分别位于Helical-1和HEPN结构域上。crRNA的结合会引起C2c2蛋白的构象变化,这种变化很可能会稳定crRNA的结合,进而对识别靶标RNA起着重要作用。该研究通过结构和生化研究揭示了C2c2剪切pre-crRNA以及切割靶标 RNA的分子机制,对认识细菌抵抗RNA病毒入侵的分子基础具有十分重要的意义。同时也为改造CRISPR-C2c2系统,为其在基因编辑领域的运用提供了强有力的结构基础,有助于加速对病毒感染引发的疾病的理解、治疗和预防。
9.Nature:CRISPR工具箱被特殊RNA切割蛋白扩充
2016年10月13日, doi:10.1038/nature19802
日前,一项刊登于国际杂志Nature上的研究报告中,来自加州大学伯克利分校(UC Berkeley)的研究人员通过研究扩大了新发现的CRISPR蛋白C2c2的作用,蛋白C2c2能够靶向作用RNA而不是DNA。
研究者指出,C2c2能够作为一种RNA引导的RNA切割酶,然而当前科学家们并不清楚该蛋白如何对RNA实施切割作用,在这项标题为“Two distinct RNase activities of CRISPR-C2c2 enable guide-RNA processing and RNA detection”的研究报告中,研究者们就通过研究发现,C2c2并不像我们之前认为的仅有一种RNA切割活性,实际上C2c2有两种不同的RNA切割活性,这两种活性能够互相协作来进行强大的RNA检测和降解功能。
研究者Doudna教授说道,这项研究扩大了我们对C2c2引导RNA过程的理解,同时也为我们提供了一种新型的RNase应用,C2c2就像一个全副武装的哨兵一样,其能够根据所检测的靶点来攻击所有的RNAs,而这种活性就能够被调节,作为一种自动的放大检测器来用于低廉的诊断检测中。
C2c2所具有的两种不同的RNA切割活性中每一种都有其自己的功能,第一种就是产生导向RNAs来促进C2c2寻找特殊的靶向RNA分子,第二种就是会激活一种互补的RNA靶点,从而作为一种常规的RNA切割器来破坏所有存在的RNAs。
10.Science:基因编辑大牛张锋再发力,揭示只靶向RNA的新型CRISPR系统
2016年6月2日, doi:10.1126/science.aaf5573
在一项新的研究中,来自美国国家卫生研究院(NIH)、哈佛大学-麻省理工学院布罗德研究所(简称布罗德研究所)、麻省理工学院、罗格斯大学新伯朗士威校区和俄罗斯斯科尔科沃理工学院等机构的研究人员描述了一种靶向作用于RNA而不是DNA的新型CRISPR系统。相关研究结果于2016年6月2日在线发表在Science期刊上,论文标题为“C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector”。
在这项研究中,来自布罗德研究所的张锋(Feng Zhang)及其同事们与来自NIH的Eugene Koonin及其同事们、来自罗格斯大学新伯朗士威校区的Konstantin Severinov等组成一个合作小组,鉴定出一种RNA引导的能够靶向结合和降解RNA的酶C2c2,并对C2c2进行功能性描述。
这些发现揭示出C2c2---鉴定出的首个自然发生的只靶向作用于RNA的CRISPR系统,是由这个合作小组于2015年10月发现的---有助保护细菌免受病毒感染。他们证实C2c2经基因编程后能够切割细菌细胞中的特定RNA序列,这可能往分子生物学工具箱中增加了一个重要的工具。
C2c2只针对RNA发生作用可作为靶向作用于DNA的CRISPR-Cas9系统的重要补充。这种只靶向作用于RNA---协助执行基因组指令---的能力能够让人们特异性地和高通量地操纵RNA,以及更加广泛地操纵基因功能。这有潜力加快理解、治疗和预防疾病的步伐。
11.Mol Cell:发现第二类CRISPR-Cas基因组编辑系统
2015年11月5日, doi:10.1016/j.molcel.2015.10.008
在一项血脑的研究中,研究人员发现了三个天然存在的具有基因组编辑潜力的新型CRISPR-Cas系统。相关研究结果发表在2015年11月5日的Molecular Cell期刊上,论文标题为“Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems”。
这三个新发现的系统与Cas9和Cpf1具有一些相同的特征,但是它们自己也具有一些独特的性质。这一发现突出表明第二类CRISPR-Cas系统具有多样性。
这些研究人员采用一种新的生物信息学方法发现了这些暂时被命名为C2c1、C2c2和C2c3的新蛋白,同时他们也开发出多种计算方法来寻找新的CRISPR-Cas系统。