广泛引起业界关注的北京四环制造有限公司(下称四环制造)与齐鲁制药有限公司(下称齐鲁公司)关于马来酸桂哌齐特注射液系列专利侵权和无效案中,四环制造在第一阶段以绝对的优势取得了胜利。由于该系列案均涉及关键的桂哌齐特氮氧化物这一杂质成分,笔者本文即以近期新出的无效决定为视角,以期能帮助业界更详细的了解该案及其背景。
作者|刘元霞
创始合伙人
北京知元同创知识产权代理事务所
一、案件背景
桂哌齐特化合物最早出现在法国狄朗药厂(Delalande S.A., France)在1969年4月1日提交的专利申请US3634411中,该专利于1972年1月11日授权。1974年,法国狄朗药厂在法国将该药推向市场,临床上主要用于心脑血管疾病的治疗。此后,该药在西班牙、意大利、日本和韩国上市。但自1986年开始,马来酸桂哌齐特因安全性和有效性问题分别从法国和意大利撤市。
法国狄朗药厂的马来酸桂哌齐特注射液(商品名Vasodista)于1992年获准进口中国,但后来未见进口品的销售或报道。
1999年,日本药审机构提出,需要对包括马来酸桂哌齐特在内的四种药物重新进行临床试验来证明其疗效。第一制药没有启动重新临床研究,故该药自2000年起在日本也等同于退市。
四环制造是国内首家仿制该药品的企业,于2002年4月获准生产销售马来酸桂哌齐特药品(包括原料药和注射液)。作为首仿产品,四环制造生产的药品被药品监管部门给予新药保护,保护期至2008年4月结束。在新药保护期内,药品监管部门不再批准其他制药企业仿制该药品。
2008年4月,四环制造享有的新药保护期届满后,陆续申请了多项与该药品相关的专利,包括:
(1)2008年4月24日提出的专利号为ZL200810093966.9(“966”)、发明名称为“马来酸桂哌齐特晶型及其制备方法”的发明专利;
(2)2009年9月29日提出的专利号为ZL200910176994.1(“994”)、发明名称为“桂哌齐特氮氧化物、其制备方法和用途”的发明专利;
(3)2009年11月13日提出的专利号为ZL201110006357.7(“357”)、发明名称为“一种安全性高的桂哌齐特药用组合物及其制备方法和其应用”的发明专利。后两项专利均要求享有2009年8月17日的相同优先权。其中,357专利还在审查提出了专利号为ZL200910180174X(“174”)的分案申请并获授权。
另一方面,四环制造利用其在国内独家生产销售该药品的地位,先后多次修订该药品的国家标准。具体如表一所示:
表一 四环制造桂哌齐特原料药和注射液的标准对照表
标准编号 | 原料药/注射液 | 施行时间 | 氮氧化物 | 顺式异构体 | 其他杂质 |
WS-069(X-060)-2002 | 原料药 | 2002.4.9起执行, 试行期2年 |
| 不得大于对照溶液主峰面积(1.0%) | 不得大于对照溶液主峰面积(1.0%) |
WS-070(X-061)-2002 | 注射液 | 2002.4.9起执行, 试行期2年 |
| 不得大于对照溶液主峰面积(1.0%) | 不得大于对照溶液主峰面积(1.0%)
|
WS1-(X-328)-2004Z | 注射液 | 2004.7.13颁布, 2004.10.13施行 |
| 不得大于对照溶液主峰面积(1.0%) | 不得大于对照溶液主峰面积(1.0%) |
WS1-(X-018)-2010Z | 原料药 | 2010.5.21颁布, 2010.8.21施行 | 外标法,不得过0.15% | 不得大于对照溶液主峰面积0.5倍(0.5%) | 不得大于对照溶液主峰面积(1.0%) |
WS1-(X-328)-2004Z-2011 | 注射液 | 2011.9.27颁布, 2011.12.27施行 | 外标法,不得过0.15% | 不得大于对照溶液主峰面积0.5倍(0.5%) | 单个峰不得大于对照溶液主峰面积的0.2倍(0.2%),总和不得大于主峰面积(1.0%) |
WS1-(X-018)-2010Z-2012 | 原料药 | 2012.6.12颁布, 2012.12.12施行 | 外标法,不得过0.05%
| 不得大于对照溶液主峰面积0.3倍(0.3%) | 不得大于对照溶液主峰面积0.5倍(0.5%) |
WS1-(X-018)-2010Z-2013 | 原料药 | 2013.12.19颁布, 2014.6.19施行 | 外标法,不得过0.05% | 不得大于对照溶液主峰面积1.5倍(0.3%) | 单个峰不得大于对照溶液主峰面积(0.2%),总和不得过0.5% |
WS1-(X-328)-2004Z-2013 | 注射液 | 2013.12.19颁布,2014.6.19施行 | 外标法,不得过0.15% | 不得大于对照溶液主峰面积2.5倍(0.5%) | 单个峰不得大于对照溶液主峰面积(0.2%),总和不得过1.0% |
通过对照,四环制造的标准主要是对其中的杂质(包括氮氧化物、顺式异构体和其他杂质)的检测限度进行了变更。
根据我国的药品注册管理制度,在药品监管部门已经对四环制造生产的马来酸桂哌齐特颁布国家标准的情况下,其他制药企业仿制该药品,其药品标准不得低于四环制造颁布的该药品标准的最新版本。
由于药品标准的不断提高,从该药2002年上市,到2015年3月以前,马来酸桂哌齐特仍是国内的独家产品,且为四环制造的核心品种。据报道,其年收入的80%来源自该品种。
2015年3月27日,福建金山生物制药股份有限公司(下称福建金山)成为首家获批该药品的企业。随后,又有六家企业先后获批。而这六家企业均从2010年开始申报,且申报过程中均收到过补充通知。具体申报情况见表二:
表二 马来酸桂哌齐特原料药和注射液的申报情况
申报企业 | 规格 | 批准文号 | 上市时间 |
四环制造 | 2ML:80mg 10ML:0.32g | 国药准字H20020125 国药准字H20020124
| 2002/04/09 |
福建金山 | 2ML:80mg | 国药准字H20153059 | 2015/03/27 |
齐鲁公司 | 2ML:80mg 10ML:0.32g | 国药准字H20153127 国药准字H20153128 | 2015/06/10 |
湖南一格 | 2ML:80mg 10ML:0.32g | 国药准字H20163200 国药准字H20163199 | 2016/07/07 |
辽宁海思科 | 2ML:80mg | 国药准字H20163210 | 2016/07/12 |
辽宁天龙 | 原料药 | 国药准字H20173011 | 2017/01/11 |
福州海王 | 2ML:80mg 10ML:0.32g | 国药准字H20173235
国药准字H20173236 | 2017/06/16 |
其中,2010年5月18日和2010年6月23日,齐鲁公司分别向山东省药品监管部门提交马来酸桂哌齐特原料药及马来酸桂哌齐特注射液的注册申报资料,当时申报的药品标准并不涉及桂哌齐特氮氧化物,但齐鲁公司与2012年8月1日收到CFDA关于桂哌齐特原料药和注射液的补充通知(批件号分别为CYHS1000462和CYHS1000621/620),要求对原料药和注射液中的氮氧化物杂质进行补充研究。最终,齐鲁公司于2015年获批生产该药品时,根据药品注册管理的强制要求,统一执行四环制造修订后形成的新版马来酸桂哌齐特药品标准。
在此期间,国家药物审评中心于2012年7月18日发布《马来酸桂哌齐特及注射液仿制申请的评价原则》中说明:“马来酸桂哌齐特存在潜在的安全性风险(粒细胞缺乏和白细胞减少),分析其原因可能有以下两种:1.马来酸桂哌齐特本身可能会导致以上安全性问题……2.马来酸桂哌齐特本身不会导致安全性问题,而是其中所含的杂质可能会导致安全性问题。……马来酸桂哌齐特存在潜在的安全性风险,但目前产生该风险的原因是制剂本身还是其中的杂质,尚不明晰,而且该产品原批准的适应症过于宽泛,如果在审的马来酸桂哌齐特注射液都按照普通的仿制药注射液免临床、批准上市,则可能会放大该产品的风险。故,要求马来酸桂哌齐特注射液的仿制药申请在药学研究充分的前提下进行临床研究”。
由于当时只有四环制造一家上市产品,药审中心的发文使得其他仿制药企业的药品上市进程因此延缓。
两年半后,在四环制造并未提供临床研究结果,也未见其他六家仿制药企业的临床研究结果的前提下,上述六家企业的该品种分别免临床先后获批上市。但获批1年之后,国家食品药品监督管理总局又在2016年6月27日分别发函给北京市、福建省、山东省食品药品监督管理局,要求四环制造、福建金山和齐鲁公司于2018年6月30日前完成本品上市后的临床研究工作,并提出补充申请上报总局。逾期未完成临床研究的,一律停止本品生产销售。
二、相关诉讼和无效案
2015年11月5日,四环制造向呼和浩特市中级人民法院提起侵权诉讼,主张齐鲁公司侵犯四环制造拥有的994、966和357三项发明专利。齐鲁公司在答辩期限内提起管辖权异议,并于2015年12月14日,针对上述三项专利提起无效宣告请求。后撤销2015年12月14日针对994专利提起的无效请求,并于2016年9月22日重新针对994专利提起无效宣告请求。
国家知识产权局专利复审委员会于2016年8月24日作出第29876号决定,维持357专利权有效;于2016年8月31日作出第29935号决定,宣告966专利全部无效;于2017年6月12日作出第32428号决定,维持994专利权全部有效。
目前,994和357两专利均为有效,且相应的侵权诉讼也在一审中获得胜诉。
(一)专利基本情况
994专利权利要求1保护如下技术方案:
一种桂哌齐特氮氧化物,具有式(I)所示结构。
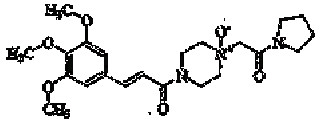
994专利背景技术部分提及“桂哌齐特也是临床上广泛使用的心脑血管扩张药物,并且疗效明确,主要用于……雷诺氏病等。但是,桂哌齐特不稳定,在光照下很容易发生氧化,至今为止,未见有关桂哌齐特氧化产物的分离、结构确认及其用途研究的相关报道(说明书第0004段)。
994专利发明内容部分提及“本发明的目的在于提供一种桂哌齐特氮氧化物,具有式(I)所示结构……本发明的另一目的在于提供一种制备桂哌齐特氮氧化物的方法,其特征在于:将桂哌齐特碱与过氧化物进行氧化反应得到。”(说明书第0005-0007段)。“发明人通过研究,得到惊人的发现,本发明的桂哌齐特氮氧化物具有较好的杀虫活性。”(说明书第0019段)
357专利权利要求1保护如下技术方案:
一种安全性高的药物组合物,所述药物组合物含有桂哌齐特或其药学上可接受的盐和含量不高于0.5%的式III所示结构化合物,
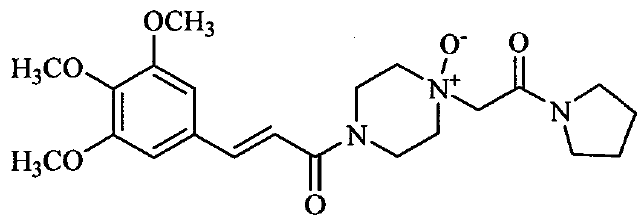
式III,所述桂哌齐特或其药学上可接受的盐与式III化合物之间的重量比不低于500∶1。
357专利说明书提及“本发明进一步分离、纯化和表征了研究桂哌齐特相关物质的结构及其活性,得到惊人的发现,药理实验证实,桂哌齐特纯品不会引起动物的白细胞降低,引起白细胞降低或者影响粒细胞分化和形成的物质为式III所示结构的桂哌齐特氮氧化物”(说明书第0011段)。“本发明通过深入研究,惊人发现,桂哌齐特氮氧化物在其含量不高于0.5%时,对动物白细胞数或粒细胞的形成和分化存在影响,但不显著;在其含量不高于0.2%时,则对动物白细胞数或粒细胞的形成和分化没有影响”(说明书第0059段)。
四环制造在357案无效程序中主张:“本专利的核心是发现、确认、分离、表征桂哌齐特氮氧化物这种杂质,并对其定性定量分析,从而控制其含量,降低临床不良反应发生率,提高用药安全”。
基于上述两份专利及无效程序中的相关论述可以确定,专利权人从未否认现有技术客观存在该氮氧化物。其发明的核心是发现、分离和确认该杂质。
(二)994决定分析
在本专利申请之前,医药化学领域的专利申请中,对于不论何种原因出现的杂质,尤其是有机杂质,通常采用如下两种方式予以保护,一种是采用纯度或杂质含量限定,例如一种高纯度桂哌齐特化合物,其中氮氧化物的含量不超过0.2%;另一种采用组合物方式予以保护,如357专利所述,保护一种药物组合物,其中含有桂哌齐特和不高于0.5%的氮氧化物。根据检索可知,在本专利申请日之前,还未发现有申请直接保护杂质化合物的情形。
994专利保护一具体化合物(下文称为“氮氧化物”),该氮氧化物在994专利的背景技术部分认为是桂哌齐特药物的杂质,同时还说明,意外地发现了该氮氧化物具有杀虫活性。即994专利保护的这一具体化合物,既是杂质,又是杀虫化合物。
为何同时保护这两方面?为何不单独保护杂质?或者单独保护杀虫活性?
994决定认为,“本专利的发明是在桂哌齐特的药品生产中发现其氧化产物的基础上,通过进一步研究发现该氧化产物具有杀虫剂用途而完成的。”(第32428决定第12页)。由此确定,四环制造和复审委认为,因为氮氧化物杂质未被认知,该氮氧化物满足新颖性的规定。
但要具有创造性,根据审查实践,似乎还需要满足,“发明通过发现该杂质并在药物可接受的杂质含量范围之内降低该杂质含量,解决了现有技术未教导的技术问题”,即还需要控制杂质在可接受的范围。
994专利的整个申请文件中,除了在背景技术部分简单提及了氮氧化物是桂哌齐特的杂质以外,在说明书正文以及整个申请文件均再未提及氮氧化物与桂哌齐特药物之间的任何关联,也未涉及该氮氧化物为杂质的任何信息。
但事实上,与本专利享有同样优先权文件的357专利中,大量而详尽地进行了控制该杂质含量的原因及实验结果,且最终因此而获得授权并被维持有效。如果将357专利的内容引入到本专利中,即直接可以实现对杂质的保护,为何还需要强调杀虫活性?
是因为发现该杂质本身属于科学发现,不属于专利保护的客体,故因而单独保护杂质不能被授权,且将杂质作为发明内容同样不能规避该杂质属于科学发现的事实,因此刻意在专利申请文件中仅在背景技术部分提及杂质,而整个申请文件均只杀虫活性?
四环制造称其开发了结构为桂哌齐特氮氧化物的杀虫剂。笔者理解,如果是一种新结构的杀虫化合物,专利申请文件的通常撰写方式应该是:在背景技术部分描写杀虫剂领域的化合物结构及其活性;存在哪些需要解决或完善的问题;在发明内容部分写明新结构的杀虫化合物,以及要解决的技术问题;相对现有技术的有益效果是什么。但本专利并非如此方式。
就杀虫活性的现有技术,笔者对氮氧化物及其类似结构进行了全面深入的检索,至少在无效程序中并未发现与氮氧化物结构接近的化合物,且具有杀虫活性。事实上,无效决定提交了近30份证据,也无任何一篇有杀虫剂领域的文献。可以确定该杀虫活性也是现有技术没有披露的,连最接近的现有技术都没有。因此,笔者认为,本专利完全可以基于杀虫活性使得氮氧化物获得授权,为何还要强调杂质?
综上,笔者认为,四环制造应该是利用杀虫活性赋予杂质化合物具有创造性,并通过该预料不到的技术效果实现对马来酸桂哌齐特注射液中客观存在的杂质进行保护,以此延长其药品市场垄断地位的目的。
(三)多说一点:杂质化合物能否被授予专利权
根据国家食品药品监督管理局《化学药物原料药制备和结构确证研究技术的指导原则》第10页可知“杂质:是在原料药的制备过程中,由原料、试剂、溶剂或副反应引入的与终产品结构不同的任何成分。”
根据国家食品药品监督管理局《化学药物杂质研究的技术指导原则》第1页的规定可知,药物领域中,将任何影响药物纯度的物质统称为杂质。药品中的杂质按其理化性质一般分为三类:有机杂质、无机杂质及残留溶剂。按照其来源,杂质可以分为工艺杂质(包括合成中未反应完全的反应物及试剂、中间体、副产物等)、降解产物、从反应物及试剂中混入的杂质等。按照毒性分类,杂质又可分为毒性杂质和普通杂质等。其中:
“有机杂质包括工艺中引入的杂质和降解产物等,可能是已知的或未知的、挥发性的或不挥发性的。由于这类杂质的化学结构一般与活性成分类似或具渊源关系,故通常又可称之为有关物质”。
“无机杂质是指在原料药及制剂生产或传递过程中产生的杂质,这些杂质通常是已知的,主要包括:反应试剂、配位体、催化剂、重金属、其它残留的金属、无机盐、助滤剂、活性炭等。”
而残留溶剂是指在原料药及制剂生产过程中使用的有机溶剂。
根据上述杂质的理化性质分类,对于无机杂质和残留溶剂通常不会产生争议,因为他们是已知的(包括结构等也是已知的)。因此,下文主要讨论有机杂质(下文称为“杂质”)。
关于杂质的发现是否属于科学发现,观点不一。有观点认为,杂质属于自然界中存在的天然物质,首次分离提取并确认其结构,属于可以授权的客体;另有观点认为,杂质不属于天然物质,但该杂质在现有技术中从未被认知,而发现它并确定它的具体用途,使其具有专利性。
根据专利法和专利审查指南相关规定可知,发现了自然界中客观存在的物质,甚至是发现了自然界中客观存在的天然物质,这些发现都仅仅是一种发现,仅是揭示了一种过去未知的物质的客观存在,不能被授予专利权。
不过,专利审查指南对于科学发现有例外,且一共涉及三个方面,一是天然物质(即天然化学物质),一是微生物,另一是基因或DNA片段。事实上,由审查指南对于微生物、基因或DNA片段的表述“天然形态存在的基因或DNA片段”可知,这三类物质都可以被称之为天然物质,故下文的天然物质包括这三类。
基于专利审查指南的规定,如果是首次从自然界分离或提取出来的天然物质,被确切地表征并在产业上有利用价值,则该物质本身可以被授权。
上述天然物质的例外是否可以推而广之到前述的“客观存在的物质”?事实上,由于天然物质存在科学发现的例外,确实导致业界对于科学发现的例外理解多有不同。
但天然物质和客观存在的物质是两个不同的概念,并不是一回事。
首先,“客观存在”,是相对于主观存在而言的,其不仅包括具体的物质,还包括具体的精神和意识。而客观存在的物质是具有不依赖于人的意识而实实在在地存在着的特性。
而“天然物质”,在专利法及相关规定中并无直接定义,根据《专利审查指南》第十章中“天然物质”标题下提及的概念可以理解为,天然物质是指在自然界中以天然形态存在的物质。
由此可知,客观存在的物质包括天然物质和人工合成物质,而非只包括天然物质,所以天然物质的例外并不能直接套用到客观存在的物质的例外上。否则将会导致诸多科学发现被当作发明而授予专利权。
因此,发现自然界客观存在的人工合成物质,其揭示过程仅仅是一个发现,这些人工合成物质不属于可授予专利权的保护客体,不能被授予专利权。
由前述杂质的定义可知,药品中的杂质并非自然界中以自然形态存在的物质,因而不可能属于天然物质,不能适用天然物质的科学发现的例外。因而,不论该杂质是首次分离提取被认知的,还是通过其他方式被认知的,鉴于科学发现本来就是揭示自然界原本就存在而人类尚未认识的事物,发现该杂质仅仅是个科学发现,不能被授予专利权。
《专利审查指南》第二部分第十章第5.1节规定,“天然物质的存在本身并不能破坏该发明物质的新颖性,只有对比文件中公开的与发明物质的结构和形态一致或者直接等同的天然物质,才能破坏该发明物质的新颖性。”
根据上述规定可知,《专利审查指南》只规定天然物质的存在本身不能破坏发明物质的新颖性,而这样设置的目的也是与“可授予专利权的发明”的规定一致的。否则,如果现有技术中已经存在的该天然物质本身可以破坏发明保护物质的新颖性,则会使得天然物质不授予专利权的例外形同虚设。
其次,客观存在的人工合成物质本身并无新颖性判断的例外,因而根据新颖性的判断标准,只要符合现有技术的规定,客观存在的人工合成物质(如杂质)本身当然可以破坏发明物质的新颖性。这或许是整个专利文件均不提及杂质的根本原因。
三、结语
笔者以为,为了避免杂质的保护客体存在争议,选择如本专利这样的一种撰写形式,利用不相干的技术领域的应用赋予杂质以专利性。复审委又基于技术领域的差异而维持其专利性。从该角度而言,该专利的撰写以及无效决定的维持,将客观存在的杂质纳入其保护范围,似乎对于仿制药企业有益。但长远来看,随着国内的医药企业创新能力不断增强,在该制度的设立下,需要披露其付出巨大的研发成本而知晓的杂质,将可能会损害国内创新企业的合法权益,甚至阻碍技术的创新。
文本已获作者授权,未经允许,请勿转载。
会讯
电子通用技术文档(eCTD)申报 8月4-5日 南京















