ESMO大会第三天,西班牙马德里当地时间2017年9月11日,来自意大利的Angelo Di Leo教授对重磅研究Monarch 3研究做了详尽的介绍。同时会上,Nicholas Turner教授对MONARCH3进行了深入的点评,并展望CDK4/6抑制剂在ER+乳腺癌中的未来。
Monarch 3: Abemaciclib用于HR+, HER2-晚期乳腺癌患者的一线治疗的研究
雌激素在激素受体阳性的乳腺癌中诱导激活细胞周期蛋白cyclin D1,从而促进CDK4&6的激活并促进细胞周期从G1期进入S期。Abemaciclib对cyclin D1/CDK4的酶活性抑制作用较cyclin D3/CDK6强14倍。持续的抑制作用可使细胞停滞在细胞周期G1中,最终导致细胞衰老或凋亡,而短期的抑制可导致可逆的细胞周期停滞同时伴有细胞反弹效应。已经有研究证明,Abemaciclib在既往接受过内分泌治疗和化疗的乳腺癌患者中显示出了很好的单药活性。MONARCH2研究为既往接受过内分泌治疗后进展的HR(+),HER-2(-)乳腺癌患者接受abemaciclib联合氟维司群治疗对比氟维司群单药治疗后,显示出了的显著的PFS和ORR的获益,这为MONARCH3的研究设计及开展奠定基础。
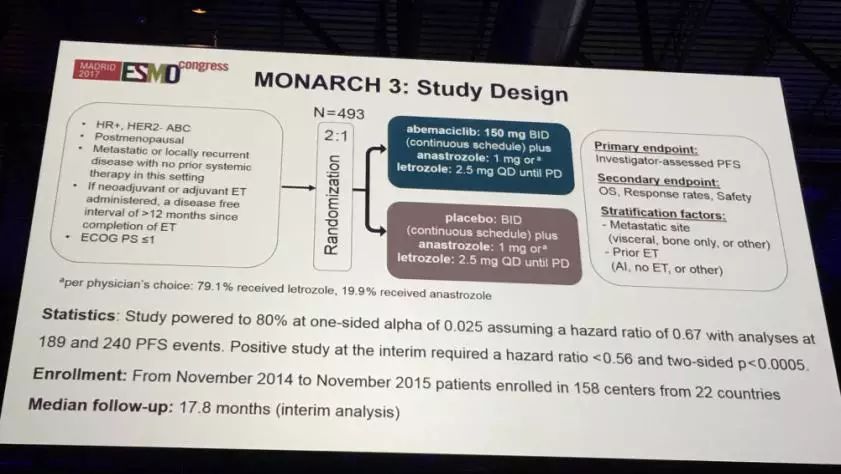 该研究从2014年11月到2015年11月,从22个国家的158个中心入组了493例患者。患者入组的条件为HR+, HER2-的转移性或局部复发的绝经后乳腺癌患者,并且既往未接受过系统性治疗;如果患者既往接受过新辅助或辅助内分泌治疗,要求内分泌治疗结束后至进展之间的无疾病时间需大于12个月;患者的ECOG 评分小于等于1。入组的493例患者以2:1比例随机分到两组,一组接受Abemaciclib(150mg一日两次)联合阿那曲唑 1mg或来曲唑2.5mg每日一次口服直至进展,另外一组接受安慰剂联合阿那曲唑 1mg或来曲唑2.5mg每日一次口服直至进展。中位随访时间为17.8个月。需要注意的是两组的患者分布很平均,尤其在入组时,患者中有约40%为新发的转移灶,约40%为内脏转移,约50%既往未接受过内分泌治疗。
该研究从2014年11月到2015年11月,从22个国家的158个中心入组了493例患者。患者入组的条件为HR+, HER2-的转移性或局部复发的绝经后乳腺癌患者,并且既往未接受过系统性治疗;如果患者既往接受过新辅助或辅助内分泌治疗,要求内分泌治疗结束后至进展之间的无疾病时间需大于12个月;患者的ECOG 评分小于等于1。入组的493例患者以2:1比例随机分到两组,一组接受Abemaciclib(150mg一日两次)联合阿那曲唑 1mg或来曲唑2.5mg每日一次口服直至进展,另外一组接受安慰剂联合阿那曲唑 1mg或来曲唑2.5mg每日一次口服直至进展。中位随访时间为17.8个月。需要注意的是两组的患者分布很平均,尤其在入组时,患者中有约40%为新发的转移灶,约40%为内脏转移,约50%既往未接受过内分泌治疗。
主要研究终点为研究者评定的无进展生存期PFS;
次要研究终点为总生存OS、反应率RR及安全性;
统计学单侧检验80% α值设定为0.025, 风险比0.67用于189和240 里的PFS分析。阳性判定需风险比小于0.56,两侧p值小于0.0005。
从试验数据中可以看到,中期分析的主要研究终点PFS显著的获益,HR(95%置信区间)为0.543,安慰剂组中位PFS为14.7个月,abemaciclib治疗组PFS尚未达到。这项数据在经过独立评估组盲评后的结果仍未改变。次要研究终点结果显示,在所有患者中,治疗组的客观反应率为48.2%,安慰剂组为34.5%。 总生存在数据收集截止时间(2017年1月)时尚未达到,只有49例获得数据,还需要后续的315例数据后才能进行分析。
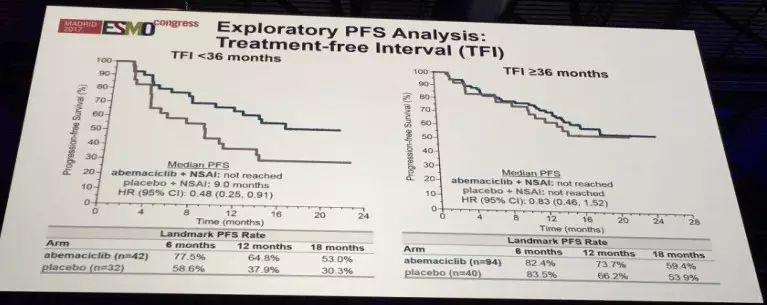
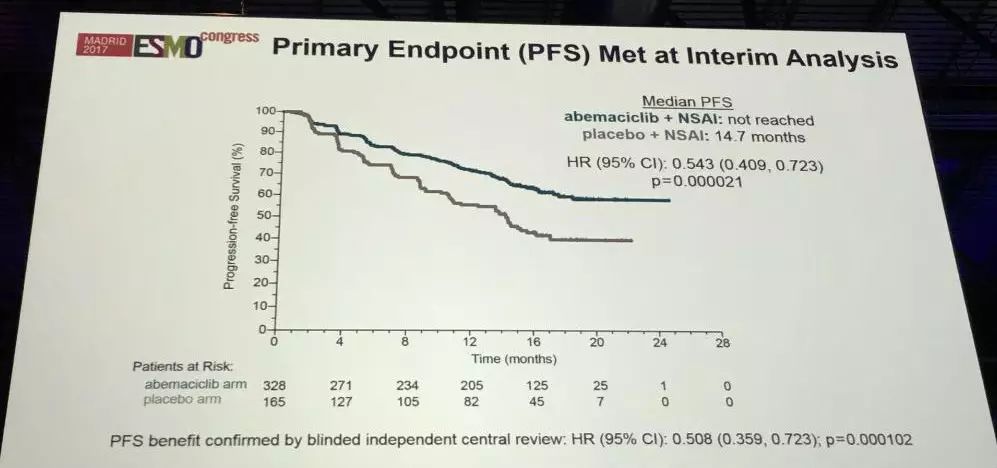 探索性的PFS分析显示,无治疗间隔时间TFI(辅助内分泌治疗结束时间至入组开始治疗的时间) 对PFS的影响,TFI小于36个月的患者从Abemaciclib联合治疗中获益更多,Abemaciclib 联合治疗组PFS未达到,安慰剂组PFS 9.0个月。而TFI≥36个月的患者的HR(95%置信区间)为0.83,接近1,这也说明对于TFI≥36个月的患者,内分泌治疗仍可能为一个很好的选择。对于这部分数据的分析需要注意三点:1、这项数据仅约占总患者的40%,这部分TFI分析的患者为既往接受过辅助内分泌治疗;2、其他部分患者置的信区间很大;3、在TFI≥36个月的这部分患者中,截止数据分析时为止,患者仍在接受治疗,因此若想获得更可信的数据,应该进行随访时间更长的临床研究,至少大部分患者均达到停止治疗。
探索性的PFS分析显示,无治疗间隔时间TFI(辅助内分泌治疗结束时间至入组开始治疗的时间) 对PFS的影响,TFI小于36个月的患者从Abemaciclib联合治疗中获益更多,Abemaciclib 联合治疗组PFS未达到,安慰剂组PFS 9.0个月。而TFI≥36个月的患者的HR(95%置信区间)为0.83,接近1,这也说明对于TFI≥36个月的患者,内分泌治疗仍可能为一个很好的选择。对于这部分数据的分析需要注意三点:1、这项数据仅约占总患者的40%,这部分TFI分析的患者为既往接受过辅助内分泌治疗;2、其他部分患者置的信区间很大;3、在TFI≥36个月的这部分患者中,截止数据分析时为止,患者仍在接受治疗,因此若想获得更可信的数据,应该进行随访时间更长的临床研究,至少大部分患者均达到停止治疗。
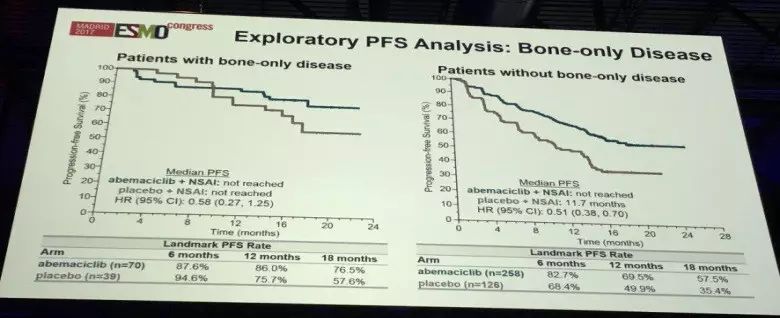
 关于骨转移患者的疗效分析,两个亚组分别为仅有骨转移组和不仅限于骨转移组。这结果与前不同,从数据可以看出,仅合并骨转移的患者,不能从Abemaciclib 联合治疗组中获益,内分泌单药可能是比较适合的治疗方案。
关于骨转移患者的疗效分析,两个亚组分别为仅有骨转移组和不仅限于骨转移组。这结果与前不同,从数据可以看出,仅合并骨转移的患者,不能从Abemaciclib 联合治疗组中获益,内分泌单药可能是比较适合的治疗方案。
 最后的亚组分析为肝转移组,可以看到有肝转移的患者预后更差,但是,即使是在肝转移的患者中,Abemaciclib联合治疗组也显示出了很好的疗效,在两组都显示出了绝对获益。
最后的亚组分析为肝转移组,可以看到有肝转移的患者预后更差,但是,即使是在肝转移的患者中,Abemaciclib联合治疗组也显示出了很好的疗效,在两组都显示出了绝对获益。

Abemaciclib联合治疗组最常见的不良反应为腹泻、中性粒细胞减少及乏力,具体比例见表。
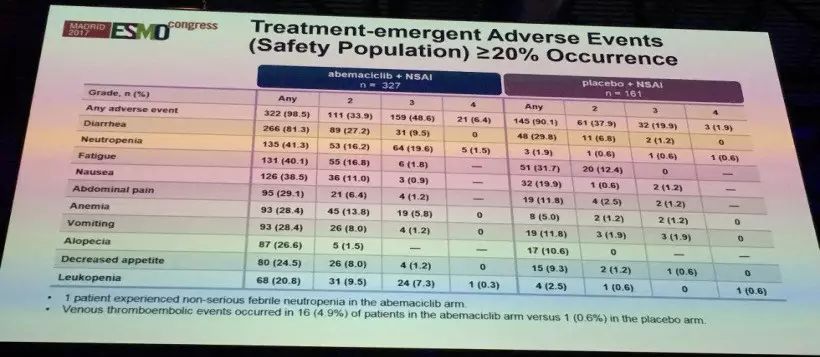
1、Abemaciclib联合NSAIs一线治疗HR+, HER2-绝经后的晚期乳腺癌患者,结果显示可以显著的提高PFS (中位NR vs. 14.7个月,HR:0.543)和ORR(59.2% vs 43.8% 对于有可测量病灶患者);
2、基于风险比分析可以看出, 在各个亚组中均可以观察到Abemaciclib的治疗效果;
3、探索性分析显示,对于预后差的亚组患者接受Abemaciclib联合阿那曲唑方案治疗获益更多,而对于长时间的TFI或仅有骨转移的患者,单纯的内分泌治疗可能是比较合适的一线治疗方案;
4、患者对Abemaciclib的持续给药方案耐受性良好,3&4级中性粒细胞减少发生率为21.1%(无中性粒细胞性发热),3级腹泻发生率为9.5%,腹泻一般发生时间较早而且通过剂量调整或抗腹泻治疗后控制良好。
Nicholas Turner教授深入点评Monach 3——CDK4/6抑制剂在ER+乳腺癌中的未来
首先,Turner教授恭喜Angelo Di Leo教授这项成功的临床试验,其次在点评前,Turner教授回顾了ER+、HER2-的乳腺癌(最常见的乳腺癌,占进展期乳腺癌的70%左右)治疗的进展和相关基础研究。他表示:“ER+,HER2-的晚期绝经后乳腺癌患者的一线标准治疗为AI治疗。而在内分泌治疗中,氟维司群的临床研究也有相应的进展,两项一线的临床研究都显示出氟维司群治疗的获益。但是我们真正需要的是靶向治疗,即针对ER+,HER2-患者生物学特征的特异性治疗。目前已知CDK4/6与乳腺癌的密切联系,对乳腺癌小鼠模型敲除Cyclin D1及CDK4基因的研究显示,没有这两种基因的小鼠可避免肿瘤导致的死亡。ER+乳腺癌的生长是依赖Cyclin D1-CDK4/6,而Cyclin D1的表达是依赖于CCND1的扩增,ER信号通路和有丝分裂信号通路。”
紧接着,Turner教授围绕着两个问题:
1. 这项研究改变了标准的一线内分泌治疗方案吗?
2. 这项研究改变了内分泌治疗针对的人群吗?”展开讨论,来探讨MONARCH3是否是一项改变临床实践的研究。
Turner教授通过对MONARCH3患者和疾病特征以及主要研究终点PFS的解读;
通过PALOMA2,MONALEESA2,MONARCH3三个研究的比较;

通过palbociclib(3/4级中性粒细胞减少患者达66%),Ribociclib(3/4级中性粒细胞减少患者达59%),Abemaciclib(腹泻率达9.5%)不良反应的比较,前两者的不良反应表现在血液学毒性方面,而Abemaciclib的不良反应主要是腹泻,前两者是间断给药,Abemaciclib是持续给药。
通过以上数据分析,Turner教授认为MONARCH3改变了标准的一线内分泌治疗以及针对人群,是一项可以改变未来临床实践和指南的研究。
随后TURNER 教授提出:
1.CDK4/6抑制剂对所有ER+,HER2-的乳腺癌患者有作用吗?
答案是否定的。MONARCH 3探索性分析显示,对于预后差的亚组患者接受Abemaciclib联合阿那曲唑方案治疗获益更多,而对于长时间的TFI或仅有骨转移的患者,单纯的内分泌治疗可能比较合适的一线治疗方案,同时在PALOMA-2和MONALEESA-2也有相似的研究结果。

2.哪些患者能从单纯的AI治疗中获益?
之前没有经过内分泌治疗,肿瘤负荷小没有内脏转移的以及分级低、生物学行为低侵袭性的患者更容易从单纯的AI治疗中获益,而之前接受过AI治疗复发的,内脏转移(肝转移),高分级的患者更不容易从内分泌治疗中获益。
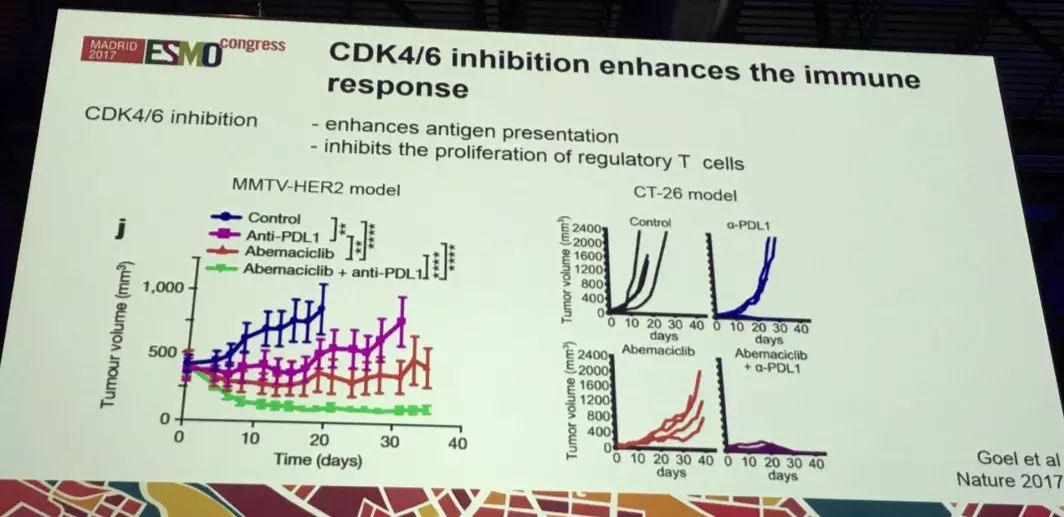 3.CDK4/6抑制剂在ER+乳腺癌患者中未来展望
3.CDK4/6抑制剂在ER+乳腺癌患者中未来展望
有一个有趣的现象——有研究显示,CDK4/6抑制剂能够通过提高抗原表达和通过抑制调节T细胞增殖来提高免疫反应。
未来,CDK4/6抑制剂在ER+,HER2-乳腺癌患者中的临床实践值得我们期待。
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情
















