
器质性心脏病室速的消融一直是当前室性心律失常治疗的热点,基质消融作为前景最为光明的一类消融策略,正引起电生理界同行们的高度关注和重视。作为多项国际多中心研究尤其是室速相关研究的组织者及重要参与者之一,来自美国纽约Montefiore电生理中心的Luigi教授及其团队对器质性室速的基质消融策略相关进展做了荟萃分析和归纳总结,文章发表在2017年《Card Electrophysiol Clin》(临床心电生理)杂志上,层次清晰,内容详尽,值得我们学习。《书心剑律》平台也第一时间将其翻译并分期分享给广大电生理同行。
 室 性 心 动 过 速 的 基 质 消 融 策 略
室 性 心 动 过 速 的 基 质 消 融 策 略
具体消融策略的总结见图4。
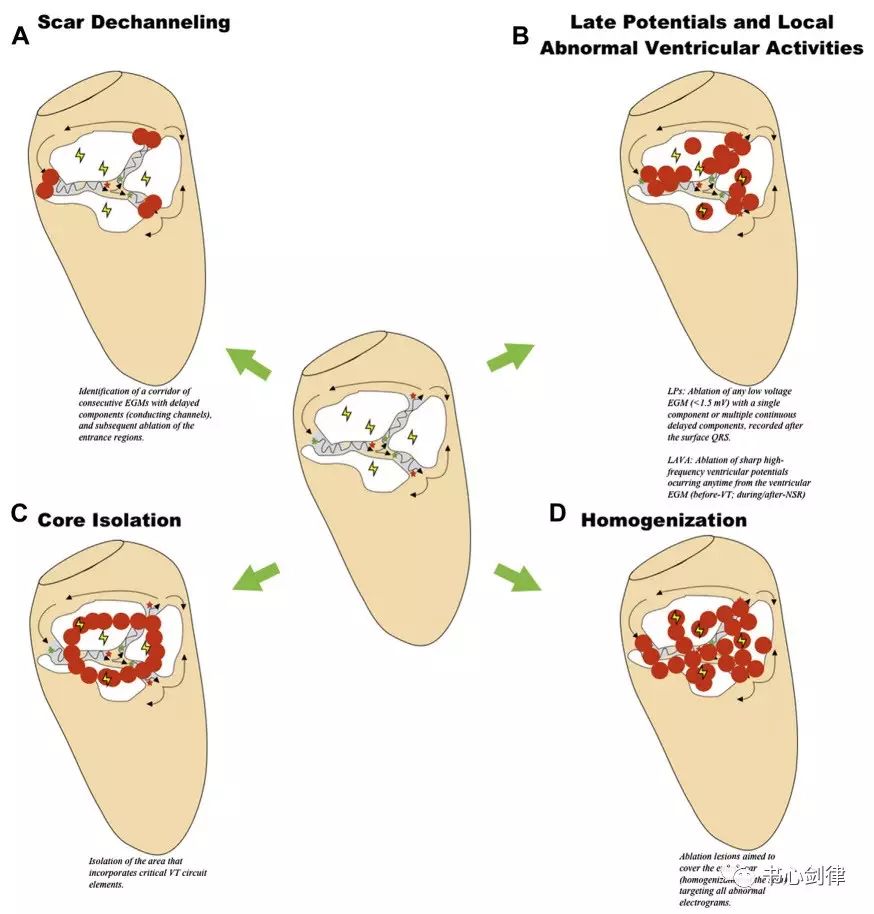 图4 基质消融的不同策略比较。通道间的区域常存在异常电活动(闪电符号),可产生VT基质;因此消除这些疤痕相关电位便成为相应的消融目标,也是不同基质消融策略的基础。A图为疤痕去通道(Scar dechanneling);B图为晚电位(late potentials, LPs)消融及局部异常心室电位(local abnormal ventricular activities, LAVAs)消融;C图为核心区隔离(core isolation, CI);D图为均质化(homogenization)消融。NSR为正常窦性心律(normal sinus rhythm)
。
图4 基质消融的不同策略比较。通道间的区域常存在异常电活动(闪电符号),可产生VT基质;因此消除这些疤痕相关电位便成为相应的消融目标,也是不同基质消融策略的基础。A图为疤痕去通道(Scar dechanneling);B图为晚电位(late potentials, LPs)消融及局部异常心室电位(local abnormal ventricular activities, LAVAs)消融;C图为核心区隔离(core isolation, CI);D图为均质化(homogenization)消融。NSR为正常窦性心律(normal sinus rhythm)
。
 晚 电 位(late potentials, LPs)
晚 电 位(late potentials, LPs)
多年来LPs一直没有统一的定义。Cassidy等将LPs定义为提前于体表QRS波之前的所有电位,在其定义中,正常电位振幅≥3mV,时程≤70ms,和/或振幅/时程比≥0.046。其研究证实,以LPs为消融靶点是有效的。随后的研究围绕这一定义又发生了变化,主要针对不同的基质消融技术。总而言之,LPs定位了心室基质中引起VT的缓慢传导通道(slow conducting channels, CCs,如峡部)。
循 证 证 据
Arenal等对24例有临床心电图记录的单形性VT患者行LPs指导下的导管消融。窦律下心内膜电解剖激动标测及右室心尖部起搏均可发现包含孤立的、延迟电位成分的区域。LPs消融可消除除一种外所有的临床VT,且不能再次诱发。平均随访9±4月,仅5例患者有VT复发。
2012年,Vergara等报道了以完全消除LP电位为靶点的VT导管消融策略的有效性结果。研究连续入选了64例ICM或NICM的VT患者,其中50例(男性47例,平均66.2±10.1岁)电解剖标测时可见LPs;35例在基础程序刺激时可诱发至少一种以上VT。基质标测后,以完全消除所有LPs为终点。其中有5例广泛消融后仍不能完全消除LPs,1例LPs定位靠近心尖部血栓附近,2例可能存在膈神经损伤。术后8例LPs不完全消融患者中仍有5例可诱发VT,42例LPs完全消除者中5例(16.1%)可诱发VT(P
仍有待进一步研究的领域是基质消融对NICM的影响。Nakahara等比较了ICM与NICM患者LPs消融的影响差异。其结果发现,与ICM相比,LPs消融联合起搏标测的消融策略在NICM病例中疗效有限。他们评估了33例行VT导管消融的SHD患者(NICM 16例,ICM 17例)。LPs消融策略在ICM患者中疗效更好(随访12±10月82%患者无复发),而NICM患者相同技术的成功率仅50%(随访15±13月)。这提示在血流动力学不稳定的VT患者中以LPs为靶点消融时,疤痕对电解剖异常的贡献,ICM与NICM基质有所不同。他们认为与ICM患者相比,NICM患者心内膜的疤痕更小,心内膜及心外膜疤痕区LPs更少。NICM患者LPs相对较少意味着该消融策略会有所受限,需考虑其他消融策略。其中一种解释是NICM的疤痕范围更小,疤痕区交汇更少,影响传导的折返环路会有不同的解剖及功能特点。
 疤 痕 去 通 道(Scar Dechanneling)
疤 痕 去 通 道(Scar Dechanneling)
Berruezo
等在文献中描述了疤痕去通道技术,他将有延迟成分的电位做标记,并根据其窦律下延迟程度的早晚分两类,即传导通道入口或内部点,按其电压振幅高低以区别于周围组织并形成连续通道(这也有助于定义折返环峡部)。根据疤痕区心肌纤维局部电活动特点,将CC入口定义为健康/移行区远场电位(低频,通常高电压)与局部电位(延迟、高频,通常碎裂、电压低)间具有最短延迟成分的电位。为避免影响疤痕附近的健康心肌,CC入口的电压范围设在0.5~1.5mV之间。
循 证 证 据
Berruezo等报道了疤痕去通道技术在疤痕相关性VT中的应用。研究入选了101例连续收治的LV疤痕相关性VT患者(75例ICM,LVEF 36±13%)。手术终点为标测所有CC并消融所有CC入口,至所有VT不能诱发。与常规消融相比,去通道消融手术时间更短(213±64 vs 244±71min,P=0.027),消融时间更少(19±11% vs 27±18%,P=0.01),需电复律者比例也更少(20% vs 65.2%,P
与NICM消融LPs得到的阴性结果不同,去通道技术在NICM患者的VT消融中似乎前途更为光明。Ferndandez-Armenta等评估了CC与VT峡部之间的联系,发现在ARVC患者中,CC多为VT基质,因此可以指导消融。Berruezo等发现ARVC患者心内膜、心外膜消融联合疤痕去通道技术可获得很好的短期及中期成功率,平均随访11月(6-24)仅1例(9%)VT复发。

局部异常心室电位(Local Abnormal Ventricular Activities, LAVAs)。Jais
等最早定义了LAVA,即尖锐的高频心室电位。这些电位可能振幅较低,窦律下可与心室远场电位并行或落于其后,在VT时可提前于心室远场电位。此外LAVA有时可表现为碎裂电位或被低振幅信号分隔成多波成分,且与其他心肌偶联欠佳。这些高频尖锐电位通常被认为是起源于病变组织的局部电活动。通常需要使用不同的起搏方法,才能将这些LAVAs特点弄清,并与心室远场电位区分开。通常要使用高密度标测导管来识别LAVAs。
循 证 证 据
2012年,Jais等发现,在绝大多数疤痕相关VT患者中均可识别LAVAs。他们发现,消除 LAVAs的消融策略安全、可行,且成功率高于常规VT消融(如激动、拖带标测)。他们前瞻性入选了70例合并SHD的VT患者(67±11岁,女性7例)。窦律下行传统标测,并使用PentaRay标测导管(35例)分别于内膜及外膜进行标测。67例(95.7%)患者可以记录到LAVAs,其中47例(70.1%)可成功消除LAVAs或使LAVAs成为无关电位。多因素分析发现,消除LAVAs与长期随访(22个月)中减少VT复发或死亡独立相关(HR 0.49,95%CI 0.26-0.95,P
 核 心 区 隔 离(Core Isolation,CI)
核 心 区 隔 离(Core Isolation,CI)
Tzou
等在其研究中首先提出CI的概念,包括由电生理数据所确认的VT折返环重要元素,或致密但电学可激动疤痕。实际操作中,为达到CI,消融术中第一步就是隔离致密疤痕(
成功的CI定义为消融后从消融灶内部以20mA及2ms脉宽从至少3处以上分散的、消融前可夺获的心室位点起搏而不能夺获心室肌(即传出阻滞)。CI的确认应在隔离区域内多位点起搏确认,而不能仅行局部起搏。CI效果的确认也一定要在确保兴趣区域完成环状消融灶后再进行。
循 证 证 据
2015年Tzou等通过双中心研究,报道了CI这种用以治疗多形或无法标测VT的消融新策略,其消融终点分散、可测量,而无需诱发VT。具体策略如下,如果VT血流动力学稳定,行拖带/激动标测,如果VT不稳定,则行电压标测(并行电位分析)和起搏标测。CI消融区域要包含关键峡部和最早出口。如果VT不能诱发,则将致密疤痕(2和55±40cm
2
。此外27例(61%)患者进行了基质改良,4例(9%)进行了心外膜消融。37例(84%)患者可达到CI,其无VT成功率比未达到CI者更好(约89 vs 57%,log rank P=0.013)。
该结果提示,CI可作为VT诱发之外另一种可量化的消融终点,CI区域的选择可基于可疑VT峡部的所有特征进行,这样可以限制消融区域的大小。

均质化消融被不同作者定义为贯穿整个疤痕区的广泛经验性消融。除了电压标准外,心内膜及心外膜的异常电位,包括延迟及碎裂的电位都是消融靶点(如LAVA和LP)。这种消融策略包括消融致密疤痕内及移行区的异常电位,使其达到均质化,从而预防电生理峡部的产生。均质化消融较其他基质消融策略的优势在于,消除所有疤痕相关的异常电位,以避免既往旁观的不同疤痕区域内某些“活化”区域可产生触发灶。尤其是其与CI策略相对比优势明显,CI的消融灶如不隔离彻底,会再连接形成折返。在行心外膜均质化消融时,消融靶点区域应至少包含3种以上异常电位。心内膜消融后,应再行心外膜疤痕标测,如果异常电位区域仍存在,则需行心外膜消融。就这一点而言,正常电位定义为基线时3个或更少的尖峰和波折,振幅≥1.5mV,时程>70ms(和/或振幅/时程比>0.046)。任何不符合该标准的电位都定义为异常电位,可作为消融靶点。只有当心外膜出现大面积延迟或碎裂电位时,才行心外膜均质化消融。这种消融策略旨在用消融灶覆盖整个疤痕区内所有的异常电位。基质消融后,需在疤痕内以20mA高输出起搏以确保无组织可被夺获。
循 证 证 据
2012年相关文献报道了两种不同消融策略对VA的影响,研究入选了92例ICM合并电风暴、逆行导管消融的患者(81%男性,平均62±13岁,平均EF27±5%)。患者行心内膜表面局限性基质消融(第1组,49例)或行心内膜及心外膜疤痕内异常电位消融(第2组,43例,疤痕均质化消融)。第2组所有患者均行心外膜穿刺,但仅33%(14例)行心外膜消融。经过平均25±10月随访,VA复发率第1组明显高于第2组(47% vs 19%,log rank P=0.006),两组各有1例非心脏原因死亡。该研究证明,心内外膜疤痕区均质化消融可显著提高ICM患者无VA生存率。
随后2015年,VISTA随机对照研究公布。该研究对比了临床消融(仅对可标测的临床VT消融)及基质消融(疤痕均质化)的VT复发率。ICM合并血流动力学耐受的VT患者随机入选临床消融组(60例)及基质消融组(58例,消除疤痕区所有异常电位)。主要终点为VT复发,次要终点包括围术期并发症,12个月死亡率及再住院率。经过12个月随访,基质消融组及临床消融组分别有9例(15.5%)和29例(48.3%)患者VT复发(log rank P
VA
是ICM及NICM患者最常见的死因之一。疤痕相关性的折返是持续性VT最常见的心律失常基质。疤痕相关性VT折返环的标测主要在于对致心律失常组织的识别,这主要基于窦律或起搏下异常电位的识别(基质标测),其可替代VT发作时用来描述折返环峡部及出口的激动标测及拖带标测(常规标测)。基质消融的策略包括LPs消融,疤痕去通道,LAVAs消融,CI及疤痕均质化消融。尽管不同策略的消融目标不同,但其终点都相同,且都在窦律下进行。循证证据表明,仅消融疤痕通道疗效不如广泛消融,这主要由于通道间的组织常存在可产生VT基质的异常电活动。因此,消除疤痕相关电位是一个较为明确的目标,也是不同基质消融策略的基础。
这些消融策略的无心律失常成功率都较高,针对这些研究的荟萃分析不仅证实了基质消融在SHD患者的VT消融中比常规消融更有效,更提示长期随访其疗效也优于常规消融。可以预期,未来器质性VT的研究方向将集中于不同基质消融策略的比较及联合,以更好地改进临床结果。不过我们依然要看到,这些证据主要来自于SHD尤其是心梗后VT人群,而NICM人群数据则很少,因此未来还需要更多研究来为该类人群找到更好的VT消融方案。
 Card Electrophysiol Clin. 2017 Mar;9(1):81-91.
Card Electrophysiol Clin. 2017 Mar;9(1):81-91.






