今天是2017年7月20日
农历六月二十七
医麦客:实体瘤迈出夯实的一步
2017年7月20日/医麦客 eMedClub/--
宾夕法尼亚大学和诺华医学研究所合作开发了
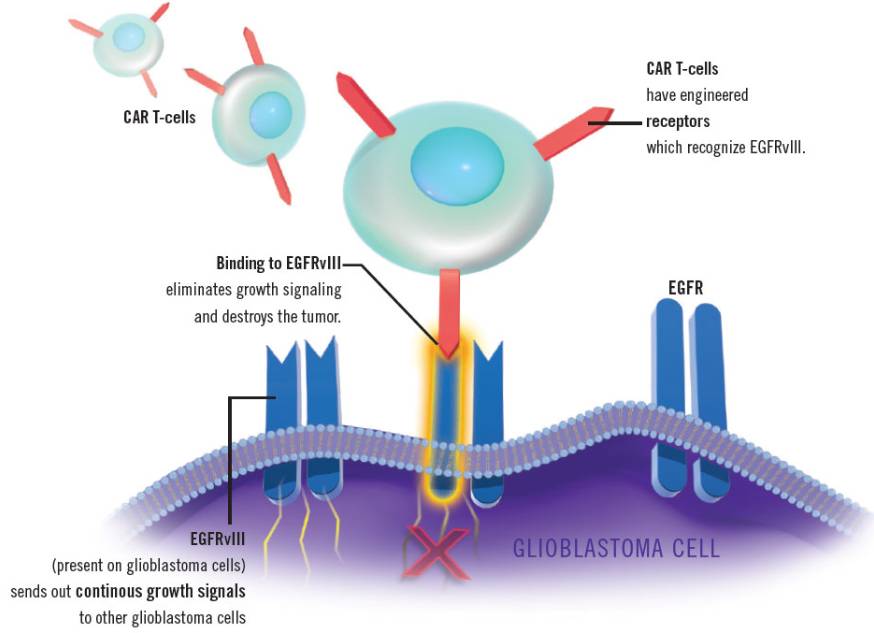
靶向EGFRvIII的自体CAR-T治疗方式
。
在
最
新的一项临床试验中(NCT02209376)
,基因改造后的“hunter”T细胞成功地迁移并渗入到一种被称为胶质母细胞瘤(GBM)的致命脑部肿瘤。但是
细胞引发了免疫抑制性肿瘤微环境
,为了更好地治疗这种侵袭性癌症,研究人员则需要克服这种复杂的微环境的影响。
今天,宾大医学院的研究人员在《Science Translational Medicine》期刊上报道了这项新研究。
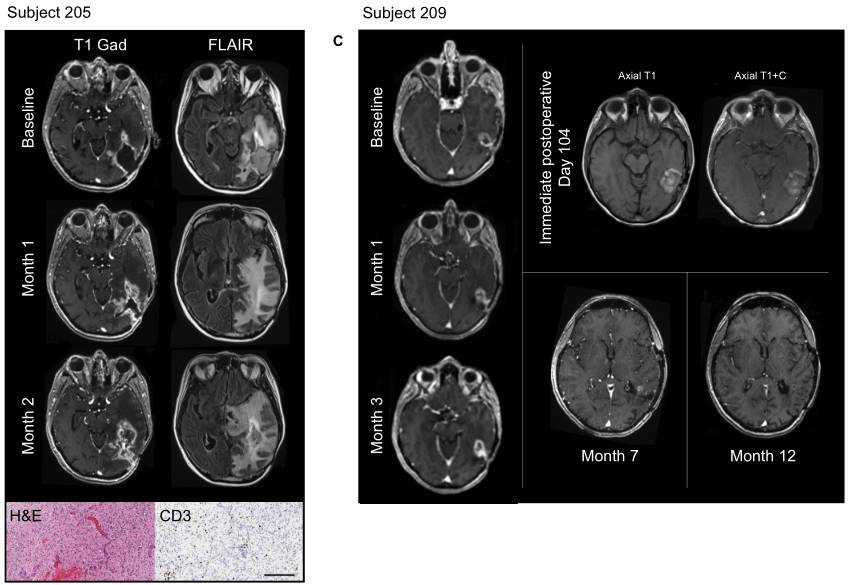
CART-EGFRvIII对两名受试者的放射学和/或病理学评估的影响
(图片来源 ScienceTranslational Medicine)
该研究是由宾夕法尼亚大学的研究人员负责进行的
一项首例人体试验
,
针对胶质母细胞瘤(GBM)的CAR-T疗法成功地跨越了血脑屏障到达脑部的肿瘤
,同时也
显示出了该疗法的安全性
,并且在GBM细胞中,其
表皮生长因子变体III(EGFRvIII)肿瘤靶标的水平显著降低
。
除此之外,该研究还发现,患者中EGFRvIII表达的广泛变化,再加上CAR-T细胞输注时
引起的肿瘤免疫抑制效应被激活
,这些可能是实体瘤临床应用方面代表性的障碍。

Donald M. O'Rourke博士(图片来源 Penn Medicine)
在过去的两年中,宾夕法尼亚大学佩雷尔曼医学院的调查人员报道了使用CAR-T细胞疗法治疗GBM患者的试验结果,
通过该方法,患者自身的T细胞被设计为追踪并杀死表达肿瘤特异性蛋白质(EGFRvIII)的癌细胞。
该研究小组由首席研究员Donald M. O'Rourke博士(宾夕法尼亚州神经外科副教授)和Marcela Maus博士共同领导,
结果表明CART-EGFRvIII细胞具有可接受的安全性,可以跨越血脑屏障,浸润肿瘤,并且能够引起免疫应答,从而使得GBM细胞中EGFRvIII肿瘤抗原的减少。
(注:MarcelaMaus博士先前是宾大的教授,现任麻省总医院癌症中心的细胞免疫治疗主任,哈佛医学院医学助理教授,也是该研究的资深作者)
EGFRVIII 作为目前发现的存在于实体瘤细胞表面的唯一高特异性抗原,在一类恶性度极高的脑部肿瘤的恶性胶质瘤(Glioblastoma, GBM)中发现,约30%的GBM是EGFRVIII高表达的。
然而,在存活一年或更长时间的患者中,EGFRvIII表达被认为与较差的预后相关。
这项CART-EGFRvIII的新研究包括第一批接受治疗的10名严重的顽固性复发性GBM患者的全部结果。
这些患者已经接受CAR-T细胞的单次输注,其中三名患者在CAR-T治疗后未接受手术治疗,三名患者分别在输液后34、55或104天进行了晚期手术,其余四名早期手术患者则具有明显的症状进展,并且接受了CAR-T输注的联合治疗。
CART-EGFRvIII(图片来源curetoday.com)
在治疗后不久接受手术的患者的肿瘤测试中发现,CAR-T细胞输注后的前两周内CART-EGFRvIII细胞和活化迹象,并且在所有接受CAR-T治疗的患者的血液中也发现
循环CAR-T细胞。
两周后,血液中CART-EGFRvIII细胞的水平开始下降,一个月后已经检测不到了。同时,接受手术治疗的5名患者的肿瘤也显示出较低水平的靶抗原EGFRvIII。
作为I期研究,该试验的主要终点是安全性,并不是疗效,当然也不可能确定CART-EGFRvIII治疗的明确临床益处
。然而,
在18个月的随访中发现,其中一名患者获得了疾病稳定的情况,并且当研究数据公布时仍然存活。另有两名患者也幸存下来,但疾病出现了进展。其余7例患者生存时间则长于根据治疗史和多灶性肿瘤复发预测的时间。
虽然该试验表明CAR-T治疗与大脑中的靶点活性相关,但随着时间的推移,研究人员发现患者肿瘤的不同区域的EGFRvIII表达存在很大差异。
C
AR-T治疗也引发了迁移到肿瘤中的免疫抑制调节性T细胞的产生,并且导致了额外的免疫抑制途径的上调。
基于此发现,研究人员指出,EGFRvIII变异和肿瘤微环境中的抑制反应都将代表潜在的治疗障碍。

(左)Swimmer’s plotdescribing time on study for each subject (black), duration of follow-up offstudy (that is, survival beyond progression or initiation of other therapy)(gray), and present status. Arrows indicate ongoing survival. Asterisksindicate surgical intervention. Dashed vertical line indicates 1-year timepoint.
(右)OS plotted asKaplan-Meier estimate for all subjects. X axis is shown in days. Tick marksindicate each censored subject (that is, subjects who are alive at the data cutoffpoint).
论文中同时确定了治疗过程中所存在的两个障碍:患者中EGFRvIII表达的广泛变化和肿瘤微环境中的抗性以及CAR-T细胞输注后具有更多的免疫抑制作用。
作者表示, 尽管前者可能需要靶向胶质细胞瘤中的其他抗原,但后者可能被现有的针对免疫抑制分子的药物所克服,例如用于成功治疗其他癌症的检查点抑制剂。
对此,该试验领导者Donald M. O'Rourke博士说:“
CAR-T输注后肿瘤中抑制性T细胞有显著的扩张,而且比没有CAR-T细胞的情况要多得多。这一点告诉我们,在CAR-T治疗的过程中需要同时调节微环境,这样才能使其更有利。另外,CAR-T细胞与小分子药物或检查点阻断抗体之间可能存在协同作用。”
目前,尽管GBM的免疫抑制性质已经得到了公认,但适应环境是一个新的发现,这项研究代表了对肿瘤微环境的深入探索。
在CAR-T细胞给药前后,我们终将得到关于肿瘤微环境的一些线索,与此同时,也开始研究改进方法,并提出有利于临床疗效的平衡点。
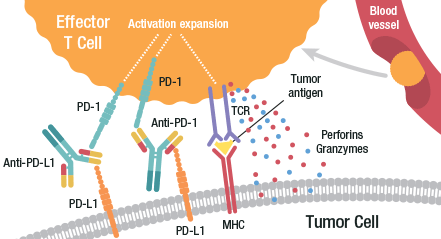
免疫检查点抑制剂(图片来源 lymphomation.org)
O'Rourke博士强调:“
这项研究令人兴奋的事情是在CAR-T细胞输注后进入大脑的T细胞克隆的数量,如果我们可以设计出更多的策略,并将其与改造肿瘤微环境相结合,那么我们将会看到更好的临床结果。”
他还建议,一种可能性是
将CAR-T治疗与检查点抑制相结合,潜在地使用程序性细胞死亡蛋白1( PD-1)或程序性死亡配体1(PD-L1)抑制剂。













