
在(主题篇)S5E31:一文了解RNA甲基化的来龙去脉中,我们介绍了有关RNA甲基化的基本概念、研究方法、研究思路、文章和基金,今天我们通过一篇PNAS文章,研究模式中的第三种(揭示疾病或者某一生命过程中某一基因的特定RNA甲基化修饰与疾病的关系。即:RNA甲基化修饰——基因转录后调控(比如选择性剪接或者翻译,再或者microRNA的产生过程)——基因表达异常——疾病或者某一生命过程。)来看RNA甲基化研究的套路。
Hypoxia induces the breast cancer stem cell phenotype by HIF-dependent and ALKBH5-mediated m6A-demethylation of NANOG mRNA.Proc Natl Acad Sci U S A. 2016 Apr 5;113(14):E2047-56.(下载链接:链接:http://pan.baidu.com/s/1dFhYDdZ 密码:tlue)
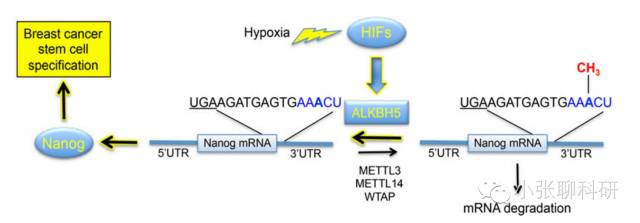
这篇文章的思路非常清晰:缺氧诱导微环境下RNA去甲基化酶ALKBH5被HIFs(1α,2α)依赖的方式上调,然后特异性的将Nanog mRNA的m6A甲基化修饰去除,从而提高了Nanog mRNA的稳定性和Nanog的表达水平,使得乳腺癌干细胞表型维持,从而促进肿瘤发生。
即:缺氧——HIFs——ALKBH5上调——Nanog mRNA去甲基化——Nanog表达上调——干细胞表型——肿瘤发生。
因此,文章的关键词有:缺氧微环境;RNA去甲基化酶ALKBH5;Nanog m6A修饰;乳腺癌干细胞。改成基金就是:缺氧微环境下,ALKBH5介导的Nanog m6A去甲基化修饰促进乳腺癌干细胞表型的功能和机制研究。
其中,缺氧微环境对ALKBH5表达影响,ALKBH5对Nanog m6A去甲基化和表达调控,以及ALKBH5与乳腺癌干细胞表型的关系是重点。
下面我们看文章的内容:
1. 缺氧微环境对ALKBH5和Nanog mRNA甲基化和表达影响
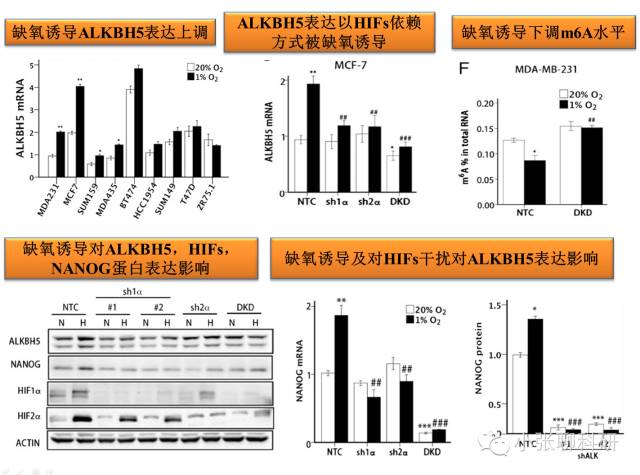
2. ALKBH5对Nanog m6A去甲基化和表达调控
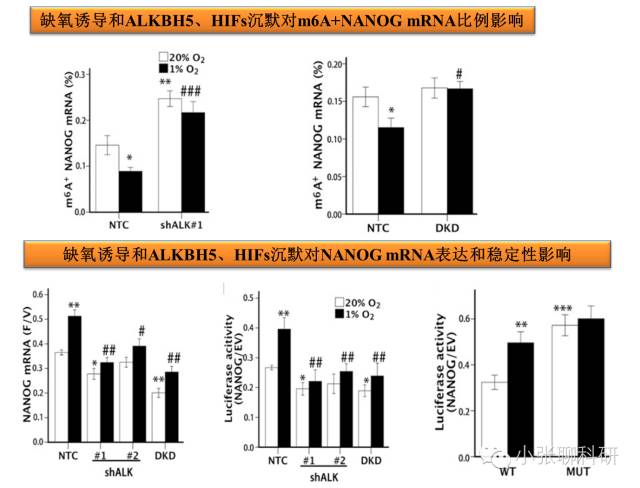 3. ALKBH5和Nanog mRNA甲基化与乳腺癌干细胞表型的关系
3. ALKBH5和Nanog mRNA甲基化与乳腺癌干细胞表型的关系
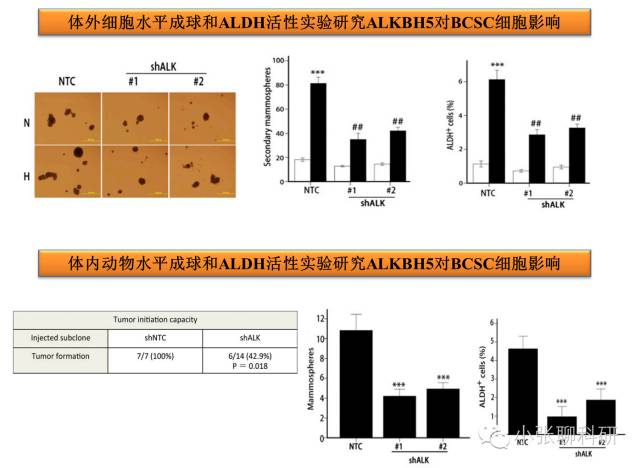
到这里,文章的内容就结束了,对于一篇PNAS文章来说是实验是非常简单的。
最后,我们总结一下这篇文章中的亮点:
1. 这篇文章主题是RNA去甲基化酶ALKBH5在缺氧微环境和诱导因子HIFs参与下通过降低Nanog mRNA m6A甲基化修饰,提高Nanog mRNA稳定性上调其表达,促进乳腺癌干细胞表型,最大的亮点是RNA去甲基化酶ALKBH5对Nanog mRNA m6A甲基化修饰和表达的调节。从这篇文章的研究思路和研究方法上看,非常适合作为设计课题和基金的参考模板。
2. 在上篇文章中,我们提到RNA甲基化修饰的参与者有“Writers”“Erasers”“Readers”等,这篇文章的关键分子ALKBH5就是一个Eraser,那么其它的参与者是否与疾病的发生发展有一定关系呢? 如果发生变化,是介导了整体RNA甲基化修饰的变化呢,还是单一RNA甲基化修饰的变化?这些关键RNA甲基化修饰的变化是否与mRNA 的稳定性、翻译、可变剪接、microRNA的生成变化有关系? 由此衍生出来的课题就很多了,大家可以按照这个模板来思考:疾病——参与者变化——RNA甲基化变化——RNA稳定性、翻译、可变剪接——细胞水平功能。
3. 本文中具体的实验方法大家可以参考,比如为了验证mRNA稳定性变化而进行flavopiridol 处理以抑制mRNA转录,检测RNA m6A修饰采用的meRIP-qPCR技术,研究干细胞功能的体内外成球和ALDH实验,验证上游分子对RNA m6A修饰采用的荧光素酶报告基因实验等等。
机会只留给有准备的人,只能帮大家到这里了。
长按二维码识别关注“小张聊科研”

关注后获取《科研修炼手册》1、2、3、4、5。














