
药明康德/报道
肥胖的阴影面积有多大?11月初公布的《2017全球营养报告》让人触目惊心。由全球众多顶尖高校科研人员组成的独立调查组,综合分析了140个国家和地区的营养状况统计数据:全世界近70亿人口当中,超重人数超过20亿。然而全球肥胖阴影的投射,远不局限于北美超过1/3人口超重。许多发展中国家人口未富先胖的格局让人扼腕,二战后人类社会从战乱饥荒到营养过剩的快速转换与并存也让人惊叹。而更揪心的是,全球肥胖儿童人数已经突破4千万,其中甚至包括1千万非洲儿童。

图片来源:Pixabay
在超重的人体内环境中,几乎所有重要的代谢器官与通路都受到长期的负面影响。而与肥胖最直接相关的脂肪组织,在持续超重者甚至已经患有肥胖症的患者体内,并非欣欣向荣地野蛮生长;恰恰相反,白色脂肪细胞的膨胀、缺氧和坏死,可能成为引起诸多代谢性炎症的第一块多米诺骨牌。因此保持脂肪组织的正常内分泌和能量代谢功能,成为遏制甚至逆转肥胖和代谢性炎症的重要环节。
武汉大学刘勇教授今年3月发表在《Nature Immunology》杂志上的研究成果,便以脂肪组织中的巨噬细胞研究为突破口,发现敲除靶细胞内质网应激感应蛋白IRE1a,可以大大提升脂肪细胞的产热活性、抵御高脂饮食诱导的肥胖发生,并且明显改善胰岛素抵抗、脂肪肝等代谢紊乱的症状。这无疑为肥胖以及诸多代谢疾病的治疗提供了重要的潜在干预靶标。刘勇教授1986、1989年获得北京大学生物化学学士和硕士学位,1995年获得新泽西州立大学微生物学和分子遗传学博士学位;2009年获国家杰出青年基金;2011年获得药明康德生命化学研究奖,2012年任科技部973计划“脂代谢紊乱疾病”研究项目的首席科学家。

脂肪细胞的前世今生
药明康德:您过去在美国的免疫学生物工程企业担任研发主管,回国之后则转入营养与糖脂代谢研究。请您谈谈促使您做出转变的契机,并从您研究的糖脂代谢出发谈谈肥胖给当代人类带来的挑战。
刘勇教授:以中国为代表的发展中国家,肥胖问题在新世纪不断凸显;与西方人群相比,甚至有后来居上的趋势。古代社会所谓的“富贵病”,已成为当代许多普通人都要正视的严峻健康风险。正因为全球多国都面临着营养失衡的挑战,所以我投入了现在的研究领域。肥胖其实只是代谢综合征的症状之一,最为重要的诱因之一是营养过剩。肥胖相关的代谢紊乱疾病还包括脂肪肝、动脉粥样硬化、2型糖尿病等,另外还可能有促进某些肿瘤发生的风险。
与肥胖最直接相关的脂肪组织,过去被认为仅仅是脂类能量的贮存场所,而今学术界已经认识到脂肪组织其实是人体内非常重要的内分泌器官,可以分泌瘦素、抵抗素、脂联素等重要激素,以及其他细胞因子和脂代谢产物。人体内的脂肪细胞可以分为白色脂肪细胞、棕色及米色脂肪细胞。白色脂肪细胞往往含有单个脂滴,且脂滴占细胞体积的90%左右,主要执行能量贮存功能;而棕色和米色脂肪细胞则有多个脂滴,并含有较多线粒体,能加速能量分解代谢。人体内棕色脂肪从出生之后就开始减少,成年后白色脂肪细胞的总数也会逐渐保持恒定。在长期营养过剩的状况下,白色脂肪组织不断扩张,甚至出现供血不足、缺氧坏死的状况。
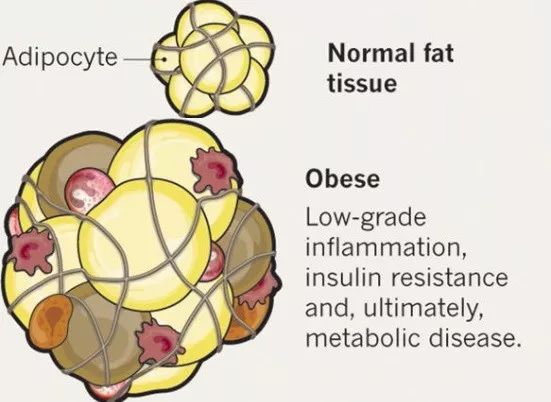
▲上图为正常脂肪组织;下图为脂肪组织膨胀发炎,并混合巨噬细胞等免疫细胞(来源:《自然》)
脂肪组织作为储能与分泌的器官,同时还与免疫系统存在错综复杂的相互作用。正常的脂肪组织内除了脂肪细胞之外,还包括多种免疫细胞的驻存,其中大约10%的M2型极性活化的巨噬细胞,具有抑制炎症并改善脂肪组织胰岛素敏感性的功能特性。然而在肥胖状况下,功能异常的脂肪组织内巨噬细胞比例可以上升至40%,主要是由坏死的脂肪细胞通过类似于内源性炎症通路,招募M1型极性活化的巨噬细胞。M1巨噬细胞自身分泌大量的炎性因子,促进脂肪组织的炎性浸润和新生血管,同时还会聚集在坏死的脂肪细胞周围形成多核巨细胞,并与坏死细胞共同形成冠状结构。在此过程中,脂肪细胞与巨噬细胞都会由于蛋白质与脂肪的代谢异常,导致内质网的功能障碍,进而引发细胞的内质网应激(Endoplasmicreticulum stress, URS);而内质网应激现象又会继续加重细胞的胰岛素抵抗和炎症反应。
药明康德:巨噬细胞浸润与内质网应激都是人体正常的适应性反应机制,它们为何在肥胖患者的脂肪组织中发挥不利的作用?您的团队最新研究成果,是从内质网应激通路发现的加速脂肪热量代谢的新靶点,请您介绍一下。
刘勇教授:巨噬细胞是人体内协调炎症反应的至关重要的效应细胞,可以对细胞残片和病原体进行吞噬消化,并激活淋巴细胞以及其他免疫细胞的免疫应答。巨噬细胞特异性分型较多,包括肝脏枯否氏细胞和肺泡巨噬细胞等等。正常情况下人体内产生炎症后,巨噬细胞会向M1极化并激发多种免疫反应;当炎症消退之后,M2巨噬细胞则应当逐渐占据主导地位。然而,当长期营养过剩导致人体脂肪细胞出现异常后,新招募的巨噬细胞会持续保持M1极性,从而使脂肪组织内M1/M2巨噬细胞的平衡被彻底打破。肥胖后期的脂肪巨噬细胞甚至可以通过原位增殖,维持脂肪组织内的炎症水平,并持续释放多种炎症因子。由此可见,肥胖是一种全身系统性的慢性代谢炎症状态。
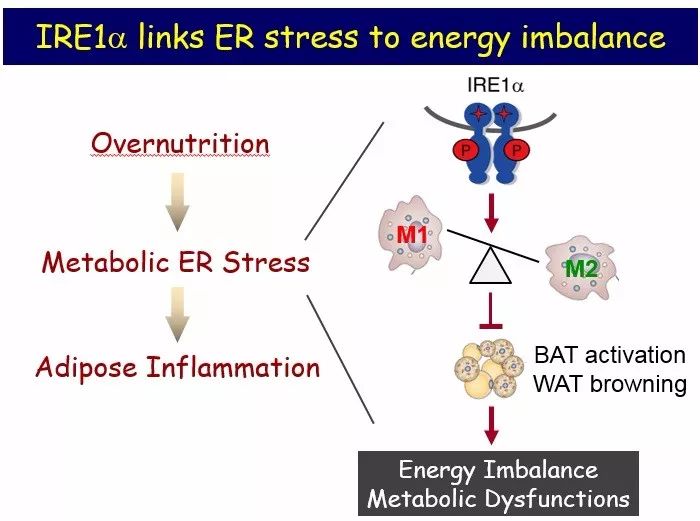
▲内质网应激与肥胖性炎症(图片来源:刘勇课题组)
内质网是细胞内最大的细胞器,内质网膜超过细胞内总体膜面积的一半。粗面内质网附有核糖体,参与蛋白质合成;而光面内质网则参与糖原、磷脂、甾类激素等物质的合成。内质网应激能够激活细胞的未折叠蛋白反应(unfolded protein response, UPR),即在缺氧、氧化应激、钙离子稳态失衡等情况下未折叠或错误折叠的蛋白增多,于是细胞启动从内质网到细胞核之间的信号转导通路,以增强内质网膜面积、增加蛋白质折叠所需的分子伴侣、以及内质网腔内的蛋白质折叠酶。但如果未折叠蛋白反应(UPR)长时间持续激活却无法缓解内质网应激,则会激发炎症信号通路、增加胰岛素抵抗,甚至导致细胞凋亡。
内质网应激启动三条关键的信号转导通路,分别是由定位于内质网的跨膜蛋白PERK(蛋白激酶R样内质网激酶)、ATF6(激活转录因子6)和IRE1(肌醇需求激酶1)介导。其中IER1a(Inositol Requiring Enzyme 1a)最早在酵母菌体内被发现,在动物进化过程中高度保守;其胞内段具有磷酸激酶和核酸内切酶的双重活性,在多种组织细胞中能够感应机体营养与代谢状况的变化,在能量平衡调节与代谢紊乱的发生发展中扮演重要角色。
IER1a通路是多年来我们团队的重点研究对象。今年我们最新发表的研究结果,就是在动物模型中揭示了营养过剩导致IRE1a的过度激活,能够阻遏巨噬细胞向M2极性活化,进而促进脂肪组织的炎症状况、降低能量消耗;而特异性抑制巨噬细胞中的IRE1a通路,则完全逆转肥胖、胰岛素抵抗与2型糖尿病等代谢疾病的症状,在相关代谢疾病的防治上可能具有重要的转化潜力。具体而言,在高脂喂养的肥胖小鼠中,我们发现如果髓性细胞(包括巨噬细胞)中敲除IRE1a基因,则白色脂肪组织中的米色脂肪转化加快,进而增强机体的产热和能量消耗,抵御高脂诱导下肥胖的发生。同时,该小鼠的胰岛素抵抗、高脂血症和脂肪肝等代谢紊乱症状明显改善。此外,伴随高脂喂养发生的M1巨噬细胞在白色脂肪中的侵润明显减少,而M2巨噬细胞却明显增多。
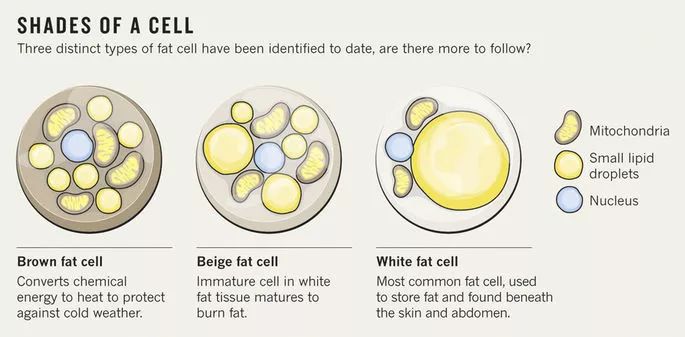
▲三种脂肪细胞(图片来源:《自然》)
内质网应激通路:揭开普罗米修斯之谜
药明康德:IER1a在人体不同组织器官中扮演的角色可能并不相同。如您所言,在脂肪组织中敲除该基因可以促进能量代谢和减少炎症信号产生,然而在肝脏中它却是非常重要的细胞再生功能推手。请您介绍一下您团队发表在《Journal of Hepatology》杂志上的相关研究成果。
刘勇教授:肝脏是人类脏器中具有独特再生能力的脏器。古希腊神话中人类的缔造者和守护者普罗米修斯因盗取天火而触怒主神宙斯,所以宙斯令山神把普罗米修斯锁在高加索山脉,并令饿鹰每日啄食其肝脏。然而普罗米修斯的肝脏每天都能完整再生,因此其痛苦要持续三万年。这个传说在某种意义上说明,数千年前人类可能已知晓肝脏的强大再生功能。
肝再生是在肝脏受到损伤、感染和有毒物质等刺激之后,残余肝细胞由基本不生长状态转变为快速生长状态,继而代偿性恢复肝脏的生理功能;同时,机体可精确感知再生肝的大小并适时停止再生过程。这由多种生长因子通过不同机制调控,其中仍有众多的未解之谜。我们发现在动物肝细胞中IRE1a介导的内质网应激通路对于肝脏的损伤修复非常重要。
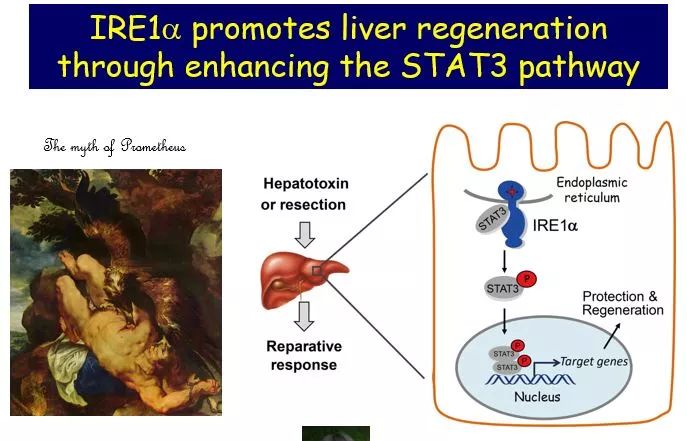
▲普罗米修斯之谜(图片来源:刘勇课题组)
我们团队利用四氯化碳诱导和肝脏切除的小鼠肝损伤模型发现,肝细胞中特异性敲除IRE1a会降低肝脏的再生能力。进一步机制层面的研究表明,IRE1a通过维持转录因子STAT3磷酸化的激活水平,来参与肝脏再生过程的调控。STAT3是构成JAK(januskinase,非受体酪氨酸激酶)-STAT信号通路的重要组成部分,而该通路广泛参与调控多种细胞的增殖、分化、迁移和凋亡。近年来STAT3在肝脏中的生理学作用逐步被阐明,主要体现在促进肝损后的细胞增殖、维持肝脏糖脂代谢平衡,以及增强肝脏在急性感染或损伤期间的反应性。同时,STAT3又在肝癌的发生发展中扮演极为重要的促进作用。所以,揭示IRE1a-STAT3通路在机体肝脏再生中的调控功能具有重要的意义。
药明康德:关于IRE1a介导的内质网应激信号通路,您还有一个重要研究成果,就是揭示它在胰岛β细胞代偿性增殖过程中的重要调节作用。请您介绍一下相关的研究。
刘勇教授:胰岛β细胞分泌的胰岛素是人体内最为重要的降低血糖的激素,还具有促进蛋白质、脂肪和糖原合成的重要功能。当人体出现肥胖状况,机体组织对胰岛素的敏感度降低,由此胰岛β细胞需要不断增量分泌胰岛素,来弥补胰岛素抵抗导致的胰岛素利用效率下降。这种高胰岛素血症若是长期不能恢复,则导致难以逆转的β细胞功能衰竭,即2型糖尿病。
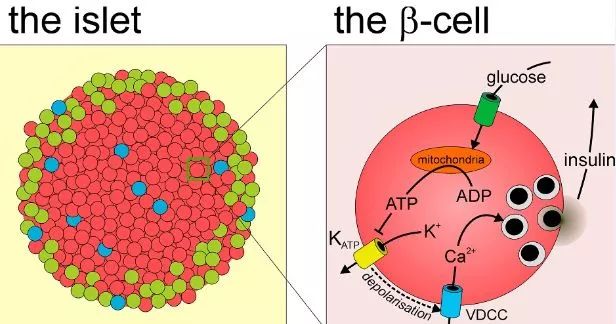
▲胰岛β细胞(图片来源:《The Public Library of Science》)
因此,在中国糖尿病患病率不断迅猛攀升的形势下,解析如何维持β细胞功能稳态、减缓其衰竭是非常重要的科学问题。我们通过构建胰岛β细胞中特异性敲除IRE1a的小鼠模型,发现正常饮食喂养情况下,IRE1a缺失会导致胰岛素含量下降并诱发高血糖;在高脂饮食喂养的肥胖与胰岛素抵抗状况下,IRE1a缺失则会显著减弱b细胞的代偿性增殖,进而加剧机体的血糖紊乱。此外,我们还发现在胰岛β细胞中,内质网应激能够诱导脚手架蛋白RACK1与IRE1a相互作用,而RACK1通过调节IRE1a的活性进而影响胰岛素的生物合成。
轻断食:促进肠道益生菌为人体益寿延年
药明康德:除了在分子生物学水平上寻找代谢疾病的发病机制和干预靶标,您也通过长时间膳食调节的动物实验,证明了肠道微生物组在人体营养代谢中发挥的作用。请您介绍一下发表在《Nature Communications》杂志上发表的相关研究成果。
刘勇教授:肠道微生物组学近年来成为国内外学术界的热点研究领域,种类繁杂的消化系统细菌数量远远超过人体细胞的总数量,堪称影响人体健康的秘密军团。肠道菌群的健康程度是人体健康和衰老程度的晴雨表,不仅直接影响消化道健康,被不当饮食破坏的肠道菌群也与多种代谢性疾病相关。因此,不少科研人员都希望从提升肠道益生菌数量、改善肠道菌群平衡的角度,来治疗疾病或者改善人体健康。
中国有句古话:要想小儿安,三分饥与寒。其实对于成年人而言也是如此。营养过度摄入会同时促进代谢紊乱与衰老,因此避免饮食失调和暴饮暴食,对于保持健康体重、维持脂肪组织健康非常重要。我们与交通大学及国家人类基因组南方中心的团队合作,发现饮食热量限制对于肠道菌群的平衡而言也非常重要:低热饮食显著促进实验小鼠肠道益生菌的生长,同时延长动物的寿命。与此同时,小鼠体内血液中的内毒素结合蛋白也显著下降,显示来自肠道菌群抗原引起的炎症水平下降;而令人吃惊的是,单纯运动只能在高脂喂养的情况下延长动物寿命,对于低脂喂养动物的健康状况没有显著影响。因此,节食作为一种干预手段,减肥降脂的作用可能超过单纯运动,而肠道菌群很可能是其作用的靶点之一,节食对肠道菌群的影响则可能与宿主的健康及寿命有密切的关联。
药明康德:客观来讲,不少代谢性疾病的研究尚在起步阶段,有许多未解之谜等待人类解析。请您谈谈这个科研领域未来探索的展望。
刘勇教授:代谢性内质网应激是连接肥胖、胰岛素抵抗与2型糖尿病的重要病理机制之一。我们对IRE1a内质网应激通路在不同器官和疾病中发挥的功能有了一定认识。下一步我们希望以分子生物学的机理为基础,通过多种试验模型寻找小分子化合物来抑制代谢性炎症、肥胖与糖尿病等。
脂肪组织的功能、内质网的稳态调控以及IRE1a的诸多信号通路,目前仍然有太多的认知空白。比如上世纪瘦素刚刚被科学家发现时,其调节饮食和饥饿感的生理功能让许多学者眼前一亮,曾一度被视为解决肥胖问题和代谢性疾病的革命性曙光。然而随着代谢研究领域的不断发展,人们对瘦素、胰岛素以及其他激素的认识更为全面,我们才明白人体内多种活性物质以及代谢通路都在执行着复杂多样的生理学功能。
但科学界能量代谢领域的未解之谜正是推动科学工作者不断深入认识人体生理功能的动力。当代肥胖和营养失衡问题在全球许多国家和地区都具有普遍流行趋势,因此对于相关疾病机理以及防治靶点的研究可谓迫在眉睫。我深信脂肪组织、代谢炎症以及肠道微生物组等研究领域,将来一定会有更多的重要成果问世,为应对不断增长的老龄化人群和慢性代谢疾病所面临的严峻挑战提供新的思路和策略。

















