近期,Science特刊:Frontiers in Cancer Therapy则试图从癌症表观遗传学,PARP抑制剂,RAS致癌基因,以及泛素-蛋白酶系统四个领域中提炼出称手的兵器,并希望借此能吹响赢得与肿瘤君战役的号角。
如果说基因突变是一场彻头彻尾的改头换面的整容项目,那么DNA和组蛋白的一些共价修饰则是在DNA原有模样之上的简单化妆。
当然这个妆容不容人们小觑,它对于维持正常细胞功能、传递基因组遗传印记、胚胎发育等起着至关重要作用,一旦妆容出错(染色质异常修饰)就会导致正常细胞发生癌变。
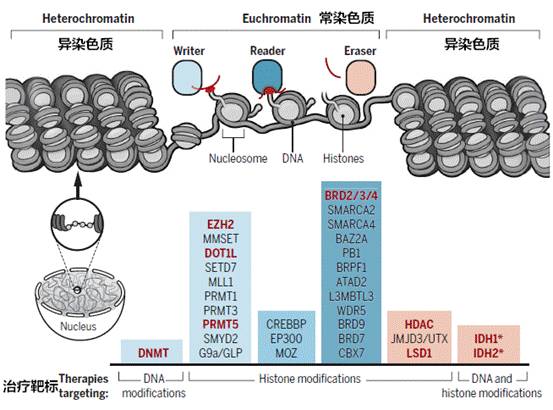
目前已有研究证实了,肿瘤细胞中CpG岛的甲基化(5mC)会发生整体性的改变,且与肿瘤抑制基因、基因组内的转座子的去阻遏有关,因而临床肿瘤治疗中最常用的表观遗传治疗药物便是DNA甲基转移酶抑制剂(DNMTi)和组蛋白脱乙酰酶(HDAC)抑制剂。
除此之外,研究者们也会通过以下几种新方法来研发能有效调节癌症表观基因组的其他小分子药物。
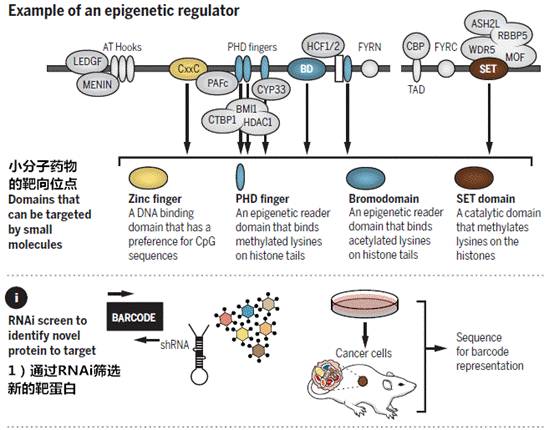
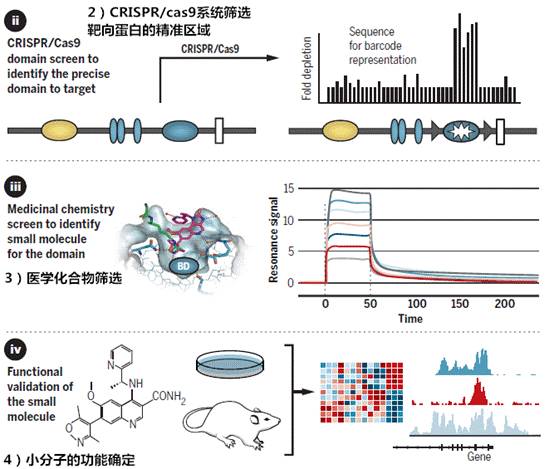
参考文献: The cancer epigenome: Concepts, challenges, and therapeutic opportunities
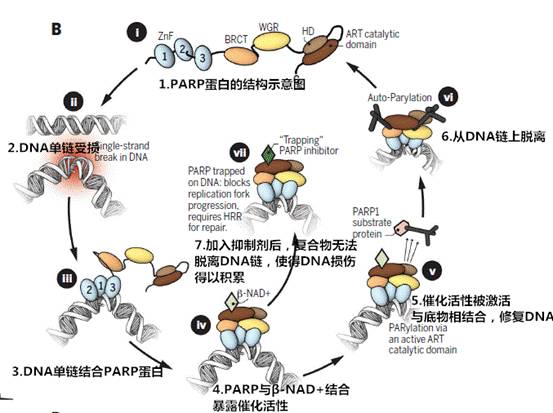
PARP抑制剂(PARPi)是一种靶向多聚合酶(ADP-ribose) 的癌症治疗方法,也是第一个临床批准的用于合成致死性(Synthetic lethality)的药物,对携带有BRCA1或BRCA2突变的患者有着良好的疗效,因为该类患者的肿瘤细胞具有特定类型的DNA修复缺陷而对PARPi敏感。
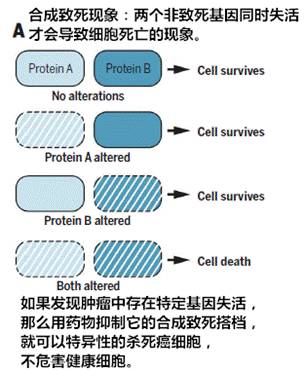
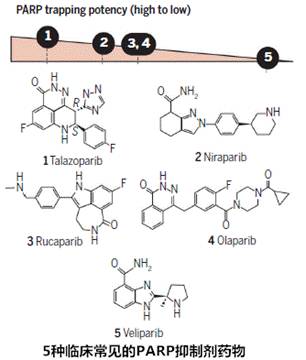
研发合成致死性药物有望实现更有效毒性更低的个性化癌症治疗,确实是抗癌药物研究的一个新方向。但是如同其它靶向治疗一样,晚期癌症患者会产生对PARP1的抗性。
此外,确定药物组合方法中PARPi的最佳使用并不容易,不过目前PARPi合成致死临床前发现和临床批准的路径为其它治疗方法的发展提供了经验教训。
参考文献:PARP inhibitors: Synthetic lethality in the clinic
RAS基因的确是一个“臭名昭著”的致癌基因,在超过30%的肿瘤中,这个基因都会产生突变。在人体中有三种RAS癌基因,其中KRAS是最常突变的(占所有RAS驱动的癌症的85%),随后是NRAS(12%)和HRAS(3%)。
但自从1982年发现它以来,三十多年过去了,一直没有药物能够成功攻克这个难题,因而RAS也就成为了所谓“无成药性”(Undruggable)靶点。
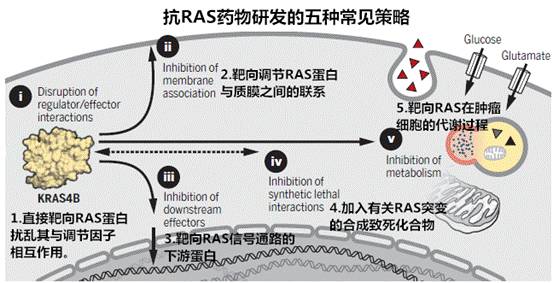
但是随着对RAS复杂性的越来越多了解,科学家们有了新的技术和方向,这一领域正在复兴,也许突变RAS终于可以被征服了。
比如美国西奈山伊坎医学院的研究者首次发现一种称为rigosertib的小分子化合物能够抑制RAS蛋白与多种信号蛋白的结合,从而防止RAS基因突变将正常细胞变为肿瘤细胞,同时为靶向RAS蛋白提供了一个新策略——与其专注于无法被药物靶向的RAS蛋白,不如转变角度,靶向与RAS蛋白相结合的RBD。
参考文献:Drugging RAS: Know the enemy
A Small Molecule RAS-Mimetic Disrupts RAS Association with Effector Proteins to Block Signaling
通常,癌症的靶向治疗是通过小分子或者单克隆抗体来抑制促进肿瘤生长的特定蛋白活性,是基于“占位”理论进行研发的,因而有其局限性:一个是肿瘤细胞会产生耐药性而导致治疗效果不能持久,另一个则是并非所有的致癌驱动蛋白都是“可药物”酶,或具有可被抑制活性的受体。
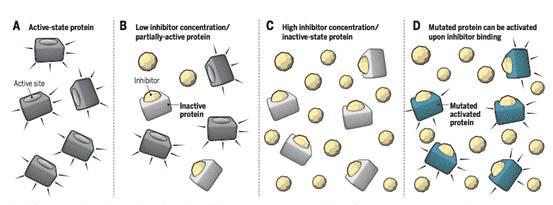
而所谓的“占位”药物研发理论就是:
(A)没有抑制剂时,靶蛋白活性位点未被占据,蛋白质保持活性。
(B)抑制剂浓度较低时,蛋白质的活性仅被部分抑制,因为活性位点没有被最大限度地占据。
(C)抑制剂浓度较高时,过量的化合物可确保活性位点被占据并最大程度破坏蛋白质酶活性。但也有一些蛋白质(如支架蛋白)具有独立于其活性位点酶活性的结合位点,仍能发挥其功能。
(D)在癌症中的某些突变蛋白中,抑制剂化合物竟作为激动剂,可以进一步活化靶蛋白。
但泛素-蛋白酶体系统(ubiquitin proteasome system, UPS)是哺乳动物细胞蛋白质降解的主要途径,恶性肿瘤的快速增殖要求更快的蛋白质降解和合成,且仅需要小分子和其靶蛋白之间的短暂相互作用就可引起所需的蛋白质功能丧失。
因而近年来UPS已成为开发抗肿瘤药物的热点靶标,以此而研发的治疗药物有以下两种方式:
a、活性位点结合和/或酶促蛋白质组接合
嵌合分子结合靶蛋白的活性位点并抑制其活性,并招募细胞蛋白降解性标记(泛素化),可使靶蛋白被蛋白酶体降解。优点就是,即便是小剂量的小分子在诱导降解靶蛋白上也可显示持续的催化活性。
b 、非活性位点结合和/或非酶促蛋白质组参与
嵌合分子以与(a)中相同的方式起作用,因而可以靶向缺乏活性位点的蛋白质(如转录因子和支架蛋白),增强药物研发的灵活性。
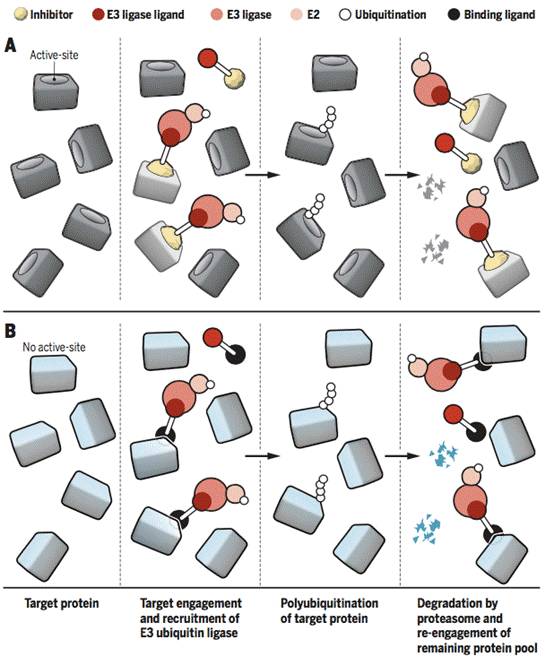
而目前关于控制蛋白质稳态机制的代表性的癌症药物和候选药物如下图所示。
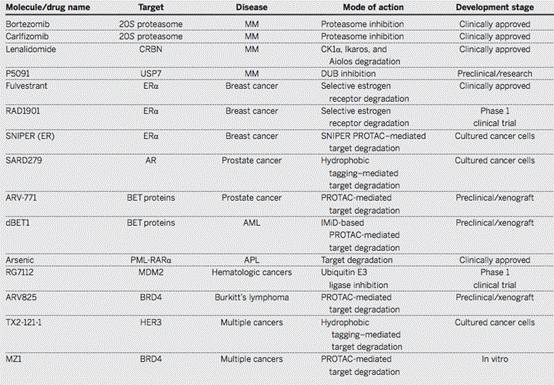
参考文献:Waste disposal—An attractive strategy for cancer therapy















