
卵巢恶性肿瘤是女性生殖器官常见的恶性肿瘤之一,发病率仅次于子宫颈癌和子宫体癌而列居第三位。但卵巢上皮癌死亡率却占各类妇科肿瘤的首位,对女性生命造成严重威胁。由于卵巢的胚胎发育、组织解剖及内分泌功能较复杂,早期症状不具有典型性,术前鉴别卵巢肿瘤的组织类型及良恶性相当困难。卵巢恶性肿瘤中以上皮癌最多见,其次是恶性生殖细胞肿瘤。
2016年,仅在美国就有约20000名患者被确认为卵巢癌。绝大多数(90%)卵巢恶性肿瘤具有上皮起源,并且根据组织学可以分为浆液性、粘液性、子宫内膜样或透明细胞样。高级别的浆液性肿瘤约占所有卵巢癌的10-15%,根据细胞是否携带有BRCA1及BRCA2突变可进一步分类。BRCA1和BRCA2基因异常的女性一生患有卵巢癌的风险高达40%(BRCA1)或是20%(BRCA2)。超过60%的卵巢癌患者在确诊时已处于后期发展阶段(Ⅲ-Ⅳ),主要治疗方案为铂类药物基础上的化疗。贝伐珠单抗(Bevacizumab,商品名Avastin)是一种人源化的单克隆抗体,在美国之外区域获批为同标准化疗方案联用作为卵巢癌的一线治疗措施。在欧洲及美国,贝伐珠单抗还获批用于复发性卵巢癌的治疗。

PARP是存在于多数真核细胞中的一个多功能蛋白质翻译后修饰酶。它通过识别结构损伤的DNA片段而被激活,被认为是DNA损伤的感受器。它还能对许多核蛋白进行聚腺苷二磷酸核糖基化。受它修饰的蛋白质有组蛋白、RNA聚合酶、DNA聚合酶、DNA连接酶等,并通过组蛋白的ADP-核糖基化使组蛋白脱离下来,有助于修复蛋白的结合而进行DNA的损伤修复。同时,PARP又是细胞凋亡核心成员胱天蛋白酶(caspase)的切割底物。因此,它在DNA损伤修复与细胞凋亡中发挥着重要作用。

Proposed mechanisms of the cytotoxicity of PARP inhibition and their effects on DNA repair
PARP抑制剂应用于肿瘤治疗主要基于两个方面的机制:
第一,PARP抑制剂能够抑制DNA单链损伤的修复过程,但这种DNA单链损伤可在DNA复制形成复制叉过程中转变成双链损伤(DSB),而这种DSB仍可通过同源重组(HR)途径修复完成。如果肿瘤细胞存在同源重组修复缺陷(包括BRCA1/2突变),使得DSB损伤无法修复,则会导致PARP抑制剂和同源重组修复缺陷对肿瘤细胞合成致死的作用。PARP抑制剂单药对于BRCA1和BRCA2突变的乳腺癌及卵巢癌细胞有明显抑制作用。
第二,BRCA1/2只是HR修复的一部分,其他蛋白如EMSY和PTEN对于HR途径同样重要,如果HR修复途径中这些基因突变或表达沉默,PARP抑制剂即可能通过合成致死作用而产生单药抗肿瘤活性。目前大部分的化疗药物和放疗都是通过直接或者间接攻击DNA,造成DNA损伤。如果抑制肿瘤细胞的DNA损伤修复功能,则会大大提高放化疗的疗效,避免产生耐药。国内布局PARP抑制剂的公司主要有百济神州、豪森药业、青峰药业、人福医药、瑛派药业等。
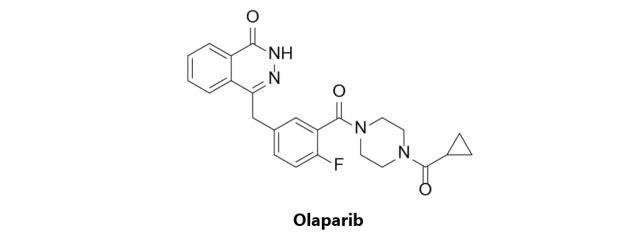
Olaparib
第一种进入卵巢癌治疗药物市场的PARP抑制剂类药物,由阿斯利康原研,于2014年12月16日获得欧洲EMA批准,于2014年12月19日获得美国FDA的加速批准上市,商品名为Lynparza。该药物是一种新型的PARP抑制剂,可通过肿瘤DNA修复途径缺陷优先杀死肿瘤细胞,为抑制肿瘤的口服一线用药,其适应症为与BRCA基因突变相关的晚期卵巢癌化疗后的单药治疗。
Olaparib于2014年获得EMA的条件性批准作为复发性生殖细胞或体细胞BRCA突变(g/sBRCAm)的高级别浆液性卵巢癌的维持性治疗药物。在代号为SOLO-2的一项三期临床研究中,针对复发性铂类药物敏感的gBRCAm卵巢癌患者,Olaparib可将PFS(Progression-free survival)由安慰剂组的5.5月提升至30.2个月。基于上述实验结果,FDA批准了Olaparib作为卵巢癌维持性治疗药物的优先审查,而PDUFA的(Prescription Drug User Fee Act)相关工作则会在2017年三季度开展。另外,基于正在进行的名为SOLO-1的三期临床研究,该药物正寻求获批作为携带有BRCA突变的卵巢癌患者的一线维持性治疗药物。
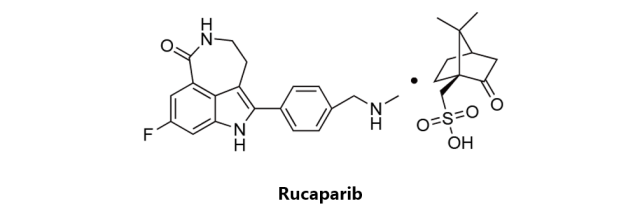
Rucaparib
第二种进入卵巢癌治疗药物市场的PARP抑制剂类药物,辉瑞原研,后转让给Clovis Oncology。该药物于2015年被美国FDA授予治疗卵巢癌突破性疗法资格,2016年12月19日获得美国FDA加速批准上市,商品名为Rubraca。Rucaparib Camsylate是一种PARP抑制剂类药物,通过作用于PARP1-3修复DNA起作用。该药物被批准作为单一疗法用于接受过两次及以上化疗的携带有BRCA突变的晚期卵巢癌患者的治疗。Rucaparib Phosphate用于治疗输卵管癌和腹膜癌的临床研究目前也正处于三期临床阶段。

Niraparib
FDA批准的第一款用于复发性铂类药物敏感型卵巢癌的维持性治疗的PARP抑制剂类药物,商品名为Zejula。Niraparib是一种PARP-1/2抑制剂,IC50分别为3.8nM和2.1nM,可抑制DNA的修复,其获批适应症为复发性上皮卵巢癌、输卵管癌及原发性腹膜癌及对铂化疗完全或部分响应的成人患者的维持治疗。与Olaparib及Rucaparib不同,Niraparib获批适应症不需要考虑患者的BRCA突变及HRD状态。该化合物最初由默沙东研发,后授权给Tesaro,后由后者授权给杨森和再鼎医药。2017年3月,中国CFDA受理了再鼎医药提交的关于本品的临床试验申请(化药1类)。
PARP抑制剂类药物的出现,极大的改变了卵巢癌治疗领域的局面。与此同时,其他一些生物制剂及小分子抑制剂类药物也分别处于不同的研发阶段,有望进一步拓展卵巢癌领域的治疗手段。


卵巢癌药物研发管线中最有希望的药物为靶向PD-L1的抗体药物,其中Pfizer/Merck KGaA研发的Avelumab及Roche/Genentech研发的Atezolizumab分别有两项及三项三期临床项目在研。对于新确诊的晚期阶段患者,编号为JAVELIN Ovarian 100的项目正在评估化疗后或同时使用Avelumab的维持性疗法效果是否优于化疗单独治疗的效果;而IMagyn050项目则要确认将Atezolizumab增加至化疗及Bevacizumab治疗方案中的效果。对于铂类药物具有抗性的复发性卵巢癌病例,Atezolizumab正在开展Bevacizumab存在与否的条件下,该药物同脂质体阿霉素(PLD)联合用药的效果,并以PLD同Bevacizumab连用作为对照。针对同样的患者群体,JAVELIN Ovarian 200项目正在评估Avelumab单独用药或同PLD联合用药的疗效。与此同时,在对铂类药物敏感的复发性卵巢癌患者中,ATALANTE项目正在评估Atezolizumab同化疗及Bevacizumab联合用药的效果,该研究仅在法国开展。
Avelumab由Merck Serono研发,于2017年3月23日获得美国FDA批准上市,商品名为Bavencio。Avelumab是一种靶向于细胞程序性死亡配体PD-L1的全人源IgG1型单克隆抗体类药物,能结合PD-L1并阻止其与受体PD-1和B7.1的结合。该药物的批准适应症为治疗Merkel细胞癌(成人或12岁以上儿童)和晚期或转移性尿路上皮癌
Atezolizumab由基因泰克研发,于2016年5月18日获得美国FDA批准上市,商品名为Tecentriq。Atezolizumab是一种Fc区改造的人源化单克隆抗体,作为细胞程序性死亡配体PD-L1阻断剂,能与肿瘤细胞或肿瘤浸润性免疫细胞上的PD-L1受体结合,并阻断其与T细胞及抗原递呈细胞中PD-1和B7.1的结合,从而解除PD-L1/PD-1介导的免疫抑制。该药物获批适应症为局部晚期或转移性尿路上皮癌的治疗,适用人群为在铂类药物化疗期间或化疗后病情恶化,或接受铂类药物化疗联合新辅助或辅助外科治疗12个月内病情进展的患者。此外,Atezolizumab也批准用于铂类化疗后疾病进展以及接受EGFR或ALK靶向药物治疗后疾病进展的转移性非小细胞肺癌患者。

紫杉醇由NIH研发并于1992年12月29日获得美国FDA批准上市,商品名为Taxol。该药物抗肿瘤的作用机制为诱导微管生成和稳定微管,继而使细胞周期G2和M期正常的细胞分裂中断。紫杉醇联合顺铂或卡铂用于晚期卵巢癌的初次治疗及标准含铂方案治疗失败后的二线治疗。目前一种采用胶束以降低药物副反应的形式正在欧洲处于监管审查中,并有望在2017年向FDA提出申请。而另一种细胞毒性药物lurbinectedin目前正开展代号为CORAIL的三期临床研究,用以评估该药物同PLD或topetecan的疗效差异。
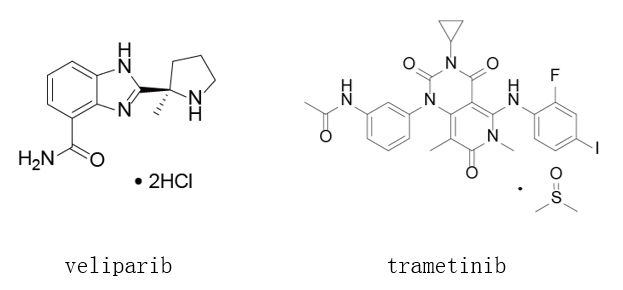
迄今为止,三类PARP抑制剂类药物的获批极大推动了卵巢癌治疗领域的进展,而AbbVie公司的Veliparib也正处于三期临床研究中。不同于Olaparib、Rucaparib及Niraparib所需的临床研究,针对Veliparib的临床试验目的在于评估该药物同铂类化疗联用及作为未经治疗的高级别浆液性卵巢肿瘤的维持性治疗。Novartis公司的Trametinib目前正处于Ⅱ/Ⅲ期临床研发阶段用于复发性或进展性低级别的浆液性卵巢肿瘤的治疗,该药物属于MAPK/ERK激酶抑制剂。而另一种MEK抑制剂类药物,Array BioPharma公司的Binimetinib的三期临床研究则在2016年被终止。

处于三期临床研究阶段,针对前期经治疗且对铂类化疗存在抗性的复发性卵巢癌的药物主要包括Mateon Therapeutica公司的Fosbretabulin及Immuno Gen的Mirvetuximab Soravtansine;前者是一类结合于微管的血管阻断剂,后者则是靶向于叶酸受体的抗体偶联药物,该受体在超过90%的非粘液性卵巢癌中存在过表达。目前两类药物同其他药物联用的早期临床研究正在对铂类化疗敏感的患者群体中开展。AstraZeneca的Cediranib是一类口服的新生血管抑制剂,目前正在同Olaparib联用用以测试对于铂类化疗敏感或具有抗性的复发性卵巢癌的治疗效果。另外一项正在开展的三期临床研究正在测试gemogenovatucel-T,一类自体肿瘤细胞疫苗作为高级别晚期浆液性卵巢癌的维持性治疗方案。
处于早期研发阶段的新型药物靶点还包括WEE1、布鲁顿氏酪氨酸激酶、吲哚胺2,3双加氧酶、CSFR1及B7-H3/CD276等。这些靶点针对卵巢癌的Ⅰ/Ⅱ期临床研究正在进行中,且多数同PD-L1抑制剂类抗体联用于复发性患者中。
PARP抑制剂类药物的持续获批(Olaparib、Rucaparib及Niraparib)及两类PD-L1抑制剂类单抗药物(Avelumab及Atezolizumab)的获批预期,将有力推动卵巢癌药物市场的迅速增长,市场容量在2026年有望达到67亿美元,如下图所示。

Sales of drugs for ovarian cancer
这其中,PARP抑制剂类药物将占据最大份额,销售额达25亿美元,占比达50%左右。得益于广泛的适应症,Niraparib将会对卵巢癌药物市场产生最大影响,在2026年有望占据PARP抑制剂类药物销售份额的三分之二。Rucaparib的早期治疗定位及相比于Olaparib更广泛的适应症,使其有望抵消一些Olaparib的先入优势。另外,Niraparib的适应症可用于不携带BRCA突变或HRD的患者,使其相对于Olaparib及Rucaparib更有竞争优势;如果没有改变产生,Olaparib及Rucaparib的窄适应症范围将会限制它们在未来的销售潜力。PD-L1抑制剂类药物有望在2026年达到26亿美元的销售额。作为第一款预计将进入卵巢癌药物市场的PD-L1抑制剂,Avelumab预计在2026年将占据75%的销售份额。
尽管新生血管抑制剂类药物占据了2016年卵巢癌药物市场的绝大多数份额,该类别药物预计在2026年将会极大程度上萎缩。Bevacizumab的持续增长,特别是在对铂类化疗敏感的复发性患者中的扩展应用,将会持续推动其销售额增长;而相对价格偏低的bevacizumab生物仿制药,以及来自于PARP及PD-L1抑制剂类产品线的强有力竞争,则会严重阻碍该类别药物市场份额的增长。
广告
















