太懒只看重点版:
1. 为啥转录组与蛋白组在一起不好玩?
A: mRNA转录速度和翻译速度可能是不一致的,mRNA转录后调控是普遍存在的,加上不同蛋白的稳定性也不一样,所以转录组与蛋白组结果的相关性并不好。
2. 翻译组是啥?
A: 转录组测的是总mRNA,但并不是所有mRNA都在翻译啊,只有结合了一串核糖体的mRNA才算是干活的mRNA,我们只测一下这些正在翻译的mRNA好了,就叫它翻译组吧。
3. 翻译组咋搞?
A: 正在翻译的mRNA结合了一串核糖体(polysome),这种结合是很紧密的,把多聚核糖体分离出来就行了。可以用蔗糖梯度分离或核糖体免疫沉淀(翻译组之CNS潜质)。
真粉必看长文版:
玩转录组玩多了很容易产生一种虚无感,这些上调下调的东西真的有论文里说的那么种要吗?它们会不会像中-南-海的政策那样执行总是与规划不太一样?它们翻译了没有?翻译速率一样吗?它们是以怎样的形式影响生命的表现呢?这些上调下调的差异传达到蛋白组了吗?不同蛋白不会再有什么自己的调控吧?
咋越想越不靠谱?要不来一个蛋白组看看?
无数玩转录组的小伙伴就这样犹犹豫豫地做了个蛋白组……
然后静静地祈祷……

蛋白组结果很可能会让玩转录组的伙伴一时有点懵,
就这么少?
灵敏度这么低?
跟转录组相关性?呃——,哪有什么相关性!

一般同志遇到这种情况一般会想静静,然后决定随便灌篇水尽快结束这段孽缘。
但总有些牛人认坑不认栽,啥烂摊子都能弄出个所以然来。
这么多人被坑,肯定有原因啊,这就有搞头!
是不是并不是所有mRNA都在翻译啊?来,想办法看一下。
于是一波牛文诞生,甚至还搞出一篇《Cell》。
要想分离正在翻译的mRNA并不容易,我们只能从核糖体间接下手,因为mRNA在翻译时总是有一串核糖体结合在上面,形成念珠状多聚体:
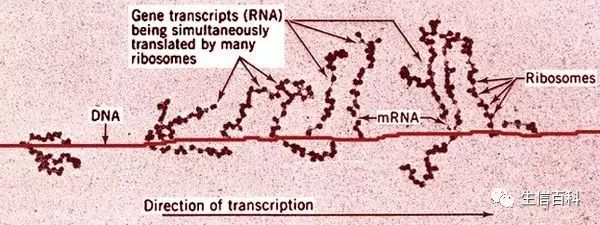
图片来自网络,只是用来举个例子,本图中可以看出该物种没有细胞核。
还好,mRNA与核糖体间的结合很稳定,那么只要分离这些多聚体再纯化mRNA就可以了。分离多聚体一般有两种方法:
蔗糖梯度分离法(sucrosegradient-based fractionation)
最近看到一篇论文,2017年发表在《NewPhytologist》【1】,他们用了一种蔗糖梯度分离的方法很巧妙地(询问过作者,表示工作量实际很大)把与mRNA结合的核糖体多聚体分了出来,然后对正在翻译的mRNA进行了表达分析。
这个实验操作可以参考这个JOVE视频论文(对,论文的形式就是视频,还是SCI哦,1分左右)
https://www.jove.com/video/51455/polysome-fractionation-analysis-mammalian-translatomes-on-genome-wide
这个方法并不新鲜,但也并不容易,所以产出论文要比转录组好一些。
核糖体免疫沉淀法(TRAP, translating ribosome affinity purification )
这是一种更高端的玩法,也是玩出《Cell》【2】的玩法:
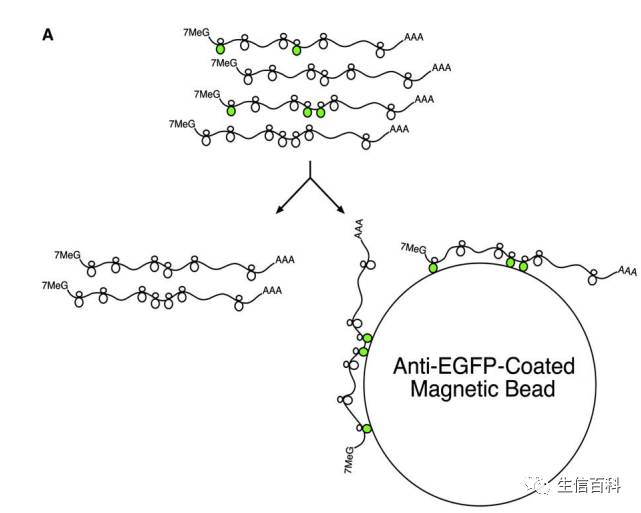
它把核糖体大亚基的L10a蛋白加上了GFP,这样便能利用GFP抗体把多聚体免疫分离出来,进行表达分析。
这个方法后来经过进一步加工,成功在植物中应用,又搞了一个10分文章【3】。
这篇《Mol Syst Biol》是我最欣赏的文章,它把核糖体大亚基的L18蛋白