
来自
Aspidosperma
和
Kopsia
的单萜吲哚生物碱具有复杂的稠环结构和广谱的生物活性,因而得到广泛的研究。这些家族化合物的重要结构差异在于
Aspidosperma
生物碱含有顺式稠合的氮杂十氢化萘结构,而
Kopsia
生物碱则含有反式稠合的氮杂十氢化萘结构(图1)。
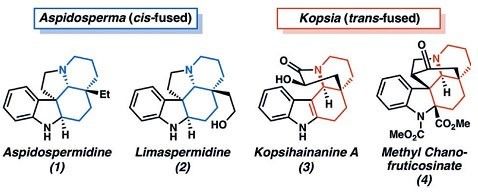
图1. Aspidosperma和Kopsia生物碱。图片来源:
Angew. Chem. Int. Ed.
2016年,
美国加州理工学院
的
Brian M. Stoltz
教授等人报道了Pd催化的二氢吡啶并[1,2-
a
]吲哚酮(DHPI)类底物的不对称脱羧烯丙基烷基化反应,并利用具有α-季碳中心的产物进一步通过吲哚-亚铵的环化对映选择性地发散合成了一系列
Aspidosperma
生物碱天然产物。鉴于这些手性合成砌块快速易得,并具有高对映选择性,最近,作者尝试进一步研究该类反应在其他天然生物碱合成中的应用,并以此完成了(+)-limaspermidine和(+)-kopsihainanine A生物碱的全合成。相关工作发表在
Angew. Chem. Int. Ed.
上。
他们设想δ-内酰胺结构
9
能以Pd催化烯丙基烷基化的产物作为原料两步反应获得,随后
9
通过负氢还原剂还原和脱水得到亚铵
10
,进而发生Pictet–Spengler型环化得到具有顺式稠合的八氢喹啉的四环结构
11
,这样的中间体可以用于进一步合成
Aspidosperma
家族的生物碱,如(+)-limaspermidine。而调整合成步骤,先发生C-C键形成,随后形成C-H键,进而通过Bischler–Napieralski型环化便得到稠合的四环亚铵中间体
12
,负氢还原剂还原得到反式稠合的八氢喹啉的四环结构
13
,
13
可用于(+)-kopsihainanine A及其他
Kopsia
生物碱的全合成。
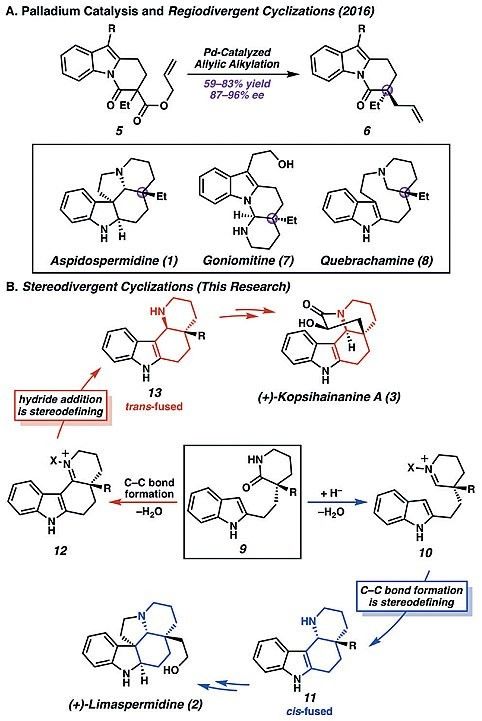
图2. 吲哚-亚铵环化反应。图片来源:
Angew. Chem. Int. Ed.
作者首先进行了(+)-limaspermidine的合成。未取代的DHPI
14
在LHMDS的作用下与烯丙基氰基甲酸酯进行
C
-酰基化反应,接着在碳酸钾的碱性条件下发生烷基化反应,以两步80%的收率得到中间体
16
。
16
在Pd
2
(pmdba)
3
/(S)-(CF
3
)
3
-tBuPHOX的催化条件下以82%的产率和94%的对映选择性得到含α-季碳手性中心的中间体
17
。中间体
17
随后发生锆氢化/胺化反应得到中间体
18
,
18
无需分离直接在反应体系中加入四氢铝锂,随后小心用醋酸和水淬灭促进吲哚与亚胺的环化得到中间体
19
。
19
又在碳酸钾的碱性条件下发生哌啶的选择性
N
-烷基化反应得到中间体
20
,三步总收率达到62%。
20
发生环化和负氢还原剂还原两步反应,以72%的总收率得到氧苄基保护的limaspermidine中间体
22
,接下来在BF
3
•Et
2
O的作用下消除苄基,以84%的收率得到(+)-limaspermidine
2
。
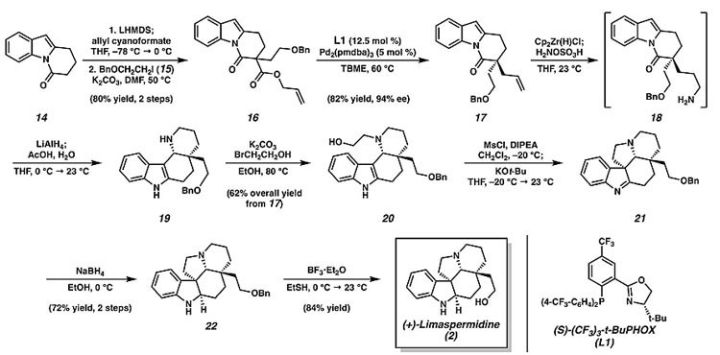
图3. (+)-limaspermidine的合成。图片来源:
Angew. Chem. Int. Ed.
他们还从未取代的DHPI
14
出发,通过
C
-酰基化/Michael加成两步反应,以两步92%的总收率得到中间体
23
,
23
在钯催化的条件下进行不对称脱羧烯丙基烷基化反应,以90%的产率和92%的对映选择性得到中间体
24
。
24
随后进行铑催化的硼氢化/氧化反应以87%的产率得到醇中间体
25
,经过简单的两步转化以88%的总产率得到叠氮化物中间体
26
。
26
又通过Staudinger还原反应以81%的产率得到内酰胺
27
产物,
27
在三氟甲磺酸酐/2-氯吡啶和硼氢化钠的先后作用下以84%的产率得到中间体
28
,并在TBD的作用下进行环化反应得到中间体
29
,该化合物的构型通过X射线单晶衍射进行确定。
29
在LDMA/(TMSO)
2
/HMPA的作用下以91%的产率完成了(+)-kopsihainanine A的全合成工作。
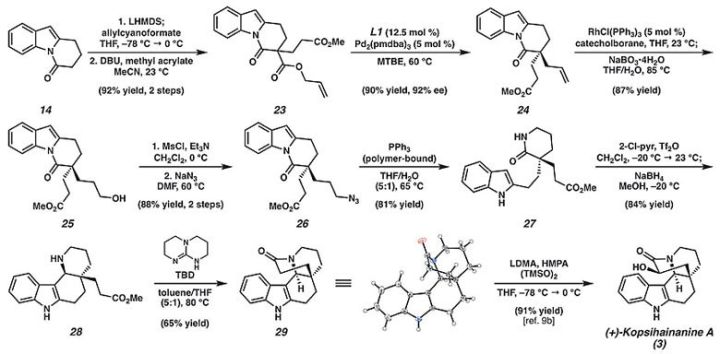
图4. (+)-kopsihainanine A的全合成。图片来源:
Angew. Chem. Int. Ed.
——总结——
Brian M. Stoltz教授报道了以钯催化DHPI衍生物的不对称脱羧烯丙基烷基化反应作为关键步骤的(+)-limaspermidine和(+)-kopsihainanine A的简单高效不对称全合成。(+)-limaspermidine以8步线性反应实现,总产率为25%;(+)-kopsihainanine A 以9步线性反应实现,总产率为28%。该策略同样有望用于其他
Kopsia
家族生物碱的全合成。















