DNA双螺旋结构发现者、诺贝尔奖得主FrancisCrick 1958年提出,1972年又在《Nature》中重申的著名的“中心法则(genetic central dogma)”告诉我们遗传信息是核酸(DNA或RNA)到蛋白质的过程,而不能由蛋白质转移到蛋白质或核酸之中(The central dogma of molecular biology dealswith the detailed residue-by-residue transfer of sequential information. Itstates that such information cannot be transferred from protein to eitherprotein or nucleic acid)【1】。这个理论可以解释绝大部分经典的孟德尔遗传现象。然而事实上,自然界也不断对它进行挑战。例如一对拥有近乎完全一致的遗传信息的同卵双胞胎,为何一方正常,一方患有红斑狼疮?似乎有什么其他“神秘的力量”影响着基因的表达,而且因环境、个体差异而异。
答案就藏在DNA双螺旋结构共同发现者JamesWatson的名言中:“你可以继承DNA之外的东西,这正是现在遗传学中让我们激动的地方”。“这个东西”就是表观遗传学(Epigenetic)研究的内容,包含DNA的后天修饰和蛋白质的翻译后修饰(甲基/去甲基化,乙酰/去乙酰化,磷酸/去磷酸化,泛素/去泛素化等)。自1942年奥地利发育生物学家Conrad Waddington首次提出表观遗传学的概念,最近几十年得到了迅速发展,也是各大制药企业和研究院竞相追逐的热点。2014年Rockefeller大学的教授C.David Allis 就因研究组蛋白翻译后修饰对染色质信号调控摘得2014年诺贝尔奖。
遗传信息载体——染色质是由DNA和组蛋白组成的高级复合物,其结构随着组蛋白末端赖氨酸残基的表观遗传学修饰(ε-氨基的乙酰/去乙酰化)而变化。例如,乙酰化时中和了赖氨酸残基上的正电荷,导致组蛋白与DNA相互作用减弱,染色质变得疏松,有利于各种转录因子和协同转录因子与DNA结合位点特异性结合,激活基因的转录【2】。而组蛋白的去乙酰化则发挥相反的作用。生物体内蛋白赖氨酸残基乙酰化水平受到组蛋白乙酰基转移酶(histoneacetylases,HATs)和组蛋白去乙酰化酶(histonedeacetylases,HDACs)共同控制。
目前已经发现的人源的HDACs共有18个亚型,可分为classⅠ-Ⅳ四个亚族【3】。ClassⅠ包括HDACl、2、3和8;classⅡ包括HDAC4、5、6、7、9和10;classⅢ又被称作sirtuins,包括SIRTl,2,3,4,5,6和7;classⅣ只有一个成员,HDAC11,含有classⅠ和Ⅱ亚族共有的催化活性中心,但结构与这二者有较大差异。ClassIIHDACs又被分为classⅡa (HDAC4、5、7和9)和classⅡb (HDAC6和10)。ClassⅠ、Ⅱ和Ⅳ是Zn2+依赖性的,又被称为经典的HDACs,它们的催化活性区域均由位于表面的氨基酸残基、一个具有一定长度的疏水性通道和位于底端的锌离子三个部分组成。而sirtuins则是依赖NAD+来发挥催化活性的。如Figure1所示,组蛋白乙酰化水平与细胞分化、细胞周期阻滞、肿瘤免疫、受损细胞凋亡等有关的蛋白的表达息息相关【4】。这些因素都会诱导癌症的发展。
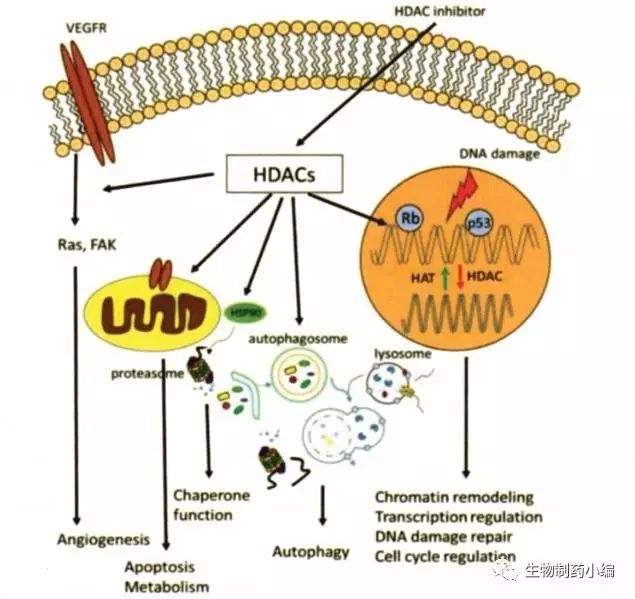
Figure1. Biological functions of HDACs
近年来HDACs与癌症产生的关系越来越清晰,HDACIs也成为各大药厂开发抗肿瘤新药的热门靶点。目前FDA已经批准上市四个HDACIs抑制剂:Vorinostat(SAHA)、Romidepsin (FK228)、Belinostat(PXD-101)和Panobinostat (LBH-589)。它们都是多种组蛋白去乙酰化酶抑制剂(pan-HDACinhibotors),主要用于T细胞淋巴瘤和骨髓瘤的治疗,尚无批准任何实体瘤适应症。同时,由于pan-HDACinhibotors使蛋白质乙酰化会带来非常巨大的影响,从而导致许多不良反应的产生,另外这些药物还有严重的心脏毒性(如Romidepsin曾导致5例病人心脏骤停),因此,制造高选择性的抑制剂是未来该靶点的新研究方向。
在HDACs成员中HDAC6是非常特殊的,它并不定位在细胞核中,而是主要在细胞质中。如Figure2所示,HDAC6是由1215 组成的分子量约为131kDa的蛋白质,结构上含有两个用于定位于细胞质的核输出信号(nuclearexport signals,NES); Ser-Glu-containingtetrapeptide (SE14) 基团;位于N端的核定位信号(nuclearlocalization signal,NLS)帮助酶穿梭于核与细胞质之间;两个同源的催化域(DD1,DD2)对底物蛋白进行去乙酰化;另外还含有肌动蛋白结合域(DMB)和C端具有非酶功能的泛素结合的锌指结构域(ZnF-UBP)【5】。
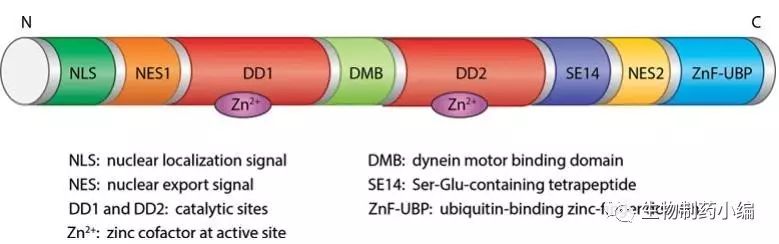
Figure 2. Structure of HDAC6
就催化结构域而言,HDAC6与其他HDAC家族成员也有非常特殊的区别。AlanP. Kozikowski课题组通过分析目前获得的HDACs氨基酸序列(同源的)应用I-TASSER技术预测了HDAC1和HDAC6的酶活性位点结构(Figure3)。发现HDAC6(右图)较HDAC1的催化“口袋”更宽。这点也被很多HDAC6选择性抑制剂所证实。
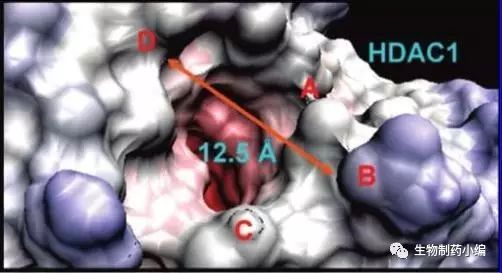
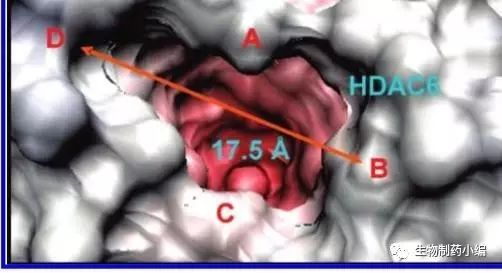
Figure 3. Top-down viewof active site of HDAC1 and HDAC6
从功能方面而言,由于HDAC6主要存在于细胞质中,很容易想到的就是它的识别底物应该是细胞质蛋白。第一个被研究清楚的底物是α-tubulin,被其催化中心DD2所识别,催化α-tubulin上赖氨酸40残基去乙酰化。截止目前,HDAC6已经有包括热休克蛋白(HSP90)、氧化还原调节蛋白peroxiredoxin在内的107种细胞质蛋白底物家族。另外,HDAC6不仅能去乙酰细胞质蛋白,还能作用于一系列转录调节子(RUNX2、NF-kB等)从而影响基因转录。
众所周知,细胞发挥正常的生物学功能需要各种蛋白拥有正常三维折叠。然而,事实上大约超过30%的蛋白质不能正确折叠,病变状态就更多了。一旦产生错误折叠的蛋白就需要尽快处置,否则将影响细胞正常功能。一般情况下,这些“坏”蛋白会被打上泛素(ubiquitin)标记,进而被26S蛋白酶体(proteasome)识别,降解成小分子多肽和氨基酸,作为氨基酸源重新被利用。
但是,在某些神经退行性疾病如阿尔茨海默病、帕金森疾病、肌萎缩侧索硬化和多谷氨酰胺疾病中,错误折叠的蛋白超过了蛋白酶体的处置能力,导致“坏”蛋白在细胞内积蓄,在核周围的中心体(centrosome)上形成聚集体(aggresomes),结果导致细胞代谢和物质转运受阻。通常,这些聚集体通过溶酶体降解途径转运到自噬体(autophagosomes),然后与溶酶体融合进而被降解。
分子生物学研究揭示,HDAC6上C-端的ZnF-UBP结构域能识别泛素化蛋白,其肌动蛋白结合域与dynein结合,利用ATP将这些蛋白通过微管向核周围输送,积累形成aggresomes,HDAC6同时招募和去乙酰化皮层肌动蛋白结合蛋白(cortactin),促使autophagosome–lysosome融合,进而通过溶酶体途径处理这些错误折叠蛋白(Figure 4)。
另外,正常情况下,HDAC6与HSP90-HSF1复合物结合成三聚体,使HSF1处于无活性状态。一旦机体检测到泛素化聚集体,HDAC6解离下来,诱导HSF1转录因子的释放和活化,依次激活应答的HSP基因,导致主要的分子伴侣HSP70和HSP27聚集, HSP降低错误折叠蛋白的毒性,增加细胞内分子伴侣的表达,使蛋白分解或者再折叠转运至蛋白酶体被降解。
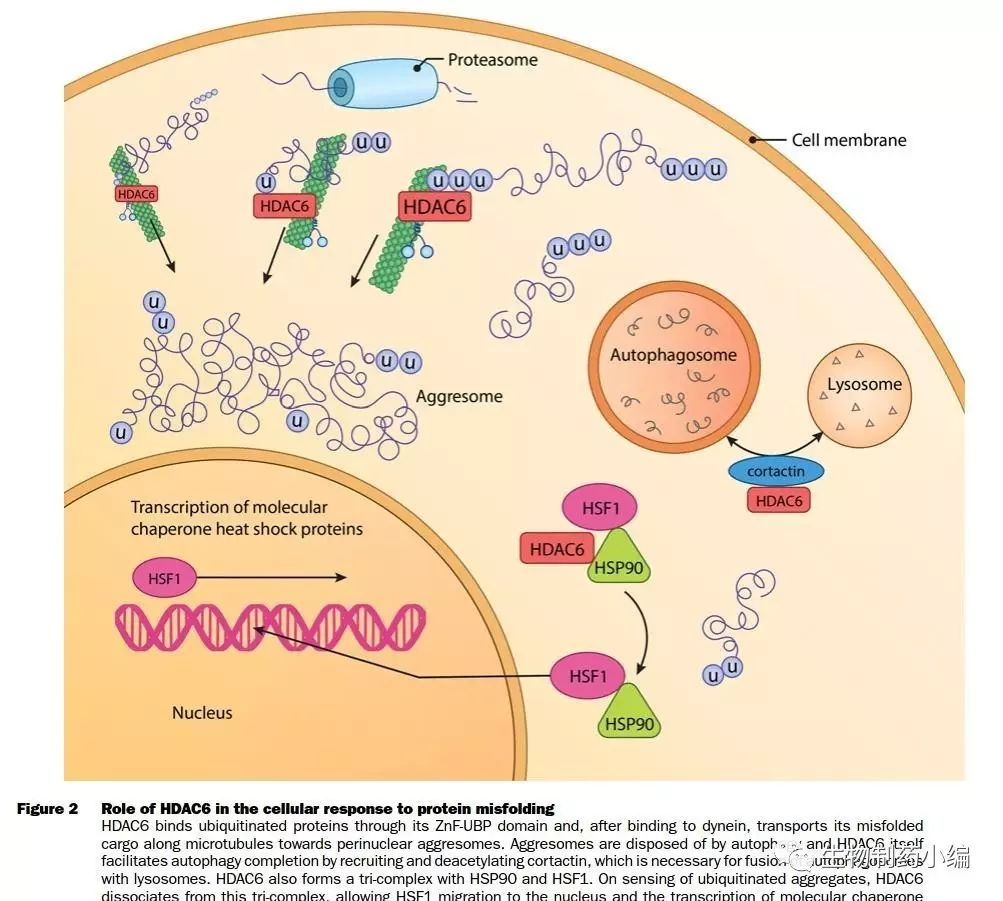
Figure 4. Roleof HDAC6 in the cellular response to protein misfolding
5.1、HDAC6与神经退行性疾病
现在已经探明,帕金森氏病(Parkinson's Disease, PD),阿尔莫兹海默症(Alzheimer’s disease,AD)、Huntington舞蹈病和腓骨肌萎缩症(Charcot–Marie–Tooth)这些神经退行性疾病的进展都与HDAC6密切相关。
例如,帕金森氏病是因为脑黑质多巴胺(dopamine, DA)能神经元的变性死亡导致的神经退行性疾病,以病人脑中出现称为路易氏体(Lewybody)的包涵体为病理学标志。研究人员在果蝇PD模型中把HDAC6基因进行缺失突变之后,PD症状包括多巴胺神经元死亡、视网膜退变和运动障碍都显著加重。同时标志性的包涵体由于HDAC6的缺失而显著减少,可溶性的寡聚体却明显增多,揭示了HDAC6与PD进展息息相关。
再者,阿尔莫兹海默症也是危害性非常大的神经退行性疾病,以神经元纤维缠结形成为病理学标志。神经元纤维缠结由过度磷酸化的微管相关蛋白——tau蛋白组成。正常脑中tau蛋白只有2-3个磷酸基,而PD患者脑的tau蛋白则异常过度磷酸化,每分子Tau蛋白可含5~9个磷酸基,阻止其与微管蛋白结合促进其聚合形成微管,丧失正常生物功能。这种过度磷酸化和积累形成聚集体也与HDAC6上微管结合域SE14关系密切。
5.2、HDAC6与肿瘤
尽管HDAC6与神经退行性疾病直接相关,但目前HDAC6抑制剂主要还是用于治疗恶性肿瘤。我们已经知道,细胞处理错误折叠蛋白有两条途径:泛素-蛋白酶体途径和聚集体-自噬体途径。由于肿瘤细胞异常活化,产生的“坏”蛋白更甚于正常细胞,其HDAC6是过度表达的,才能保证这些“坏”蛋白及时被降解,肿瘤细胞才能得以存活。因此HDAC6抑制剂通常联合蛋白酶体抑制剂才能有效的发挥阻止癌细胞增殖分化。
那么HDAC6过表达是如何影响肿瘤进展的呢?第一,研究发现HDAC6通过活化磷脂酰肌醇3激酶(PI3K)和丝裂原活化蛋白激酶通路(MAPK),使HDAC6膦酸化,进而通过去乙酰化α-微管蛋白促进肿瘤细胞迁移【7】。第二,肿瘤细胞过度表达HDAC6,提高α-微管蛋白去乙酰化水平,引起泛素化蛋白聚集体形成,并且通过去乙酰化激活皮动蛋白,促进自噬体与溶酶体融合,有效清除错误折叠蛋白,导致肿瘤细胞存活。第三,HDAC6通过与应激颗粒蛋白肿瘤迁移中(stressgranule protein)相互作用,稳定应激颗粒,隔绝细胞凋亡调节蛋白,使肿瘤细胞生存。另外,当然还有HDAC6通过参与其他多种信号通路(如Wnt-β-catenin pathway)调节基因转录、肿瘤迁移等。
尽管HDAC与肿瘤和神经退行性疾病都有关联,但正如前文所述,由于很窄的治疗窗和多副作用使得pan-HDAC抑制剂或classⅠ抑制剂目前仅限于治疗肿瘤(主要是血液瘤)。因此,如何提高治疗窗和拓展适应症促进了HDAC6抑制剂的研发。
Table 1. Selective list of HDAC6 inhibitors
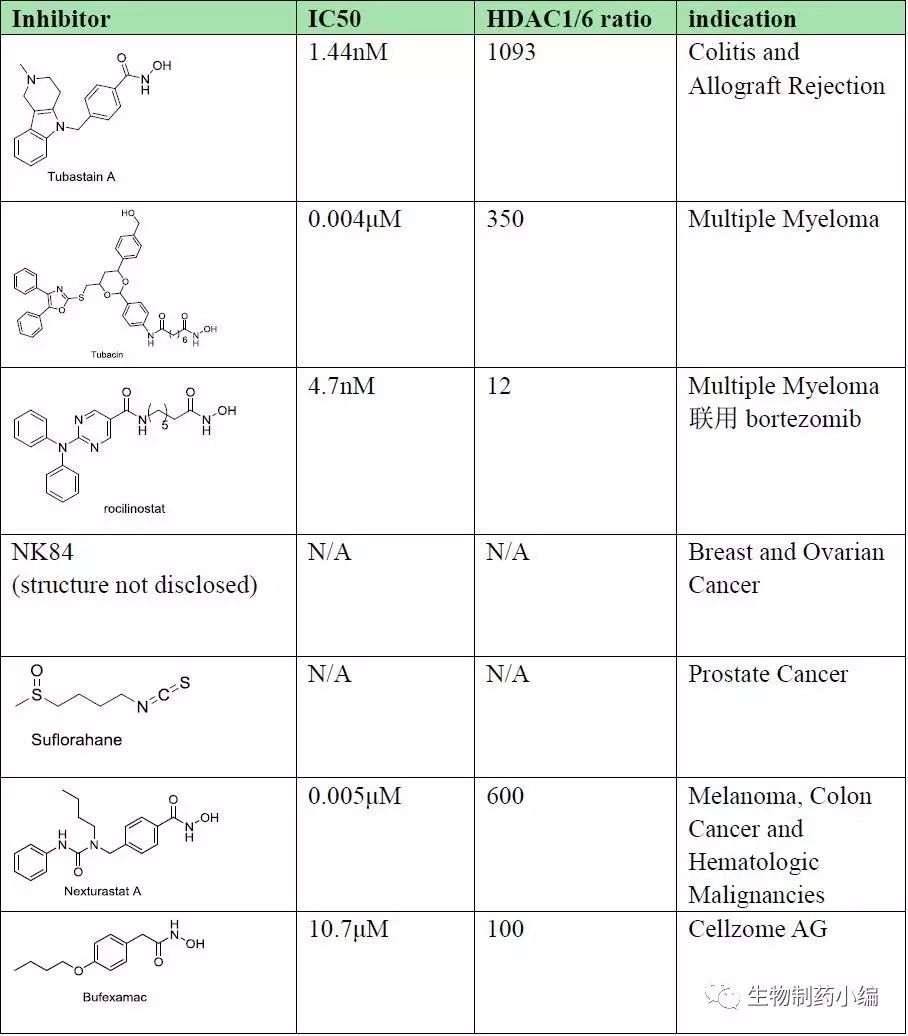
从上表(Table1)中可以看出,1)HDAC6抑制剂适应症覆盖了从肿瘤到自身免疫性疾病再到神经退行性疾病领域,这与其在生物体中较宽泛的功能相关;2)含羟肟酸的HDAC6高选择性抑制剂相对HDAC1抑制剂而言基本都含有一个较大且刚性的“Cap”基团,这与Figure3所示的两种酶活性位点模型对比一致。因此,应用基于结构的药物设计理念,可以给后续研究者开发HDAC6高选择性抑制剂带来有益提示。
【1】Crick, F, Nature, 1970, 227, 561–563.
【2】GersheyEL,Vidali G,AllfreyVG.J.Biol.Chem.1968, 243, 5018-5022.
【3】Bameda-ZahoneroB,ParraM.Mol.2012, 6, 579-589.
【4】 Li, Z; Zhu, WG. J. Biol Sci. 2014,10, 757-770.
【5】Sri N. Batchu, Angela S. Brijmohan and Andrew Advani. Clinical Science. 2016 130,987–1003.
【6】Alan P. Kozikowski et. J. AM. CHEM. SOC. 2010, 132,10842–10846.
【7】Williams KA, Zhang M. J.Biol.Chem. 2013, 288, 33156-33170.
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:[email protected]

版权为生物制药小编所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。

坚持原创、坚持专业
欢迎关注生物制药小编
投稿信箱:[email protected]
小编团队现有13位成员:
Armstrong、医药局外人、Fairy、Jone、
东胜西牛、Alpharesearcher、MT、百草、
Irene、北望、蛋白工人、At.Zhou、Julia
欢迎有共同兴趣的朋友加入















