Aicardi-Goutieres综合征(AGS)是一种罕见但致命的遗传性自身免疫性疾病。由加州大学圣地亚哥分校(UCSD)领导的一个国际研究小组近期发现了这种疾病不为所知的潜在遗传机制,并利用人工构建的人类干细胞疾病模型发现了抑制疾病进程的已知药物。文章发表在8月10日的《Cell Stem Cell》杂志。
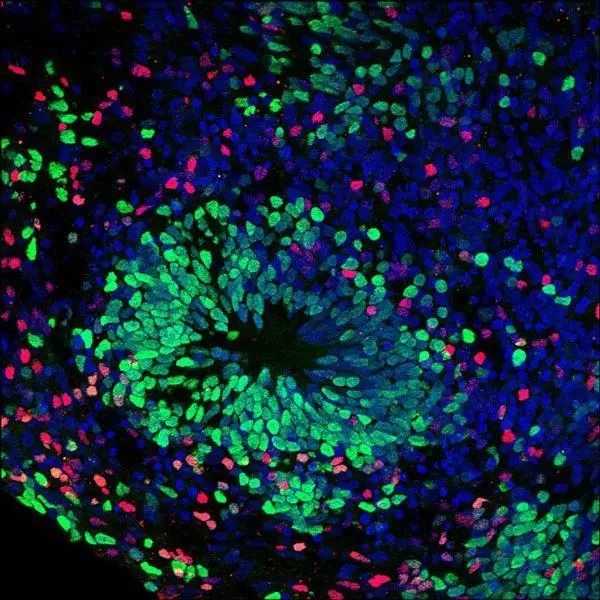
由神经元细胞组成的类器官
两种FDA批准药物在检测过程中表现出众,成功拯救了受AGS影响的神经类器官。这一发现不仅具有临床应用价值,在基础科研层面,它预示着没有其他模型可用时,人们可以创建新型以干细胞为基础的疾病模型。
UCSD医学院儿科和细胞分子医学系干细胞再生医学项目主任Alysson
Muotri博士说:“我们的方法可拓广至其他神经系统疾病研究,如自闭症、精神分裂症、自身免疫性疾病等其他类似的功能障碍。”
AGS的临床特征包括炎症标志物和其他炎症反应增加,类似于婴儿在子宫内获得的出生前病毒感染,但是,Muotri说AGS与外源病原体之间没有联系。早期研究表明,对细胞免疫反应调节来说,AGS患者缺少正常的关键核酸代谢基因,其中一种有助于防止DNA异常积聚的TREX1酶生产不足。
AGS发病机制的深入研究开展一直十分困难。因为动物模型无法准确地模拟这种人类疾病。所以Muotri和同事们决定用胚胎干细胞(ES细胞)和来自患者身上的诱导多能干细胞(iPS细胞)创建AGS细胞模型。过去几年中,Muotri实验室已开发过类似的“培养皿疾病模型”,如自闭症、神经性厌食症、威廉姆斯综合征等其他罕见神经元疾病模型。(他们也曾用iPS细胞创造过“类大脑”,或称迷你大脑,大量神经元簇自我组织成类似人类大脑皮层的皮质结构。)
研究人员发现,TREX1功能不正常后所有细胞模型都出现了多余的染色体外DNA,它们主要来自LINE1
(L1)逆转录因子。L1s是一类重复DNA序列,可在人类基因组中自发地“复制-粘贴”自己,在过去它们被称为“垃圾基因”,它们在细胞内的功能很大程度上仍然未知。
2005年,Muotri和同事曾报道,L1s对脑细胞的冲击力比其他组织细胞更高,暗示了L1s在脑部发育中的潜在关键角色。
此后,全世界的研究人员通过在脑遗传嵌合体中研究L1s的真正角色。“当绝大多数研究工作都在围绕这个基因嵌合性的影响时,我们决定跳出细胞核。于是,我们就有了这个令人惊喜的发现。”
在Muotri实验室创造的一些AGS细胞模型中,多余DNA产生了毒素。另一些模型表现出了异常的免疫反应,分泌毒素让其他细胞死亡。“综合了这些影响的类器官的神经元生长急剧减少,这些模型似乎是胎儿发育时期的AGS发病进展的一面镜子,在本应进行神经发育的阶段,细胞出现死亡和减少,”Muotri说。
因细胞核外的L1分子引起的抗病毒反应,触发了细胞死亡。相反,敲低L1基因后可以显著降低对细胞的毒性(研究中所用的shRNA慢病毒载体与病毒包装由赛业生物提供)“这是一个新的基本机制,对L1元件的慢性反应负面影响了人类神经系统发育,”前Muotri实验室研究生、文章一作Charles
Thomas说。“这种机制似乎是人类特有的,我们在老鼠身上看不到这个。
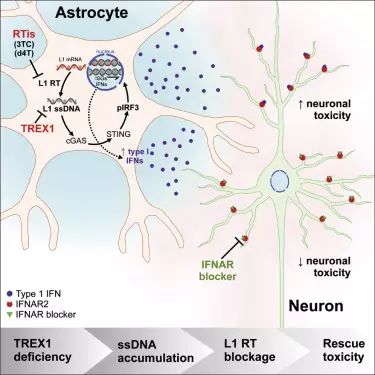
由于研究人员观察到的AGS发病特征与逆转录病毒感染相似,于是他们想看看现有的抗HIV逆转录病毒药物是否能影响L1复制。
他们选取了两种药物:Stavudine和Lamivudine。两种药能都减少L1水平和细胞毒性。构成类器官的各种复杂神经细胞群又因细胞模型得以生长而重焕生机。
根据这一实验结果,HIV药物或可使AGS患者受益。由本文共同作者曼切斯特大学Yanick Crow博士领导的一项临床试验正准备在欧洲开展。
这项实验结果为神经炎症和药物发现研究平台提供了启发和动力。“更重要的是,虽然本研究工作集中于AGS,但事实上,精神分裂症患者神经细胞中也显示出L1元素过多,并且与其他自身免疫性疾病研究也有重叠,”Muotri说。
基础研究如何迅速转化为临床?其他疾病中也有类似机制吗?这种建模策略是否有助于更好地理解和解决疾病?这些问题是本文留给我们的思考。
原文标题
Modeling of TREX1-Dependent Autoimmune Disease using Human Stem Cells Highlights L1 Accumulation as a Source of Neuroinflammation














