本文转自生物探索
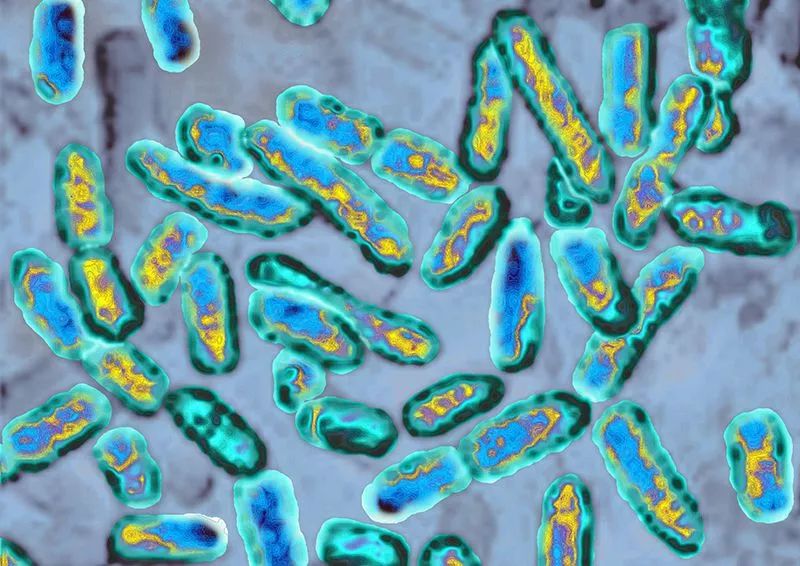
铜绿假单胞菌可导致褥疮等伤口的持续感染。图片来源:James Cavallini/Science Photo Library
这些
病毒本不应该影响人类,它们被认为是在细菌内部行驶,只是利用另一种微生物的不引人注目的“搭便车者”。
然而, 斯坦福大学的免疫学家和传染病专家Paul Bollyky博士和他的同事们三四年前在实验室看到的不是这样。这些病毒似乎正在改变人类免疫细胞的行为——白细胞没有像往常那样吞噬细菌,而是呆在那里。

DOI: 10.1126/science.aat9691
现在,随着近日《Science》杂志上一篇论文的发表,这一始于偶然观察的发现开启了一扇通往感染内部情况的大门。在感染内部中,病毒与细菌联手,通过提供诱饵来欺骗免疫系统。Bollyky将其描述为有人触发了虚假火警,这样团队的其他成员就可以在随后的混乱中成功实施抢劫。
这种被称为噬菌体的病毒会感染铜绿假单胞菌(Pseudomonas aeruginosa),而铜绿假单胞菌常常会对抗生素治疗产生抗药性。
噬菌体促使免疫系统去攻击它自己,而不是它的微生物宿主。这种细菌和噬菌体称为Pf,它们以一种共生关系存在,科学家们怀疑这种共生关系在微生物界的分布比之前认为的更为普遍。这一发现可能有助于解释为什么免疫系统能容忍有益的细菌,比如肠道内的细菌,并可能带来更好的感染治疗。
尽管一些噬菌体会杀死它们的细菌宿主,但有另一些噬菌体在微生物体内快乐地生活,并没有杀死宿主。长期以来,研究人员一直怀疑这种共存意味着病毒在某种程度上对细菌有利。
为了研究噬菌体是否会影响细菌与宿主的相互作用,Paul Bollyky收集了111人的慢性伤口(如受感染的烧伤)拭子。其中37处伤口感染了铜绿假单胞菌。
研究人员发现,68%的铜绿假单胞菌感染含有Pf病毒。当Bollyky和他的同事们将这些噬菌体感染的细菌转移到小鼠的开放性伤口时, 他们发现携带噬菌体的微生物和不携带噬菌体的微生物之间存在很大的差异:当它们体内含有病毒时,引起感染的细菌明显减少。换句话说,假单胞菌需要噬菌体的帮助才能有效感染。
这种细菌吸引了一种叫做吞噬细胞的免疫细胞,吞噬细胞以细菌为食,但会避开病毒。当吞噬细胞攻击感染了铜绿假单胞菌和Pf的伤口时,它们只吃了一些细菌,很快就离开了。吞噬细胞吞噬受感染的细菌,然后发出信号,吸引只攻击病毒的免疫细胞进入该区域。
研究小组在用细菌病毒组合感染小鼠之前,先给小鼠注射Pf疫苗,从而减少铜绿假单胞菌感染。
研究人员认为,噬菌体通过制造双链RNA来模拟人类病毒,从而引发免疫系统的攻击。Bollyky认为,类似的机制可以部分解释为什么免疫系统能容忍生活在我们体内的正常有益细菌。
参考资料:
Sweere JM, Van Belleghem JD, Ishak H, Bach MS, Popescu M, Sunkari V, Kaber G, Manasherob R, Suh GA, Cao X, de Vries CR, Lam DN, Marshall PL, Birukova M, Katznelson E, Lazzareschi DV, Balaji S, Keswani SG, Hawn TR, Secor PR, Bollyky PL. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science. 2019 Mar 29;363(6434). pii: eaat9691. doi: 10.1126/science.aat9691.
以上转自生物探索
Abstract
Bacteriophage are abundant at sites of bacterial infection, but their effects on mammalian hosts are unclear. We have identified pathogenic roles for filamentous Pf bacteriophage produced by Pseudomonas aeruginosa (Pa) in suppression of immunity against bacterial infection. Pf promote Pa wound infection in mice and are associated with chronic human Pa wound infections. Murine and human leukocytes endocytose Pf, and internalization of this single-stranded DNA virus results in phage RNA production. This triggers Toll-like receptor 3 (TLR3)- and TIR domain-containing adapter-inducing interferon-β (TRIF)-dependent type I interferon production, inhibition of tumor necrosis factor (TNF), and the suppression of phagocytosis. Conversely, immunization of mice against Pf prevents Pa wound infection. Thus, Pf triggers maladaptive innate viral pattern-recognition responses, which impair bacterial clearance. Vaccination against phage virions represents a potential strategy to prevent bacterial infection.