如今,胰腺癌现已经成为全球第七大致死性癌症,患者五年的存活率不到5%。尽管临床医学的发展使很多癌症已经成为了一种可控甚至治愈的疾病,但非常遗憾的是,胰腺癌恰恰是科学家尚未攻克的癌症之一,该病从预防、诊断、治疗到预后效果并不不理想,随着人群生活水平的提高及饮食结构的改变,近年来胰腺癌的发病率呈现上升且年轻化的趋势。今天,我们对目前国内外最新的胰腺癌治疗方法及相关方面进行整理汇编,与大家一起交流学习。
1.
Nature:重大突破!利用靶向KRAS突变基因的外泌体治疗胰腺癌
doi:10.1038/nature22341
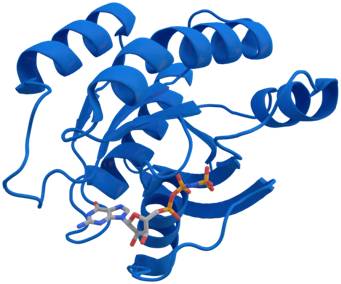
KRAS蛋白晶体结构,图片来自Thomas Splettstoesser/Wikipedia。
外泌体(exosome)是所有细胞释放出的病毒大小的颗粒。它们天然地存在于血液中。根据来自美国德州大学MD安德森癌症中心的一项新的研究,对外泌体进行基因操纵可能提供一种新的胰腺癌治疗方法。相关研究结果于2017年6月7日在线发表在Nature期刊上,论文标题为“Exosomes facilitatetherapeutic targeting of oncogenic KRAS in pancreatic cancer”。论文通信作者为德州大学MD安德森癌症中心癌症生物学系研究员Raghu Kalluri博士。
在这项新的研究中,经过基因修饰的外泌体(被称作iExosome)能够运送特异性地靶向KRAS突变基因的小RNA分子,从而导致胰腺癌模式小鼠病情缓解,增加它们的总存活率。这些研究人员采用了一种被称作RNA干扰(RNAi)的靶向方法:利用这些天然的纳米颗粒(即外泌体)运送小干扰RNA(siRNA)或短发夹RNA(shRNA)分子来靶向胰腺癌细胞中的KRAS突变基因,从而影响多种胰腺癌模型的肿瘤负荷和存活。他们证实外泌体能够作为一种高效的RNAi载体发挥作用,这是因为这些纳米大小的囊泡(即外泌体)轻松地在体内迁移和进入靶细胞(包括癌细胞)中。
作为一种分子通断开关的KRAS发生突变时会处于“开启”状态。在80%~95%的胰腺导管腺癌(PDAC)当中,这个基因发生突变,这也是这种癌症中最为常见的突变。这些研究人员证实iExosome能够运送特异性地靶向KRAS的siRNA和shRNA分子,并且比他们的合成对应物脂质体(liposome)更加高效。脂质体不具有外泌体表现出的天然复杂性和优势。
德州大学MD安德森癌症中心癌症生物学助理教授ValerieLeBleu博士说,“我们的研究提示着与脂质体相比,外泌体表现出运送siRNA分子和抑制侵袭性胰腺瘤生长的优异能力。我们也证实外泌体表面上的CD47存在允许它们躲避来自循环单核细胞的吞噬作用。”
这些研究人员也证实一种被称作巨胞饮(macropinocytosis)的细胞过程促进发生KRAS基因突变的癌细胞摄取外泌体。巨胞饮参与细胞清除营养物和囊泡。
Kamerkar说,“与之前的发现相一致的,由于增加的巨胞饮过程,达到胰腺的外泌体数量增加可能为外泌体进入KRAS相关的癌细胞提供进一步的优势。尽管胰腺瘤存在致密的基质,我们的结果也支持癌细胞高效地摄取iExosome。还需开展进一步的研究以便更好地理解通过巨胞饮进入细胞中的外泌体是否具有其他的可能增强它们的抗肿瘤能力的特征。”
2. Sci Trans Med:胰腺癌血液检测初见成效
doi:10.1126/scitranslmed.aal3226
科学家们最近发现了一类新的鉴定胰腺癌的血液检测技术,这一技术能够帮助早期诊断的进一步提前。
胰腺癌是一类致命的肿瘤类型,而究其原因,是由于检测与治疗往往不够及时。这项仍在试验阶段的技术是通过对胰腺肿瘤分泌的特有蛋白质进行检测而诊断肿瘤的发生,这一技术相比目前仍在使用的"CA19-9"技术间更加准确。
该研究的共同作者之一Cesar Castro博士称CA19-9疗法十分不完美。具体来说,CA 19-9只有在胰腺癌晚期才会有所上升,而此时的诊断结果对于治疗没有实际的帮助。此外,被检测蛋白也并非特异性存在于癌细胞中,当胰腺处于炎症反应阶段,或者胆囊阻塞的时候也会有所表达。根据Castro的说法,CA19-9技术在胰腺癌患者的治疗过程中追踪疾病的恶化情况或许有用处,但作为诊断标志物来说则十分不合格。
来自纪念凯瑟琳斯隆癌症中心的胰腺癌专家Peter Kingham.博士认为该新型的血液诊断技术相比CA19-9有了长足的进步。但是,这一研究结果还需要在更多患者群体中进行验证。
该检测手段是通过芯片技术对癌细胞分泌到血液中的胞外小体(EV)进行检测。正常细胞与癌细胞都能够分泌EV,但Castro研究组发现其中包含的5类蛋白质是很好的胰腺癌的生物标记。在其中一项研究中,研究者们发现该检测技术的检测准确率能够达到86%,特异性也能够达到81%.
3.
OncoImmunology:胰腺癌细胞附近的免疫细胞或可“助纣为虐”促进癌症扩散
doi:10.1080/2162402X.2016.1191731

图片摘自:A*STAR SingaporeImmunology Network
日前,一项刊登在国际杂志OncoImmunology上的研究报告中,来自A*STAR研究所的研究人员就通过研究提出了证据表明,胰腺肿瘤能够改变巨噬细胞的代谢,而巨噬细胞被认为是真空吸尘器,其能够捕捉并且消化微生物和细胞残渣;研究者还发现,发生代谢改变的巨噬细胞还会参与癌症的扩散,而且通过修饰巨噬细胞代谢的疗法或许能够帮助胰腺癌干细胞扩散。
肿瘤细胞能够表现出不同于健康细胞的代谢特性,尤其是其会有限通过糖酵解的过程来通过葡萄糖产生能量,尤其是在富含氧气的情况下;但本文中研究者Siew Cheng Wong推测,肿瘤或许还会改变附近巨噬细胞的代谢特性。为了检测这种推测,研究人员利用衍生自正常胰腺细胞或癌变细胞的培养物来产生人类的巨噬细胞,结果研究者发现,利用衍生自癌细胞的培养物所生长的巨噬细胞能够表现出不同的代谢特性,此外,这些巨噬细胞还能够促进血管生长以及癌细胞像远端器官的转移和建立,这往往是癌症扩散的标志。
研究者Wong指出,这项研究中我们首次发现了在癌症中巨噬细胞葡萄糖代谢通路会受到一定影响;本文研究或许为我们阐明胰腺癌扩散的分子机制提供了一定线索,同时还能够帮助医生通过重新调节巨噬细胞的代谢至原始状态来有效遏制癌症发展。巨噬细胞一种具有高度可塑性的细胞,研究者发现,通过开启代谢特性来对巨噬细胞进行重编程就能够逆转巨噬细胞的特性促进癌症的扩散。
4. Nat Genet:启动子突变也会影响胰腺癌发生
doi:10.1038/ng.3861
在一项发表在国际学术期刊Nature Genetics上的研究中,来自冷泉港实验室的一支研究团队对癌细胞中除外显子之外其余98%的DNA进行了研究。他们收集了308名胰腺癌病人样本,并且胰腺癌细胞的整个基因组都得到了测序。研究人员将他们的研究重点缩小到基因的启动子,由于启动子位于它们调控的基因附近,并不在基因内部,因此在进行外显子测序时,启动子是不可见的。
研究人员表示,启动子在决定基因开启和关闭方面有重要作用,他们对于启动子突变是否能够影响癌症发育以及癌细胞自身维持特别感兴趣。但是研究表明启动子突变并没有发生在胰腺癌中经常发生突变的一些基因附近。比如KRAS和p53在大多数胰腺癌细胞中都存在突变,研究人员利用新的计算方法在这些基因之外的其他启动子区域发现了一些突变可能参与胰腺癌。
研究人员指出启动子发生突变能够影响蛋白表达量。这种方式与KRAS和p53等基因发生突变所产生的影响不同,这些基因通常会损伤或改变它们编码的蛋白的功能。虽然启动子突变并没有发生在已知的胰腺癌相关基因附近,但是研究人员发现启动子突变仍然影响了一些相同信号途径,多数突变会影响参与细胞黏附和轴突导向的一些基因。
5. Nat Med:胰腺癌细胞如何“耍诡计”逃脱机体免疫系统的攻击?
doi:10.1038/nm.4314
日前,来自纽约大学医学中心和Perlmutter癌症研究中心的研究人员通过研究发现了一种新型关键通路,胰腺癌细胞能够利用该通路关闭攻击癌细胞的免疫系统的功能,相关研究刊登于国际杂志Nature Medicine上。
这项研究中,研究人员对小鼠进行了研究并对人类癌症进行了分析,结果发现,胰腺肿瘤中dectin-1和galectin-9两种蛋白的水平较高,这两种蛋白相互作用能够抑制巨噬细胞产生杀灭癌细胞的反应,对癌症患者进行相关分析结果表明,galectin-9蛋白水平较高或会降低胰腺导管腺癌(PDA)患者的生存率,后期研究者还需要进行更为深入的研究。
研究者利用PDA小鼠模型进行研究,PDA患者通常在诊断后的五年内就会因癌症而死亡;研究人员将携带能够制造dectin-1的癌细胞的小鼠同无法制造该蛋白的胰腺癌小鼠进行对比,结果发现,无法制造dectin-1蛋白的小鼠反而会活得更久一些,同时研究者还发现,利用阻断dectin-1和galectin-9相互作用的抗体来治疗胰腺癌小鼠或许就能够明显降低小鼠机体中肿瘤的尺寸并且增加小鼠的生存率。胰腺癌是一种致死性癌症,因为其能够对附近的免疫细胞进行编程来促进肿瘤生存和生长。这项研究中,研究者阐明了此前未知的一种机制,因此他们就能够利用这种机制来抑制肿瘤不断进展。
6. Nat Cell Biol:胰腺癌为何难以治疗?
doi:10.1038/ncb3513
胰腺癌是世界上最严重的肿瘤类型之一,原因在于其恶化的速度十分快。然而,对这种类型癌症的诊断却往往不及时,这导致了患者很高的死亡率。最近,来自来自FAU的研究者们发现了胰腺癌与其它恶性的肿瘤扩散速度很快的原因,这一结果发表在最近的《NatureCell Biology》杂志上。
来自FAU的Thomas Brabletz博士与Marc Stemmler博士领导的研究者们发现胰腺癌细胞能够激活一种在胚胎发育过程中其关键作用的因子,这种因子叫做Zeb1,它能够调节细胞的迁移以及在早期胚胎分化过程中的存活。在正常的,完全成熟的细胞中Zeb1的表达是受到抑制的,然而,在肿瘤细胞中Zeb1的表达又重新得到了激活,并产生了致命的结果。Zeb1的激活导致肿瘤细胞能够在机体中快速扩散并且能够快速地适应新环境。这些特性进一步导致胰腺癌能够在多个部位形成肿瘤病灶,即肿瘤发生了恶化现象。
不过,如果Zeb1的表达没有得到激活,那么癌细胞将不再能够轻易地适应新的环境。这将导致胰腺癌的恶化特性得到明显的降低。事实上,这种机制在其它类型的肿瘤,例如恶性的乳腺癌细胞中也能够看到。因此,研究者们希望这些发现能够帮助他们设计新的治疗方法,例如靶向Zeb1的药物或者其它的方法导致Zeb1的失活以及胰腺癌细胞扩散能力的下降,最终有效抑制胰腺癌以及其它类型的恶性肿瘤的扩散现象。
7. Autophagy:重大突破!利用MIR506诱导胰腺癌细胞死亡
doi:10.1080/15548627.2017.1280217

胰腺癌,特别是最为常见的胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC),是所有癌症中最为致命性的和最为侵袭性的。不幸的是,除了外科手术之外,还没有有效的疗效,而且外科手术也并不适合很多胰腺癌病人。
如今,为了在分子水平上更好地理解胰腺癌,来自美国威克森林浸会医学中心、德州大学MD安德森癌症中心和中国天津医科大学总医院的研究人员开展一项新的研究,鉴定出一种分子可能成为这种癌症的下一代疗法。相关研究结果发表在2017年4月的Autophagy期刊上,论文标题为“MIR506 induces autophagy-related cell death in pancreatic cancercells by targeting the STAT3 pathway”。
这些研究人员首先观察到相比于正常的胰腺,MIR506水平在胰腺瘤中更低。接下来,他们利用MIR506处理这些实验性的胰腺瘤细胞,以便确定它发挥的功能是否与在卵巢癌和其他的癌症中的一样。他们发现利用MIR506处理胰腺癌细胞会抑制恶性肿瘤细胞生长和导致癌症转移的细胞过程。
更加重要的是,Zhang和他的研究团队首次发现利用MIR506处理胰腺瘤细胞诱导自噬,即一种能够促进癌细胞死亡的过程,而且MIR506是通过直接靶向STAT3-BCL2-BECN1轴来诱导自噬的。
8.Science子刊:新策略连环出击抵抗胰腺癌
doi:10.1126/scitranslmed.aai8504
在一项新的研究中,澳大利亚研究人员揭示出一种有前景的治疗胰腺癌的新方法:靶向这种肿瘤周围的组织使得它变得“更加柔软”和对化疗作出更大的反应性。相关研究结果发表在2017年4月5日的Science Translational Medicine期刊上,论文标题为“Transienttissue priming via ROCK inhibition uncouples pancreatic cancer progression,sensitivity to chemotherapy, and metastasis”。
在这项以小鼠和胰腺癌病人样品为实验对象的研究中,这些研究人员利用法舒地尔(Fasudil)三天疗程对胰腺瘤进行预处理(priming)。作为一种药物,法舒地尔让肿瘤周围的组织松弛,从而让肿瘤变得更加柔软,并且也让肿瘤周围的血管泄漏。他们随后利用标准的胰腺癌化疗药物治疗它们。
显著的是,这种连续两步方法让存活时间加倍,而且也会阻止癌症扩散到其他的组织中。
9. JEM:胰腺癌为何如此难以治疗科学家揭示重要原因
doi:10.1084/jem.20162024

最近来自冷泉港实验室的研究人员在深入理解胰腺癌为何难以治疗方面取得重要进展。胰腺癌病人的中位生存期只有6个月,5年生存率只有大约8%,很多病人都是在癌症已经扩散到身体其他部位才得到诊断,并且目前所使用的化疗药物对病人的治疗效果非常微弱甚至无效。
胰腺肿瘤为何会抵抗治疗?其中一个原因就是肿瘤周围存在“疤痕”样组织——基质,这种组织比围绕在其他更易治疗的肿瘤周围的基质组织更加致密。有研究表明基质组织中包含一些能够帮助肿瘤存活和生长的因子,更为重要的是,对于胰腺癌来说,基质组织的密度是导致癌症杀伤药物无法到达肿瘤的一个重要因素。
来自冷泉港实验室的研究人员在国际学术期刊The Journal of ExperimentalMedicine上报道了关于胰腺导管腺癌(PDA)基质组织的一个重要发现。
研究人员曾经开发了一项技术,将人或小鼠的胰腺肿瘤样本培养在三维环境中,获得胰腺类器官,这些小球体能够模拟肿瘤样本的生物学特性可以帮助研究人员了解更多关于肿瘤生物学的信息,检测新的治疗组合。
在这项研究中他们把类器官技术提高到一个新的高度,他们将来自肿瘤样本的类器官与基质组织中的一种细胞成分共培养在一起。他们添加的这种细胞叫做癌症相关成纤维细胞(CAF)。 在这项研究中他们发现一种成纤维细胞亚型会合成更多的αSMA,这些细胞在人类和小鼠肿瘤组织中贴近肿瘤细胞。这一结果也在共培养实验中得到证实,研究人员还发现共培养会导致致密基质组织的形成。
另外一种成纤维细胞亚型能够合成和分泌白介素6(IL-6),这种细胞在人类和小鼠PDA肿瘤中距离癌细胞相对较远。研究表明IL-6与癌细胞增殖以及许多胰腺癌病人出现的恶病质过程有关。
















