撰文 | 陈皮
责编 | 迦溆、兮
图片引自:
https:
//friedreichsataxianews.com/
细胞每天都在经历着不同程度的DNA损伤,应对损伤细胞往往会选择多种途径去修复同一损伤,修复方式的不同选择对基因组维持高保真性具有深远的影响。DNA链间交联是一种具有很强毒性的DNA损伤,细胞代谢产生的醛类物质抑或是外源DNA交联剂,另外例如顺铂
(Cisplatin)
、丝裂霉素
(MMC,Mitomycin-C)
的作用均会产生DNA链间交联,进而阻断DNA的复制、转录和重组。因此,顺铂和丝裂霉素也常用于针对肿瘤细胞的化学疗法
【1】
。
范可尼贫血症
(Fanconi anemia)
是一种罕见的常染色体或X染色体隐性遗传病,其临床表现为进行性骨髓衰竭、恶性血液系统肿瘤等,该疾病的主要特征是患者DNA发生自发断裂以及交联剂诱导后可产生
DNA链间交联
(interstand cross-links, ICL)
现象。经典的DNA链间交联修复途径便据此命名为Fanconi anemia 途径,目前已鉴定出22种“FANC“蛋白参与该途径的调控
【2】
。
在以非洲爪蟾卵提取物构建的非细胞体系中,行进中的复制叉与交联的DNA链相遇能够启动两条不同的修复途径:当复制叉汇聚时,cisplatin-ICL由范可尼贫血症
(Fanconi anemia)
信号通路相关蛋白通过切割环绕链间交联的磷酸二酯主链来产生一个双联断裂缺口,再通过同源重组对损伤进行修复,需要CMG解旋酶复合体从DNA链上卸载
【3】
。当ICL形成于一条链上的碱基位点和另一条链上的腺苷之间时
(AP-ICL and psoralen-ICL)
,
NEIL3
DNA糖苷酶可通过切除形成链间交联的碱基之间的两个N-糖基基团其中一个以破坏交联结构,从而产生了一个脱碱基位点,然后再利用跨损伤修复途径绕开损伤位点
【4】
。

图一. ICLs修复的两种途径
NEIL3途径较Fanconi anemia途径更为简便,并且以往研究发现细胞对NEIL3途径选择的优先级要高于Fanconi anemia途径。鉴于这两种机制具有不同的致突变潜力,了解如何它们之间的调控选择是至关重要。
近日,美国波士顿哈佛医学院Johannes C. Walter组在
Nature
上在线发表题为
TRAIP is a master regulator of DNA interstrand crosslink repair
的研究论文,阐述了E3泛素连接酶TRAIP是已知的两条DNA链间交联损伤修复途径的核心调节蛋白。DNA复制过程中当两个复制体汇聚在同一ICL处时,TRAIP会对
DNA解旋酶复合体
CMG
( CDC45, MCM2-7, GINS )
进行不同程度的泛素化,较短的泛素化链能够通过直接结合的方式招募NEIL3进行切除链间交联,若形成较长的泛素化链,则能作为p97 ATPase募集的信号,让CMG从DNA上卸载然后使修复方式转向Fanconi anemia途径。

结合最近的两篇相关报道,
(Ⅰ.
Larsen, N. B. et al.
Mechanism of replication-coupled DNA-protein crosslink proteolysis by SPRTN and the proteasome
.
Mol. Cell
73, 574–588 (2019). SPRTN和蛋白酶体以相互独立的调节方式促进不同化学性质的DNA-protein crosslink(DPC)降解。DPC的泛素化以及蛋白酶体识别需要TRAIP。Ⅱ.
Deng, L. et al.
Mitotic CDK promotes replisome disassembly, fork breakage, and complex DNA rearrangements
.
Mol. Cell
(in the press).
有丝分裂时,TRAIP促进CMG解旋酶复合体内的MCM7泛素化,促使CMG从停滞的复制叉上卸载,造成复制叉崩塌。)
该研究发现了
TRAIP是CMG复合体去组装及复制体对复制障碍应答的核心调节蛋白。
Johannes C. Walter组一直致力于利用非洲爪蟾卵细胞提取物建立的“cell in a test tube”系统研究DNA复制及损伤修复的调节机制。非洲爪蟾卵细胞提取液能有效地复制添加的DNA模板,通过构建并添加含有损伤的模板,能有效的揭示复制机制如何克服模板链中的DNA损伤
【5】
。在本文中,研究人员依然选用该体系展开一系列研究。
正如前文所言,复制叉的汇聚是两条途径活化的前提,并且只有Fanconi anemia 途径的启动需要CMG的卸载。研究人员以CMG需要被泛素化才能离开DNA链为突破口,试图寻找能在对的时间,对的地点,对CMG进行泛素化的E3连接酶。
RING-E3连接酶TRAIP
(TRAF-结合蛋白)
对细胞增殖尤为重要,TRAIP的亚等位基因突变会导致原始侏儒症。TRAIP能与有ICL的染色质结合,其敲低使细胞对DNA交联剂mitomycin C敏感。基于这些研究,研究人员猜想TRAIP能促进CMG的卸载。因此,研究人员构建了一个位点特异的cisplatin-ICL
(pICLpt)
质粒
(形成的ICL由Fanconi anemia 途径解开)
,将其整合于非洲爪蟾卵细胞提取物体系内,模拟DNA复制。

图二 pICL在无核爪蟾卵细胞提取物系统中复制示意图
(质粒与溶液体系共同孵育后,未活化的MCM2-7双六聚体的募集。添加NPE(核质蛋白提取物)后激活复制起始,活化的CMG组装(绿色),新生链的延长(红线)导致复制叉在ICL位点汇聚)
正常情况下,复制叉会在ICL处汇聚并停止移动,继而形成一个离散的slow-figure-8中间体,在此基础上,CMG的卸载使其转变成“fast-figure-8”。
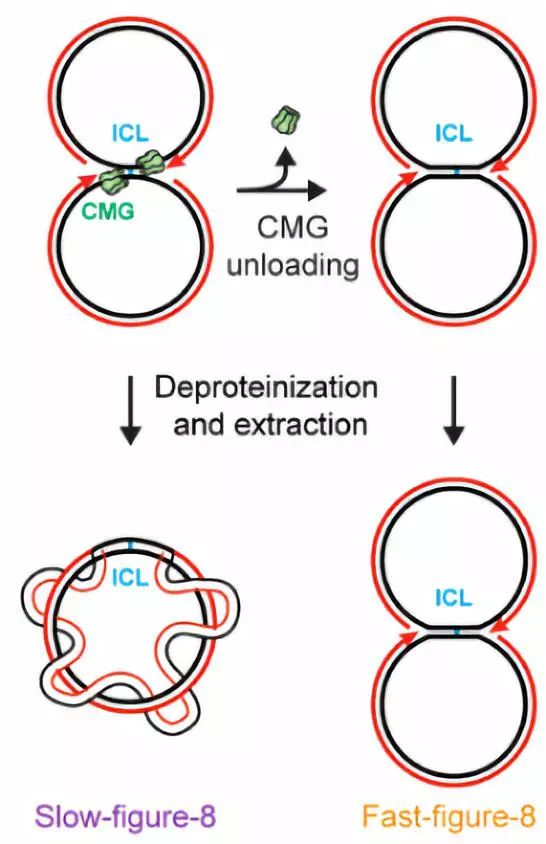
图三 slow-figure-8和fast-figure-8的结构
针对不同DNA结构在琼脂糖凝胶电泳过程中特有的移动特性。研究人员利用天然琼脂糖凝胶电泳对不同样品进行分离,再通过放射自显影法对结果进行分析,发现TRAIP的缺失会导致slow-figure-8结构的聚集,利用p97抑制剂对CMG卸载进行阻滞也会产生同样现象。这些结果表明TRAIP通过泛素化CMG促进其卸载。此外,CDC45和MCM7的解离亦需要TRAIP的参与,并且MCM7的泛素化依赖于TRAIP的结果也支持了上述结论。
因由Fanconi anemia途径介导的复制叉的逆转以及ICL位点的切除均需要CMG成功的卸载,研究人员通过电镜分析及损伤修复系统检测发现TRAIP同样也参与到复制叉逆转和无错损伤修复的过程中。外源构建的RING-domain突变
(破坏E3连接酶活性)
的rTRAIP(R18C)会大大减弱这些能力。
CMG在复制终止时的卸载需要CRL2LRR1对MCM7进行多聚泛素化。与此不同的,ICL修复涉及到依赖于TRAIP的MCM2,MCM3,MCM4,MCM6,MCM7泛素化,以及CDC45的部分泛素化,但不涉及到其他复制体相关蛋白。并且TRAIP可以将泛素链通过异质连接和/或分支连接的方式连接于蛋白上。
那么,在NEIL3 修复途径中,TRAIP是否也发挥着相同的作用?研究人员同样构建了psoralen-ICLs和AP-ICLs质粒
(ICL形成于一条链上的碱基位点和另一条链上的腺苷之间,不依赖于CMG卸载,由NEIL3途径解开)
,通过实验发现,AP-ICLs修复过程也存在MCM7的泛素化,有基于此,对复制过程中的DNA结构变化分析发现,TRAIP的缺失会导致slow-figure-8形DNA的显著增加。这表明TRAIP缺失会明显降低NEIL3途径对AP-ICLs的修复能力。外源回补rTRAIP
(R18C)
则能大部分逆转这些问题,表明AP-ICL修复在泛素化程度较低的水平下就能够进行,并且不依赖于CMG的卸载。
那么,回到最开始的疑问,在非洲爪蟾卵细胞提取物中,AP-ICLs和psoralen-ICLs专门由NEIL3负责进行切除如果NEIL3缺失则由Fanconi anemia途径负责处理,为什么NEIL3途径优先于Fanconi anemia途径呢?研究人员发现,TRAIP泛素化CMG,CMG上的短泛素链足以招募NEIL3对ICL进行修复,如若ICL不能被NEIL3切除,短泛素链便会继续延生形成长泛素链,激活p97依赖的CMG卸载,从而活化Fanconi anemia途径进行修复。但是研究人员对从提取物中得出的NEIL3通路优先型的结论是否在细胞中也适用持保留意见。
总而言之,
上述工作阐明了TRAIP作为与复制体相关的E3连接酶能够调控ICL修复途径的选择,以及对复制过程中阻碍产生应答
。
原文链接:
https:
//www.nature.com/articles/s41586-019-1002-0
制版人:子阳
1. Price, N. E., Catalano, M. J., Liu, S., Wang, Y. & Gates, K. S. Chemical and structural characterization of interstrand cross-links formed between abasic sites and adenine residues in duplex DNA.
Nucleic Acids Res
. 43, 3434–3441 (2015).
2. Kottemann, M. C. & Smogorzewska, A. Fanconi anaemia and the repair of Watson and Crick DNA crosslinks.
Nature
493, 356–363 (2013).
3. Räschle, M. et al. Mechanism of replication-coupled DNA interstrand crosslink repair.
Cell
134, 969–980 (2008).
4. Semlow, D. R., Zhang, J., Budzowska, M., Drohat, A. C. & Walter, J. C. Replicationdependent unhooking of DNA interstrand cross-links by the NEIL3 glycosylase.
Cell
167, 498–511.e14 (2016).
5. Walter, J., Sun, L., and Newport, J. . Regulated chromosomal DNA replication in the absence of a nucleus.
Mol. Cell
1, 519–529 (1998).


BioArt,一心
关注生命科学,只为
分享更多有种、有趣、有料的信息。
关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:
bioartbusiness
或邮箱:
[email protected]
。
原创内容,未经授权,禁止转载到其它平台。





