1型单疱疹病毒
(HSV-1)是一个已经被熟知的基因治疗型病毒载体之一,我们对其疾病发病机制、临床诊断及感染后的治疗处理的研究都比较深入,HSV-1是一款安全性较高的治疗型病毒载体。
2015年,第一款溶瘤疱疹病毒(T-VEC)在被FDA获批上市,近期,又有研究显示溶瘤疱疹病毒和免疫监测点药物(PD1/PD-L1)联合使用可以显著提高肿瘤的治疗效果。因此,
溶瘤疱疹病毒在临床的运用进一步的被拓宽,溶瘤疱疹病毒将是一个充满更多期待的基因治疗载体。
那么,如何更好、更高效的制备、优化和改造HSV-1病毒是行业内要解决的重要问题之一
!
Lauren M. Oldfield 等人在PNAS上发表研究论文,系统的
阐述了
一种通过分片段合成、多片段同时优化改造的方法构建目的溶瘤疱疹病毒
,该方法的显著优点是:
完美的将基因合成技术和酵母重组技术进行融合,
对HSV-1病毒进行快速、复杂的修饰和制备
。
 研究者
选择了HSV-1 KOS病毒株进行实验,将该
病毒株
152kb
的基因组拆分成11个片段,且顺序片段与片段之间含有部分重叠序列,
研究者可以分别同时对11个片段进行相关的修饰和改造,
改造后的质粒共同转入酵母菌中发生重组从而获得完整的HSV-1病毒基因组,再将其转入到
E.coli
宿主细胞中进行DNA扩增,收取DNA转染到哺乳细胞中得到具有感染性质的完整病毒。
这种在酵母中装配基因组的病毒(KOS
YA
),其复制和感染能力与野生型基本一致。
研究者
选择了HSV-1 KOS病毒株进行实验,将该
病毒株
152kb
的基因组拆分成11个片段,且顺序片段与片段之间含有部分重叠序列,
研究者可以分别同时对11个片段进行相关的修饰和改造,
改造后的质粒共同转入酵母菌中发生重组从而获得完整的HSV-1病毒基因组,再将其转入到
E.coli
宿主细胞中进行DNA扩增,收取DNA转染到哺乳细胞中得到具有感染性质的完整病毒。
这种在酵母中装配基因组的病毒(KOS
YA
),其复制和感染能力与野生型基本一致。
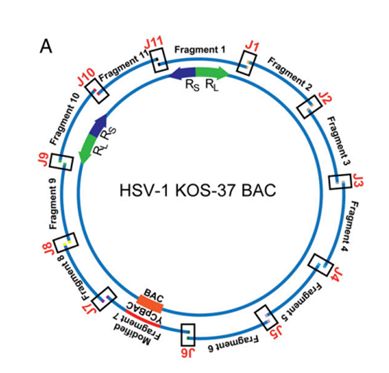
1. HSV-1基因组的装配设计
选择HSV-1属中的KOS序列——KOS-37 BAC(BAC质粒形式存在的KOS基因组克隆),整个基因组分成11个片段,平均每个片段14 kb。每个片段间都有80个碱基对的重叠区域,为之后的酵母菌装配做准备。7号片段中被修饰上BAC及YCp(酵母着丝粒序列质粒),使其在两者中均能复制。装配好的HSV-1基因组标记为KOS
YA
(KOS yeast assembled)
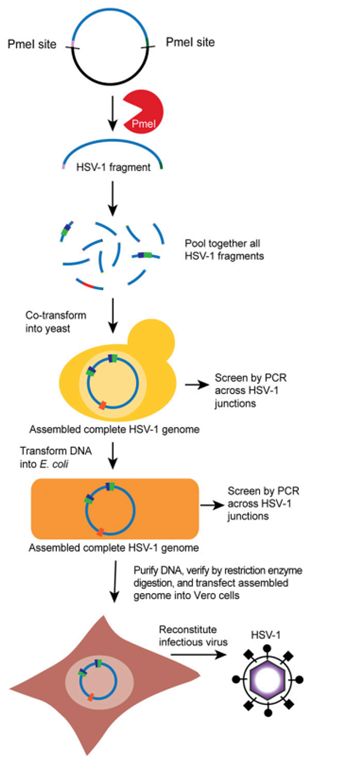
 2. HSV-1片段的TAR克隆
2. HSV-1片段的TAR克隆
通过TAR克隆与cre-loxp技术结合的方式,将11个片段分离收集,每个片段与TAR克隆载体链接,载体上引入PmeI酶切位点(该位点不会切断HSV-1基因组片段),PCR验证后转入
E.coli
中培养,抽提质粒并用PCR及酶切方法验证后,对阳性质粒测序验证。

2. 在酵母菌中完成HSV-1基因组片段的组装
对上述得到的基因组片段阳性质粒进行酶切,得到11个独立片段,再将这11个基因组片段共转染到酵母菌中,在酵母菌重组体系的作用下,按照之前设计好的片段间重叠部分,按顺序依次组装片段到对应位置,测序证明链接处没有非HSV-1序列及PmeI位点的存在。转入大肠杆菌中抽提质粒,转入到细胞中得到完整的病毒。
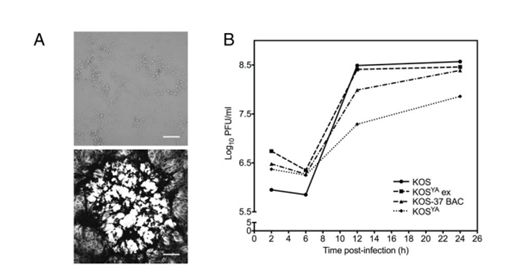
3. 获得感染性重组病毒及
KOS
YA
的生长属性
得到病毒后,作者进行了细胞感染,细胞出现了典型的病变迹象,结晶紫染色同样证实了这一结论。之后作者对病毒生长活力进行检测,发现和野生型KOS相比,KOS
YA
生长活力被抑制,这可能是由于YCp/BAC序列的存在,使用cre-loxp系统得到的病毒生长活力明显恢复。这说明以这种方式合成的病毒和野生型KOS有着相同的生长属性。同时对病毒DNA进行测序分析,与传统方式比较,尽管在一些非编码位点上序列有变化(传统方式也有),但KOS
YA
仍然是正确的组装。
4.
探索病毒蛋白的功能与联系
除了可以快速得到稳定性的病毒外,作者也展示了这套系统在研究病毒功能方面上的应用。使用TAR重组法或者CRISPR-Cas9法,可在克隆片段的的基因末端融合荧光蛋白,作者通过实验证明这并不会影响病毒的活力和蛋白的表达。通过对VP6、VP26、VP1-2的标记,并按需重组后(这里可以同时对每个片段上的基因进行平行修饰,之后按需将片段组装在一起),感染细胞后可通过成像方式发现不同蛋白定位在细胞的不同位置。













