历史上人们认为,结直肠癌肝转移患者切缘存在活细胞与术后总体生存及无复发生存降低相关。然而,近期有研究对阳性切缘对生存的影响提出了质疑。这种差异可能是由于患者本身的基因状态的不同导致的,也有可能是由于肿瘤解剖位置的不同导致的。RAS突变发生在15%-35%可切除的结直肠癌肝转移患者中。之前的研究显示,RAS突变与肝切除术后总生存及无复发生存缩短相关,而且也被发现可以预测化疗后更差的形态学及病理学反应。还有报道提示RAS突变能预测肿瘤细胞具有更强的迁移力及侵袭力等生物学行为。总之,这些发现提示RAS突变反应了更具侵袭性的一种肿瘤表型,那么RAS切除对于手术切缘是否存在提示作用呢?
此外近年来结直肠癌肝转移的外科治疗越来越倾向于缩小范围、保留肝实质的局部切除,CRLM的手术指征也不断扩大,更多初始不可切除的患者获得了手术切除的机会,这也势必导致了更多R1切除的出现,R1切缘的不同类型(R1Vasc:镜下血管残留;R1Par镜下肝实质残留)是否对预后具有相似的影响呢?本期内容尝试给出以上问题的答案。
RAS状态与切缘
Vauthey JN,MD Anderson, 2015

本研究回顾了前瞻性机构肝脏数据库(The prospective institutional liver database )2005年至2013年间633例进行手术切除且RAS突变状态明确的的CRLM患者,其中行根治性切除且没有同时应用射频消融(RFA)的患者,纳入本研究。
229例患者(36.2%)为RAS突变型,
RAS突变组切缘阳性率为11.4%,RAS野生型组切缘阳性率为5.4%
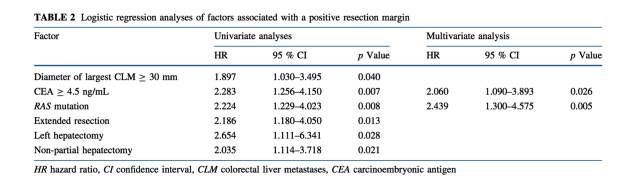
(p=0.007)。单因素分析显示,与切缘阳性相关的因素有:CLM最大径≥30mm,CEA水平≥4.5ng/mL,RAS突变,扩大肝切除,左半肝切除及非部分肝切除。大部肝切除(超过3个肝段),右半肝切除,二次肝切除的第二次切除,以及双侧肝切除与阳性肝切除并不相关。
预测阳性切缘的独立预后因素是CEA≥4.5ng/mL (HR 2.060,95%CI 1.090-3.893;p=0.026)以及RAS突变状态(HR 2.439.95%CI 1.300-4.575;p=0.005)
。
RAS突变组中位切缘宽度(5mm,范围0-80mm)与野生组(6mm,范围0-90mm)类似(p=0.131)。
然而,在切缘宽度≤10mm的群体中,RAS突变组切缘宽度(3mm,范围0-10mm)明显小于RAS野生组(4mm,范围0-10mm)[p=0.045]
。此外,整个群体有225例(55.3%)以肝脏为第一复发脏器,而
在这些肝脏为第一复发脏器的患者中,第一次肝切除切缘中位宽度RAS突变组明显窄于野生组(中位:4mm vs 7mm,p=0.031)
。而RAS突变组与野生组患者第一次肝切除肝转移的直径(RAS突变组28mm,RAS野生组30mm;p=0.476)及数目(RAS突变组2.6,RAS野生组2.5;p=0.825)类似。

对CLM术后影响总生存的因素进行多因素分析显示,与总生存期缩短相关的独立因素包括阳性切缘(HR 3.360,95%CI 1.741-6.485;p<0.001)以及RAS突变(HR 1.629,95%CI 1.013-2.620;p=0.044)。
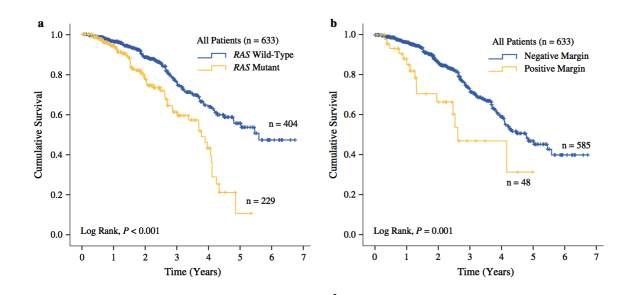
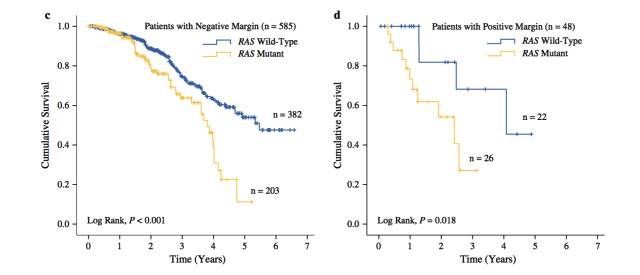 ⬆︎ Kaplan–Meier plots of overall survival in all patients according to (a) RAS mutation status and (b) resection margin status, and in patients with (c) negative resection margins and (d) positive resection margins stratified by RAS mutation status
⬆︎ Kaplan–Meier plots of overall survival in all patients according to (a) RAS mutation status and (b) resection margin status, and in patients with (c) negative resection margins and (d) positive resection margins stratified by RAS mutation status
研究点评:
研究发现CLM中存在两种肿瘤生长方式:
浸润性生长及挤压式生长
。浸润性生长与与CLM切除后较差的OS及增加的肝脏复发风险相关。有研究提示RAS突变与肿瘤更强的迁移力及浸润性相关。该研究中RAS突变组有较高的切缘阳性率提示,如果
不考虑肿瘤生物学行为的差别去探讨最佳无瘤切缘是不合适的。RAS突变与更强的肿瘤侵袭性和/或迁移力表型相关
。
RAS突变与CLM术后切缘更高阳性率相关
。对于RAS突变患者的最佳切缘宽度并无特别推荐,但是今后关于肿瘤生长方式,微转移及局部复发的研究可能有助于确定这些患者的最佳局部治疗。但同时,我们推荐对于
已知RAS突变的患者,术中仔细评价切缘,力争达到1cm切缘
,除非切缘被解剖关系所限制。
肿瘤解剖位置与切缘
Luca Vigano`, Torzilli, Italy, 2016

肝切除是结直肠癌肝转移患者获得长期生存甚至治愈的唯一手段,R0切除一直是肝切除的金标准,R1切除的地位始终存在广泛争议。近年来随着现代化疗有效率的不断提升(尤其在西妥昔单抗、帕尼单抗、贝伐珠单抗在临床广泛使用后)、外科手术技术的不断演进(譬如PVE/PVL、ALPPS等二步肝切除术)、外科理念的不断更新(从提倡大范围、解剖性肝切除,到倾向于缩小范围、保留肝实质的局部切除),CRLM的手术指征也不断扩大,更多初始不可切除的患者获得了手术切除的机会。然而,这也势必导致了更多R1切除的出现。如何看待R1切缘的地位,其对患者术后短期复发(DFS)及长期生存(OS)的影响如何?R1切缘的不同类型(R1Vasc:镜下血管残留;R1Par镜下肝实质残留)是否具有相似的预后?本研究尝试给出以上问题的答案。
















