—— 埃里克·坎德尔(Eric R. Kandel)一花一世界,一胞一乾坤。我们体内的细胞就像我们每个人,各有其独特的命运和身份。细胞的命运和身份主要由其独特的基因调控网络决定和维持【1】。细胞命运决定或维持过程出现错误均可能导致疾病发生。然而,有丝分裂作为多细胞生物生长和维持的基石,却给细胞命运或身份的跨代继承带来了巨大挑战。细胞在进入有丝分裂后,染色质高度凝集成染色体,绝大多数构成基因调控网络的元件,如转录因子和染色质重塑因子等,从染色体上剥离或降解,转录活动几乎完全停滞【2-4】。随着其独特基因调控网络在有丝分裂期的“分崩离析”,细胞好似进入短暂失忆状态。那么,细胞在退出有丝分裂进入分裂间期时,是如何精确、及时地重建其独特的基因调控网络的呢?关乎细胞命运或身份的“记忆”在有丝分裂期如何被精确存储,在分裂间期又如何被及时唤醒呢?
有丝分裂书签被认为是细胞跨代维持其命运记忆的一种可能策略。特定的转录因子或染色质重塑因子可以在有丝分裂期保留在高度致密的染色体上,作为书签因子特异“标记”关键命运基因以促进其转录的快速重新激活,从而确保细胞命运记忆的精确、及时传递。然而,过去几十年间相关有丝分裂书签的重要研究几乎都在体外培养的细胞中完成【5-7】。有丝分裂书签在如神经发育这样复杂生理条件下的生理学功能及分子调控机理仍是领域内关键的未解之谜。
2024年12月10日,北京大学生命科学学院宋艳课题组在Molecular Cell上在线发表了题为“TBP bookmarks and preserves neural stem cell fate memory by orchestrating local chromatin architecture” 的最新研究成果。该研究发现在神经发育过程中,转录因子TBP通过招募染色质重塑因子EP400增加局部染色质可及性,作为有丝分裂书签保留在神经干细胞染色体上,进而维持神经干细胞的命运记忆。

在前期相关神经干细胞命运决定的研究中,宋艳团队发现超级转录延伸复合体(SEC)作为“信号放大器”驱动神经干细胞细胞命运及时、精准的锁定【8】,但关于SEC调控关键靶基因转录的分子调控机制还尚不明晰。通过遗传和生化筛选,研究人员发现SEC可以磷酸化转录因子TBP。更出乎意料的是,TBP蛋白可以保留在果蝇神经干细胞高度凝聚的有丝分裂期染色体上(图1)。为什么TBP能够保留在高度致密的分裂期染色体上?TBP有丝分裂保留的生物学意义又是什么?
图1. 书签蛋白TBP保留在果蝇神经干细胞分裂期染色体上通过精细的果蝇分子遗传学、细胞生物学、生物化学和多组学实验,研究人员发现SEC通过磷酸化修饰调控TBP有丝分裂保留能力,进而促进神经干细胞的自我复制和增殖。由于被SEC磷酸化的TBP能够更有效地招募染色质重塑因子EP400,并在其染色质结合位点附近置换入组蛋白变体H2A.Z,进而增加局部染色质开放性,TBP得以在致密的分裂期染色体上保留下来,作为有丝分裂书签维持神经干细胞自我复制的命运记忆。
图2. 从发育脑中分离处于不同细胞周期的神经干细胞并进行低细胞投入量多组学分析的实验流程那么,TBP在神经干细胞分裂期染色体上特异标记了哪些关键靶基因,进而确保细胞命运记忆的精确储存和跨代传递呢?先前广泛使用的鉴定蛋白在有丝分裂染色体上保留位点的方法是利用药物处理将体外培养细胞的细胞周期同步化并对有丝分裂期细胞加以富集,然后进行多组学分析。然而,这一方法不适用于体内实验。这项研究建立了一个不依赖药物处理的全新实验方案,实现了从发育脑中分离高纯度有丝分裂期神经干细胞,并进行低细胞投入量的多组学分析(图2)。基于该新技术,研究人员细致精准地鉴定了生理条件下TBP在果蝇有丝分裂期神经干细胞中的染色体结合位点,并绘制了神经干细胞有丝分裂期染色质可及性图谱。
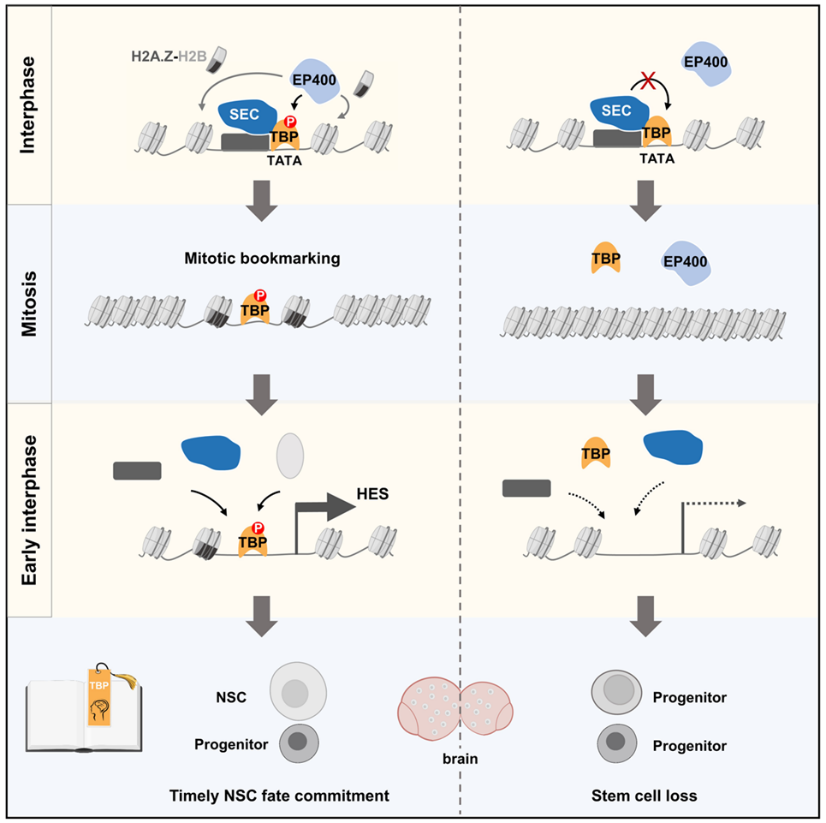
图3. 有丝分裂书签TBP通过调控局部染色质结构维持神经干细胞命运记忆综上所述,这项研究发现书签蛋白的有丝分裂保留促进神经干细胞自我复制和增殖,首次揭示了有丝分裂书签对神经发育的重要生理学意义,并阐明了书签蛋白通过调控局部染色质可及性实现染色体保留的新机制(图3)。值得一提的是,该研究建立了一个全新的技术方案,实现对发育脑中书签蛋白在染色体上的保留位点的精确鉴定。这一新方法将助力有丝分裂书签在其它物种和其它组织器官中的发现及其生理学功能和机制研究的开展。
北京大学生命科学学院博士研究生申钰荧为该论文的第一作者。北京大学生命科学学院宋艳研究员为该论文的通讯作者。课题组博士后刘琨(已出站)、博士研究生刘婕、叶桐桐、赵闰祥和已毕业的申静雯博士和张如兰博士为本文做出了重要贡献。
北京大学生命科学学院宋艳课题组综合运用多种研究手段从独特的视角研究脑发育中细胞命运决定及命运记忆维持或遗忘的分子调控机理,欢迎有志于探究细胞命运记忆传承机理的博士后或博士研究生加入。关于团队的更多介绍详见实验室网站http://yansonglab.org/。
https://doi.org/10.1016/j.molcel.2024.11.0191. Cusanovich, D.A., Reddington, J.P., Garfield, D.A., Daza, R.M., Aghamirzaie, D., Marco-Ferreres, R., Pliner, H.A., Christiansen, L., Qiu, X., Steemers, F.J., et al. (2018). The cis-regulatory dynamics of embryonic development at single-cell resolution. Nature 555, 538-542.
2. Martinez-Balbas, M.A., Dey, A., Rabindran, S.K., Ozato, K., and Wu, C. (1995). Displacement of sequence-specific transcription factors from mitotic chromatin. Cell 83, 29-38.
3. Palozola, K.C., Lerner, J., and Zaret, K.S. (2019). A changing paradigm of transcriptional memory propagation through mitosis. Nat Rev Mol Cell Biol 20, 55-64.
4. Gonzalez, I., Molliex, A., and Navarro, P. (2021). Mitotic memories of gene activity. Curr Opin Cell Biol 69, 41-47.
5. Festuccia, N., Gonzalez, I., Owens, N., and Navarro, P. (2017). Mitotic bookmarking in development and stem cells. Development 144, 3633-3645.
6. Kadauke, S., Udugama, M.I., Pawlicki, J.M., Achtman, J.C., Jain, D.P., Cheng, Y., Hardison, R.C., and Blobel, G.A. (2012). Tissue-specific mitotic bookmarking by hematopoietic transcription factor GATA1. Cell 150, 725-737.
7. Teves, S.S., An, L., Hansen, A.S., Xie, L., Darzacq, X., and Tjian, R. (2016). A dynamic mode of mitotic bookmarking by transcription factors. Elife 5. 10.7554/eLife.22280.
8. Liu, K., Shen, D., Shen, J., Gao, S.M., Li, B., Wong, C., Feng, W., and Song, Y. (2017). The Super Elongation Complex Drives Neural Stem Cell Fate Commitment. Dev Cell 40, 537-551.
BioART战略合作伙伴
(*排名不分先后)
转载须知
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。















