基于单克隆抗体(mAb)的肿瘤免疫治疗,尤其是针对免疫细胞检验点的调节治疗,在近些年来被认为是最具潜力和最受瞩目的肿瘤治疗策略之一。据统计,截至2018年,FDA共批准31款肿瘤治疗单抗药物,其中7款单抗药物用于治疗血液性肿瘤,24款单抗药物用于治疗实体瘤。在24款治疗实体瘤的单抗药物中,有9款单抗靶向了6种不同的CD抗原(包括CD19,CD20,CD30,CD33,CD38和CD53),13款单抗靶向肿瘤细胞表面分子(HER2, EGFR, PD-L1, GD2, PMSA, 以及 SLAMF7),还有3款单抗靶向免疫细胞表面抑制性受体PD-1和CTLA-4,用于激活免疫反应,剩余的单抗主要用于抑制肿瘤血管生成1)。这些数据表明,目前可以用于单抗治疗药物研发的靶点是非常有限的,并且其中的大部分靶点也同时表达在正常的组织中,这意味着在单抗治疗中将会引入一定的副作用。因此,如何找到新的筛选方法用于发现新的肿瘤特异性抗原,尤其是在肿瘤组织中表达量低,但却发挥重要作用的抗原,以及靶向这些抗原的抗体,对于扩大单抗在肿瘤治疗领域中的应用具有重要的意义。
本文将要介绍的体外 (ex vivo) / 体内 (in vivo) 噬菌体展示技术,主要目的就是为了找到更多的肿瘤特异性抗原及靶向抗原的抗体。这些抗原应该具有的特点包括:低丰度;表达在罕见的亚细胞群表面;特异地存在于肿瘤微环境中。因此有望为开发新一代肿瘤治疗抗体提供帮助。
那么这些新的筛选体系是怎么做到的呢?
我们知道,鉴定肿瘤抗原的传统方法是在DNA, RNA 和蛋白质水平上寻找肿瘤和非肿瘤细胞的区别
2
)。这依赖于有效生物原材料的获取,比如细胞系和临床样品。然而,抗原在细胞系表面的表达水平并不能代表其在肿瘤组织中的表达水平。有研究表明,一些细胞表面表达的分子在从体内分离到体外的过程中会失去其上调表达的特征,从而会导致一些潜在靶点的丢失
3
)。另一方面,新鲜分离的临床样品很难达到传统筛选技术所需的含量。即使人源肿瘤组织样品可以在免疫缺陷的小鼠中获取,鼠源的基质细胞也会影响人源肿瘤细胞表面分子的表达模式
4
)。另一个不得不考虑的问题,在传统筛选方法中,样品需要经过一系列复杂的处理,这会导致细胞形态结构的改变,也不利于筛选到潜在的肿瘤靶点。
为了使筛选的环境尽可能地接近肿瘤细胞所处的微环境,保留肿瘤细胞表面分子的表达模式,发现更多新的重要的肿瘤相关抗原和抗体,科研工作者们进行了不断的尝试和改进。这些新的方法可以用于新鲜分离的肿瘤组织,肿瘤病人的体液,以及荷瘤小鼠和癌症病人体内。下文将予以一一介绍。
1) 组织切片筛选
组织切片筛选的核心步骤包括:获取新鲜的肿瘤组织样品→制备冰冻切片或石蜡切片→用激光捕获切割方法从切片上获取感兴趣的细胞区域→将捕获的目标细胞与噬菌体抗体库共孵育→通过微量移液器和特殊的过滤杯转移和清洗非特异性结合的噬菌体→洗脱,侵染和涂板
5
,
6
)。组织切片筛选将激光捕获切割方法和传统的噬菌体筛选相结合,具有以下优点:①通过激光捕获切割可以获得感兴趣的背景相对纯净的细胞群,并且不对细胞造成伤害。②组织处于接近天然的状态。③该方法所需的最小细胞数目可以低至20-30个,大部分的肿瘤组织样品可以满足。这使得它可以被广泛用于针对各种肿瘤组织的筛选。该方法的不足在于它还是只能对多细胞群进行筛选,并且组织需要经过体外的处理。
2) shadow-stick筛选
这是一项针对单个细胞进行的筛选技术。筛选的流程如图1所示。首先将含有目标细胞的异质细胞悬液铺在玻璃片上,用固定液固定细胞,使细胞在筛选和漂洗过程不被洗脱下来。接着将细胞与噬菌体库共孵育,洗去玻片表面游离的噬菌体。然后将玻片用紫外光照射,同时通过显微操作用类似冰球棒的装备将靶细胞和结合在目标细胞上的噬菌体保护起来。这样紫外光将使结合在非靶细胞上的噬菌体的DNA与所结合细胞发生交联,从而使它们失去在大肠杆菌中复制的能力,最后能够生长起来的克隆就只剩下结合在目标细胞表面的噬菌体克隆。一般对于一个细胞可以获得1-10个克隆
7
)。不难看出,这个方法最大的优点是可以对一个细胞进行筛选,适用于靶细胞出现频率极低的情况。比如循环系统中的恶性肿瘤细胞,它们出现的概率只占外周血单核细胞的百万分之一。并且从另一角度来说,靶细胞出现的频率越低,结合细胞表面共同表位的克隆就更有可能被非靶细胞中和,从而提高筛选到结合靶细胞表面特异分子的克隆的概率。
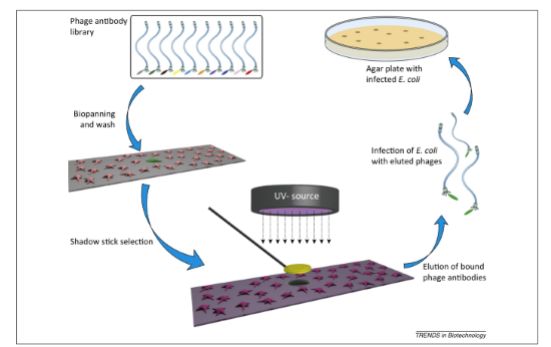
图
1:Shadow-stick
筛选方法流程图
体外和体内 (in vivo) 相结合的噬菌体筛选
早在1996年,就已经有科研工作者尝试用体内噬菌体筛选技术鉴定器官和肿瘤的标记物
8
)。随后,也有不少研究者跟随前人的脚步进行体内噬菌体筛选的试验,其中既包括在动物模型体内,也包括在病人体内 9-11),但大多都不了了之。其原因在于,相比于体外,体内筛选要面临更高背景的非特异性结合,而且后期的数据分析和体内验证要耗费很大的精力。2013年,Sa´nchez-Martı ´n等人为获得肿瘤归巢抗体而进行的体内和体外相结合的噬菌体筛选
12
),是本人认为值得介绍的工作。如图2所示,为了富集到更多可以结合肿瘤组织,而不是血管和基质细胞的抗体,研究者首先用处理过的肿瘤组织在体外进行了一轮富集筛选实验,这也可以减少体内筛选所需要的小鼠数目。随后,将体外富集的抗体库通过静脉注射使其在荷瘤小鼠体内循环24h。然后取出肿瘤组织,洗脱下结合的噬菌体,测序和分析抗体序列。最后再在小鼠体内验证抗体的特异性,以及利用层析和质谱技术鉴定抗体所识别的靶点分子。通过本次实验,工作者找到了一株可以特异识别原发性和转移性胰腺癌的抗体,其识别的靶分子是一个蛋白酶体的激活复合体PA28。后续的验证结果表明PA28可以作为胰腺癌的标记分子12)。
不得不说,通过体内筛选来找到识别肿瘤细胞表面特异分子及其抗体的前景是诱人的。其最显著的特点,是解决了传统体外筛选需要面临的一个严重的问题,即抗体不能很好地到达肿瘤组织内部,或者到达肿瘤微环境的抗体失去了它的效应功能。通过体内筛选获得的抗体,至少保证了抗体是可以通过血液运输到达肿瘤微环境中的。然而,要想真正将体内筛选作为一种普遍使用的筛选方法,仍然面临很大的挑战。例如,需要解决高背景非特异性结合的技术瓶颈;另外,急需寻找合适的抗体展示介质以使抗体能够更好地穿透内皮屏障,选择性地分布在肿瘤组织内部。因为噬菌体并不是一个可以很好穿透内皮屏障的介质,而且有被机体免疫系统攻击的风险。
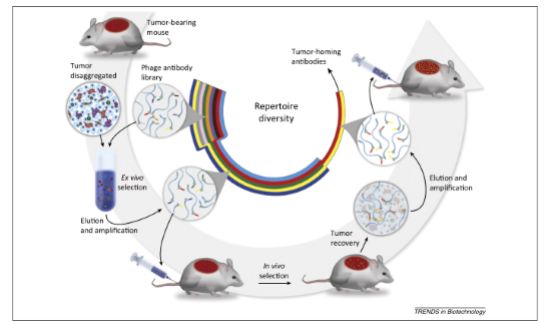
图
2:
体外和体内相结合的噬菌体筛选流程示意图
在最后,本人总结了传统的体外噬菌体筛选技术和新一代噬菌体筛选技术的优缺点,如下表所示。
|
筛选方法
|
优点
|
缺点
|
应用
|
|
体外噬菌体筛选
|
体系成熟操作过程可控;
较易筛选到高亲和力及有特定功能的抗体;
后期功能验证工程量小。
|
只适用于抗原已知的筛选;体外抗原的表达情况与体内有差距,可能导致抗体在体内无法发挥功能。
|
针对已知抗原筛选高亲和力抗体。
|
|
切片筛选
|
利用激光捕获技术,可以针对感兴趣的细胞群进行筛选,样品量需求小。
|
不能对单个细胞进行筛选;背景相对较高;样品经过体外处理,可能细胞表面分子形态的改变;对操作要求高。
|
针对表达共同表面分子的目标细胞群进行筛选,有望发现新的肿瘤相关抗原。
|
|
Shadow-stick筛选
|
针对单个细胞进行筛选,适合对出现频率极低的细胞亚群进行筛选;样品量需求小;筛选过程较为简单。
|
不适用于对常见的细胞进行筛选。
|
筛选特异识别单个细胞表面的抗原。
|
|
体内/体外结合的噬菌体筛选
|
相当于以体内的环境作为抗原库,更能反应真实的抗原表达情况;有利于筛选到能够浸润肿瘤微环境的抗体。
|

















