摘要
背景:外来体或胞外囊泡具有作为标记物的潜力,来诊断各种疾病(包括癌症)。为了鉴定前列腺癌新型的外泌体标记物,我们对从前列腺癌细胞株分离出来的外泌体进行了蛋白组学分析,同时检查了标记物的实用性。
方法:
通过差异离心从雄激素依赖性LNCaP前列腺癌细胞系的培养基及其部分雄激素依赖性C4的亚系分离出来的外泌体,对雄激素依赖性C4-2和骨转移C4-2B进行基于iTRAQ的蛋白质组学分析。外泌体同时也通过免疫捕获来分离,或是通过尺寸排阻色谱法、密度梯度离心法来分离。蛋白质的表达由蛋白印迹分析来确定。GGT的活性用荧光探针,gGlu-HMRG来测量。使用抗GGT1抗体进行组织的免疫组化分析。
结果:
对比于LNCaP细胞,在C4-2和C4-2B细胞中上调的蛋白质中,我们关注GGT1,它是一种细胞表面的酶,用来调节细胞外谷胱甘肽的分解代谢。通过差速离心法和抗CD9或前列腺特异性膜抗原(PSMA)抗体参与的免疫捕获法从C4-2和C4-2B细胞中分泌出来的外泌体中,GGT1大和小亚基的水平均升高。在细胞裂解物和外泌体中,GGT1的表达与GGT活性相关。人类血清通过尺寸排阻色谱法证明了GGT活性和CD9阳性的GGT1亚基的存在。密度梯度离心法揭示:从人血清中分离得到的外泌体中GGT1亚基与CD9共存。由于GGT活性与血清外泌体中的GGT1表达相关,我们测量患者血清中GGT的活性。意外的是,我们发现,PC患者血清外泌体中GGT的活性明显高于良性前列腺增生(BPH)患者。为了支持这一发现,免疫组化分析显示:与BPH组织相比,PC组织中GGT1表达增加。
结论:
我们的研究结果表明血清外泌体GGT的活性可能是PC的有用的生物标志物。
介绍:
外泌体或细胞外囊泡(EV)是从各种细胞分泌的直径为40-150nm的微泡。许多蛋白质,miRNAs,RNAs和DNA都包含在外泌体中,它们的分子特征主要反映了它们来源的细胞。外泌体存在于体液如血液和尿液中,因此预计会成为包括癌症在内的各种疾病的新标志物。Yoshioka等证明,CD147嵌入癌症相关的EV血液中,可用于检测结肠直肠癌。Melo等人最近报道说,在血液中表达磷脂酰肌醇蛋白聚糖-1的外泌体可以将胰腺癌患者与健康受试者及良性胰腺疾病患者区分开来。
前列腺癌(PC)在美国男性中是最常见的癌症之一,在癌症致死中排第二位。前列腺癌对雄激素剥夺疗法有很好的疗效,但是有10%-20%的患者发展成为了CRPC。在晚期CRPC患者中,常发现骨转移。多西紫杉醇,一种微管稳定的紫杉烷,已被用作CRPC的一线化疗,在获得耐药性之前尚有一段时间。最近推出的 cabazitaxel、恩扎拉替胺和阿比特龙已经扩大了转移性CRPC患者的治疗方案。
前列腺特异性抗原(PSA)已经普遍用作前列腺癌的标记物,但它不能区分前列腺癌和良性前列腺增生,除非是前列腺癌进展,PSA明显较良性前列腺肿瘤升高。结合PSA水平,建议患者用CT、MRI以及骨扫描来监测肿瘤控制情况。有许多报告指出有一种潜在的肿瘤标记物来确诊前列腺癌,判断进展以及侵袭性程度,来预测前列腺癌的预后。由于前列腺穿刺的不够精确以及有创性常常导致其不能进行,由体液中的外泌体来诊断和监测前列腺癌将是十分有益的。我们和其他人已经证明,表达于外泌体表面的MDR1编码的前列腺特异性膜抗原(PSMA)和P-糖蛋白(P-gp)可能分别是前列腺癌和抗紫杉烷抗性CRPC的标志物。我们最近还报道了,在外泌体中整合素β4和新戊烯蛋白作为CRPC进展和侵袭性的标志物的潜在可能性。
在目前的研究中,我们通过分析从PC细胞株分泌的出来的外泌体(包括雄激素依赖性LNCaP细胞系及其部分与雄激素无关的C4亚型,雄激素依赖性C4-2和骨转移C4-2B)来鉴定前列腺癌的新外泌体标记物,尤其是对那些趋势抵抗和骨转移的前列腺癌。
在通过蛋白质组学分析鉴定的蛋白质中,我们注意到了γ-谷氨酰转移酶1(GGT1),一个调节细胞外L-γ-谷氨酰基-L-半胱氨酰甘氨酸分解代谢的细胞表面酶。由于GGT活性与血清外泌体中的GGT1表达相关,我们测量了患者血清中的GGT的活性。与我们的预期相反,我们发现PC患者的外泌体GGT活性显着高于BPH患者,这也支持了PC患者的组织中GGT1表达明显高于BPH患者.总之,我们已经将血清外泌体GGT活性确定为诊断PC或将PC与BPH区分开来的新型标志物。
结果:
基于通过差速离心从PC细胞分离的外泌体的蛋白质组学分析,来鉴定GGT1作为PC的潜在的外来体标记物。
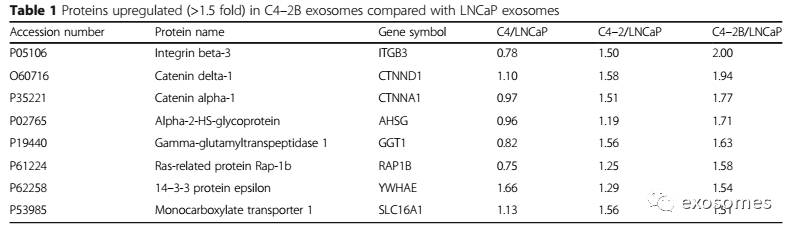
我们分析雄激素依赖性LNCaP细胞系及其C4,C4-2和C4-2B细胞系的亚系。C4细胞在去势时由LNCaP细胞移植建立,对雄激素的敏感性低。C4-2细胞在长期去势条件下从C4细胞移植建立,显示雄激素非依赖性生长反应。C4-2B细胞由去势的C4-2细胞移植骨转移而建立。外泌体通过差速离心从细胞培养基中分离出来。为了鉴定外泌体中差异表达的蛋白质,我们进行了基于iTRAQ的外泌体定量蛋白质组学分析。总共检测到153个蛋白(表S1),与来自亲本的LNCaP细胞相比,从C4-2B细胞分离的外泌体中发现8个蛋白质上调超过1.5倍(表1)。其中GGT1是一种细胞表面的酶,它切割细胞外GSH,并为细胞提供氨基酸,从而增加细胞内GSH水平。在C4-2细胞(1.56倍)以及C4-2B细胞(1.63倍)中GGT1均上调。由于血清GGT活性在某些类型的癌症患者中被报道升高,因此我们将GGT1作为后续研究中PC的潜在外泌体标记物。
通过差速离心从C4-2和C4-2B细胞分离出来的外泌体中GGT1表达的上调
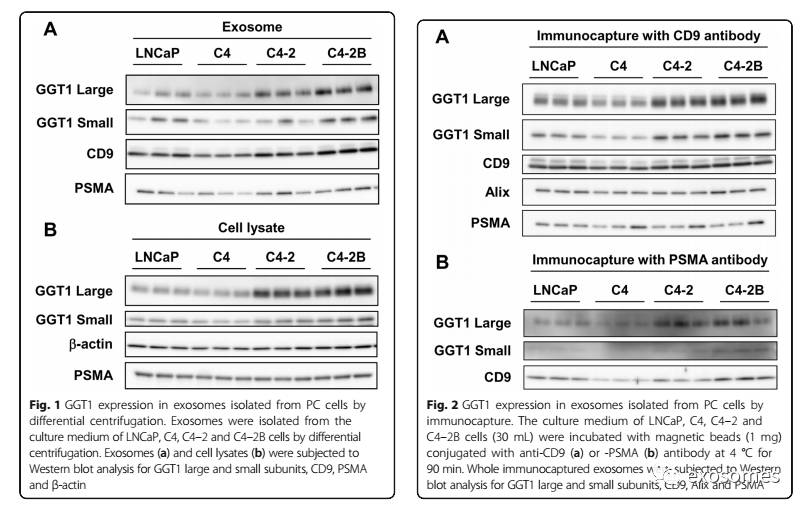
GGT1由一个大亚基和一个小亚基组成,大亚基将酶固定在细胞膜上,小亚基结合并催化细胞外GSH降解的第一步。与LNCaP和C4细胞相比,Western印迹分析显示从C4-2和C4-2B细胞分离的外泌体中GGT1的大、小亚基升高。
从四个细胞系分离的外泌体中检测到了作为外泌体标记物的PSMA以及CD9。与外泌体的表达增加一致,在C4-2和C4-2B细胞中,GGT1大和小亚基均上调,而4个细胞系中PSMA表达水平也相似。这些结果证实,在去势抗性C4-2和骨转移C4-2B细胞系中,外泌体中的GGT1表达均增加。
通过免疫捕获从C4-2和C4-2B细胞分离的外来体中GGT1表达的上调
当通过使用抗CD9抗体的免疫捕获方法从细胞培养基中分离外泌体时,C4-2和C4-2B细胞中GGT1大和小亚基的水平升高,而PSMA以及外泌体标记物CD9和Alix在细胞系之间没有显着差异。同样,通过抗PSMA抗体从C4-2和C4-2B细胞捕获的外泌体中GGT1的大小亚基上调。这些结果表明,CD9或PSMA阳性外泌体的不同亚组表现出GGT1的表达均增加。
从PC细胞分离的外泌体中GGT活性与GGT1表达的相关性
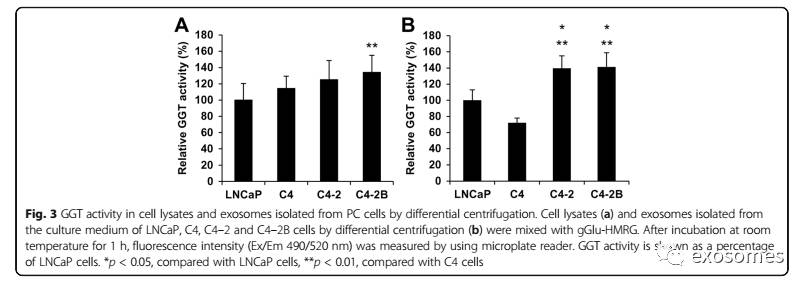
我们使用荧光成像探针,通过用GGT切割谷氨酸激活的γ-谷氨酰羟基甲基罗丹明绿(gGlu-HMRG)测量外泌体中GGT的活性。从LNCaP,C4,C4-2和C4-2B细胞分离的细胞裂解物和外泌体中测量GGT的活性。
与LNCaP细胞相比,C4-2B细胞中GGT活性显着增加。另一方面,从C4-2和C4-2B细胞分离的外泌体的GGT活性高于来自LNCaP和C4细胞。更重要的是,外泌体中GGT的活性与4个细胞系外泌体中GGT1大小亚基的表达水平相关。这些结果表明,GGT活性可以用作替代外泌体GGT的表达。
由人体血清分离的外泌体中的GGT活性和GGT1表达
Franzini等人在血清中鉴定出四种GGT级分:大GGT,中GGT,小GGT和游离GGT级分,最近表明大GGT部分对应于外泌体GGT 。在这里,我们将健康个体的血清进行大小排阻层析(SEC),并测量每个级分中的GGT活性和CD9表达。 通过夹心ELISA测定CD9的水平。SEC产生了GGT活性的的一个小峰和主峰(图4a)。跨越4至9级的小峰为CD9阳性,表明在血清外泌体中检测到GGT活性。从相同的健康个体获得的级分3至10的Western印迹分析显示GGT1大和小亚基与CD9的共存(图4b)。我们还通过由差速离心至OptiPrep密度梯度离心对来自人体血清的外泌体进行了分析。
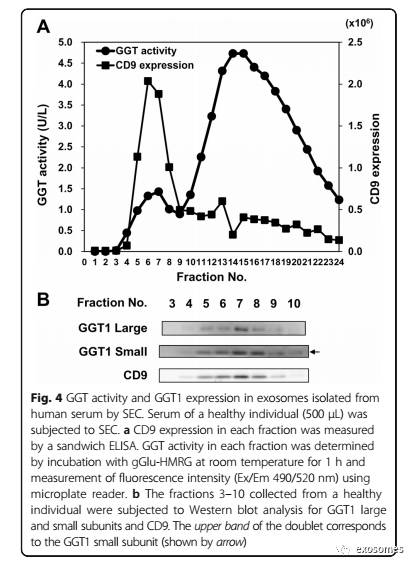
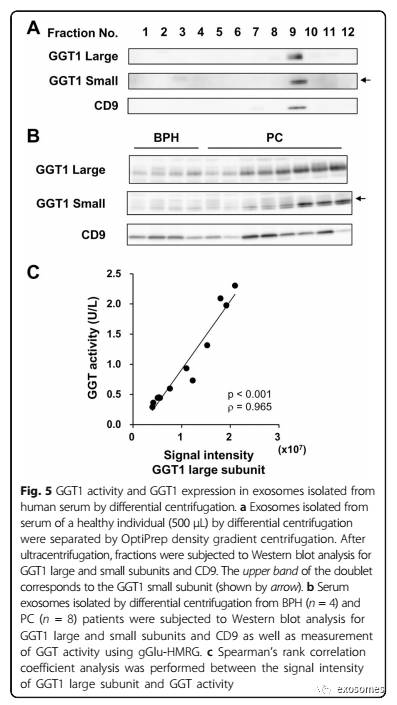
结果表明,GGT1大、小亚基仅在CD9阳性的部分9中检测到(图5a),表明通过差异离心法分离的血清外泌体不受其他GGT形式的干扰,如中GGT, 小GGT和自由GGT。最后,我们通过从BPH(n = 4)和PC(n = 8)患者的差速离心分离血清外泌体,并确定GGT1表达(图5b)以及GGT活性。Spearman等级相关分析显示GGT活性与血清外泌体中GGT1大亚基信号强度的相关性(图5c)。上述结果为使用gGlu-HMRG探针通过差速离心分离的血清外泌体测量GGT活性提供了依据。
血清外泌体GGT活性同CRPC无关联性
鉴于我们将GGT1定义为在去势抗性C4-2和骨元素静态C4-2B细胞中上调的外泌体标志物,因而可以假设血清外泌体中的GGT活性可能是CRPC和/或骨转移的标志物。我们通过差速离心从PC患者血清中分离出外泌体,并使用gGlu-HMRG探针测量GGT活性。但与我们预期相反的是,血清外泌体GGT活性在有去势阻力(n = 6,PSA:7.46-585.70ng / mL)和无去势阻力(n = 35,PSA:4.20-549.39ng / mL)的PC患者身上并没有表现出差异来(附加文件2:图S1)。由于合适的患者人选有限,血清外泌体GGT活性同骨转移的联系并未做进一步检测。上述结果表明,通过差速离心分离的血清外泌体GGT活性在PC患者中用来作为CRPC的标志物,没有或者是几乎没有可能。
较之BPH患者,PC患者的血清外泌体GGT活性增加
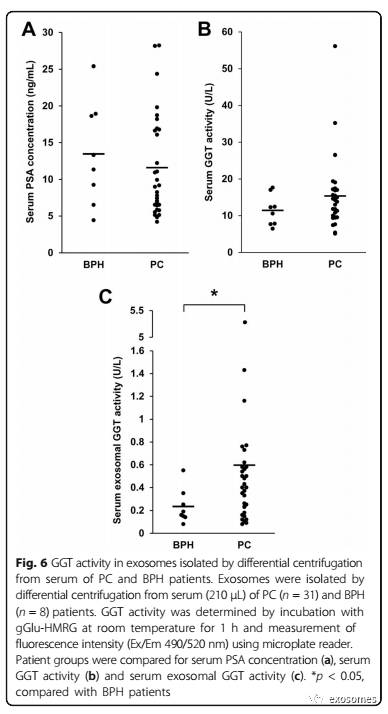
据报道,在某些特定种类的癌症中血清GGT活性增加[22],因此我们测量了BPH 患者(n = 8, PSA: 4.42-25.40 ng/mL)和PC患者(n = 31,PSA:4.20-28.23 ng / mL)这两类患者的血清GGT活性以及血清外泌体GGT活性。 结果显示,两组患者血清PSA浓度(图6a)和血清GGT活性(图6b)无统计学上的差异。相比之下,PC患者血清外泌体的GGT活性却要明显高于BPH患者(图6c)。上述结果表明,尽管两者都表现出相似的血清PSA水平,但相较于血清GGT活性,血清瓦米体 GGT活性更有可能成为区分PC患者与BPH患者的生物标志物。
PC组织中GGT1表达比在BPH组织中增加
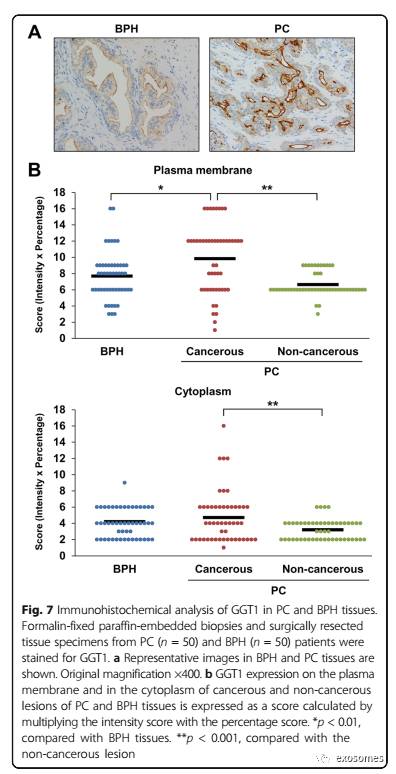
与BPH患者相比,PC患者的血清外泌体GGT活性升高表明PC组织中GGT1表达存在比BPH组织中增加的可能性。为了证明我们的假设,我们使用福尔马林固定的石蜡包埋活检和PC和BPH患者的手术切除组织标本进行GGT1的免疫组织化学染色。患者的临床和病理特征见附录3:表S2。在BPH组织中,前列腺对GGT1显示出弱的顶端表达(图7a)。在PC组织中,癌细胞表现出GGT1的胞质和膜表达,背景非癌前列腺腺体表达则较弱。为了评估质膜和细胞质中的GGT1表达,对强度和百分比进行染色,然后将两个评分相乘(图7b)。与BPH组织相比,PC组织中GGT1表达增加(p <0.01),而细胞质中GGT1表达无统计学差异。在PC组织中比较GGT1表达时,癌组织病变中的膜质和细胞质表达高于非癌性病变(p <0.001和p <0.001)。GGT1表达与Gleason评分无统计学差异。上述结果表明,PC组织中GGT1的表达明显高于BPH组织,有力支持了我们关于血清外泌体GGT活性在PC患者体内增加的这个发现。
讨论
基于通过差速离心从PC细胞系分离的外泌体的蛋白质组学分析,我们确定了GGT1可以作为PC的潜在外显子标记。GGT也称为γ-谷氨酰转肽酶是将γ-谷氨酰基从GSH和其他γ-谷氨酰化合物转移到氨基酸或二肽的酶。在细胞中有大量的GSH,它在保护氧化应激和维持氧化还原状态方面起重要作用。GGT启动细胞外GSH的降解,导致半胱氨酰甘氨酸和谷氨酸的产生。然后通过细胞表面二肽酶水解半胱氨酰甘氨酸以产生甘氨酸和半胱氨酸。降解的氨基酸用于GSH的从头合成。在正常人体组织中,神经系统肾小管细胞,肝胆管和毛细血管内皮细胞表面的GGT免疫反应性较强。汗腺,前列腺,唾液腺导管,胆管,胰腺,肠隐窝和睾丸小管中的分泌或吸收性细胞也是GGT阳性的。在人类基因组中的GGT基因家族中,GGT1通常被称为GGT,参与GSH代谢。
GGT表达的标高已报道了许多癌症,包括结肠癌,卵巢癌和肝癌,神经胶质瘤星形细胞,软组织肉瘤,黑素瘤和白血病[22]。GGT表达的综合分析显示,来自表达GGT的组织的大多数肿瘤对GGT呈阳性,来自GGT阴性上皮的肺和卵巢癌也表达GGT。GGT表达与乳腺癌预后不良相关,但前列腺,结肠直肠癌和乳腺癌患者GGT表达与标准临床病理参数之间无相关性。
已经认为癌症中GGT表达的上调通过增加细胞内GSH水平从而保护癌细胞抵抗氧化应激,从而支持其生长和存活。然而,也证明GGT对GSH的代谢具有促氧化作用。GGT的上调可能对细胞造成氧化负担,导致GSH消耗和细胞GSH储存的减少。GGT表达增加引起的ROS持续产生可能导致遗传不稳定和肿瘤进程。
血清GGT活性通常用作肝,胆囊和胆道疾病,特别是酒精性肝病的标志物,因为它对酒精消费特别敏感。另一方面,已经证实了血清GGT活性与癌症风险以及心血管疾病和代谢综合征相关。此外,与具有良好和中等分化肿瘤的肝细胞癌患者相比,在分化肿瘤的肝细胞癌患者中血清GGT水平较低。在肾细胞癌中,大多数转移患者的血清GGT活性报告增加,而大多数局部肿瘤患者为正常。
Franzini等人 进行凝胶过滤色谱,然后与荧光GGT底物,γ-谷氨酰基-7-酰胺基-4-甲基香豆素(γGluAMC)进行后柱反应,并在血清中鉴定出四种GGT级分:大GGT,中GGT,小GGT和游离GGT级分 的分子量(分子量> 2000 kDa,940 kDa,140 kDa和70 kDa)。作者表明,非酒精性脂肪性肝病(NAFLD)中b-GGT升高,而不是慢性丙型肝炎(CHC),b-GGT / sGGT比率显示出区分NAFLD和CHC的最高诊断准确性。他们还表明,大GGT分数对应于血清胞外体 GGT 。
为了确定外泌体上的GGT活性,我们使用了一种新报道的荧光探针,gGlu-HMRG,它通过用GGT快速裂解谷氨酸而被活化。该探针被开发用于在手术和内窥镜手术期间检测癌细胞,并利用其在细胞表面上存在的GGT的活化。报道中提到已使用gGlu-HMRG的有浅表头颈鳞状细胞癌和野兽,肺癌和结肠直肠癌的体内成像。在人卵巢癌细胞系中也显示了gGlu-HMRG的体外活化。
在目前的研究中,我们首先展示了细胞裂解物和外来体中GGT1表达与GGT活性的相关性。其次,我们用SEC分离人血清,证明小血清阳性对于CD9包含GGT1大和小亚基以及GGT活性,并且主要峰值可能由除GGT或外源GGT部分之外的中GGT,小GGT和游离GGT级分组成。第三,我们通过差速离心将人血清分离的外泌体进行OptiPrep密度梯度离心,证实通过差速离心分离自人血清的外泌体没有其他GGT形式的污染。最后,根据这些发现,我们测量了患者的血清外泌体GGT活性。尽管GGT1在从与雄激素无关的C4-2和骨转移性C4-2B细胞分离的外来体中上调,但是在具有阉割抗性的PC患者和不具有阉割抗性的PC患者之间没有差异。 意外的是,我们发现PC患者的血清外泌体GGT活性明显高于BPH患者。
为了证明PC患者血清exosomal GGT活性升高的这个结果,与BPH组织相比,PC组织GGT1表达升高。以前的报告显示,绝大多数PC患者大多数肿瘤细胞为GGT1阳性。在此研究中,我们证实PC和BPH组织之间的GGT1表达有显着性差异。此外,癌细胞在细胞质和膜中表现出比背景非癌前列腺更强的GGT1表达。这些结果表明,前列腺癌细胞可能产生更多的表达GGT1的外泌体。负责GGT1在PC中过量表达的基础机制仍有待阐明。
许多报告提出了基于病理和临床研究的PC的潜在标记。更多最近鉴定的PC标志物包括前列腺癌抗原3(PCA3)[46],TMPRSS2-ERG融合基因[47]及其组合使用。尽管描述了外来miRNA作为PC的标记物的报道数量有限,我们和其他人已经报道了有助于诊断PC(PSMA),紫杉烷抗性CRPC(P-gp)和PC(整联蛋白β4和纽蛋白)的进展和侵袭性的外泌体蛋白标记物。这是第一份描述血清外泌体GGT1表达或GGT活性作为诊断PC的潜在标志物的报告。
PSA是PC的常用标记,但当水平相似时,它不能区分PC与BPH 。在本研究中,我们测量了两组患者的血清exosomal GGT活性以及血清GGT活性和血清PSA水平。如附加文件4所示:图S2,血清外体GGT活性的AUC为0.714(9535%CI为0.535〜0.892),血清GGT活性为0.621(95.3%CI为0.396〜0.846),血清PSA浓度为0.601(95%CI 在0.361和0.841之间)。这些结果表明,作为生物标志物的是血清外泌体GGT活性而不是血清GGT活性能够区分PC患者与BPH患者,两者均表现出相似的血清PSA水平。
虽然我们已经证明了血清外泌体GGT活性对PC和BPH鉴别诊断的潜力,但目前的检测系统对于临床应用有局限性,因为需要差速离心来测量活性。还值得注意的是,GGT1在正常组织中表达,因此通过差速离心分离的血清外泌体可能含有来自各种组织的东西。我们和其他人最近证实,通过与抗PSMA抗体的免疫捕获可以分离来自PC的外泌体。对PSMA具有更高亲和力的抗体的研究发展及其使用将使得我们能够增加血清外泌体GGT活性的特异性和敏感性作为PC的标记。
血清外泌体GGT活性作为诊断PC的标记物的有用性需要在大规模临床研究中得到验证。由于血清GGT活性已经通过临床和流行病学研究涉及多种疾病,检测血清外体GGT活性是否优于PC以外的其他疾病的血清GGT活性是非常有意义的。血清外泌体GGT活性作为诊断PC的制造商的有用性需要在大规模临床研究中得到验证。 由于血清GGT活性已经通过临床和流行病学研究涉及多种疾病[34-36,50],检测血清外体GGT活性是否优于PC以外的其他疾病的血清GGT活性是非常有意义的。 然而,为了进行大规模的研究,仍然需要建立一个简单快速的检测系统,这将有可能在前瞻性临床研究中评估血清外泌体 GGT活性作为预后和诊断标志物的潜力。 最后,了解GGT1对患者血清外泌体的性质和作用也非常重要。
结论
我们证实PC患者的GGT活性明显高于BPH患者,与BPH组织相比,PC组织中GGT1表达增加得到支持。血清外泌体GGT活性可能是诊断PC或区分PC与BPH有用的标志,甚至诊断具有增加的GGT1表达的其他类型的癌症。