今日,中检院新公布 9 月 1 日至 30 日的企业参比制剂备案信息啦!这是第四批信息公开,前期已分三次对 5 月 20 日至 8 月 31 日期间备案信息公开。
下面 Insight 将做一些简单的分析和解读,希望与大家一起讨论,也希望能够大家补充交流。
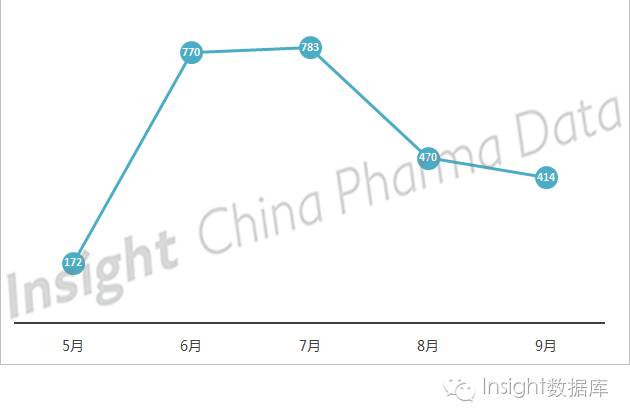
1、参比制剂备案数量 6-7 月最多
自 5 月企业开始备案拟定参比制剂以来, CFDA 共公示参比制剂备案信息 2609 条(未除去代替和废止的信息),按月统计,备案数量呈现浮动变化,如图表 1 所示。 5 月备案数量最少,当然这与备案开始时间是5月20日有很大关系;6 月和 7 月备案数量基本持平;8 月的备案数量较 7 月减少40%。整体看来,尚未出现备案数量井喷式增长, 大多企业尚未参与竞争。
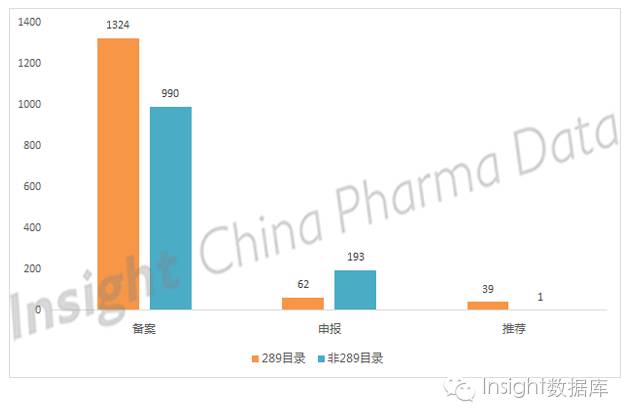
2、企业同样看重非 289 目录,尤其是申报品种
已公示 2609 条参比制剂备案信息中,其中属于 289 目录品种的有 1425 个,占备案总数的 55%。其中,申报和推荐共有 101 个,占 7%。在 1184 条非 289 目录品种中,申报和推荐共有 194 个,占 16%。由此可见,非 289 目录品种虽然总体数量低于 289 目录品种,但有更多企业选择申报非 289 目录品种作为参比制剂。
3、289 目录超三成品种仍无人问津
在 289 目录品种中,已备案品种按通用名记共 187 个,换言之超过 65% 的品种有企业开始着手开展一致性评价工作。但是,将近 35% 的品种仍无人问津,或许是因为已经备案或申报但尚未公示,或许是因为参比制剂难以确定,企业还在努力查找,亦或是因为品种市场份额有限,企业还处于观望状态。
4、拟定参比制剂:近 10% 为申报自家品种,增幅明显
根据 CFDA 第 99 号公告,若原研药品生产企业、国际公认的同种药物生产企业产品满足参比制剂的条件,可主动申报作为参比制剂。此次中检院公布的备案信息中,无论是否为 289 目录品种,共有 10% 左右的拟定参比制剂为企业主动申报,较 5-6 月的 3% 增幅显著。
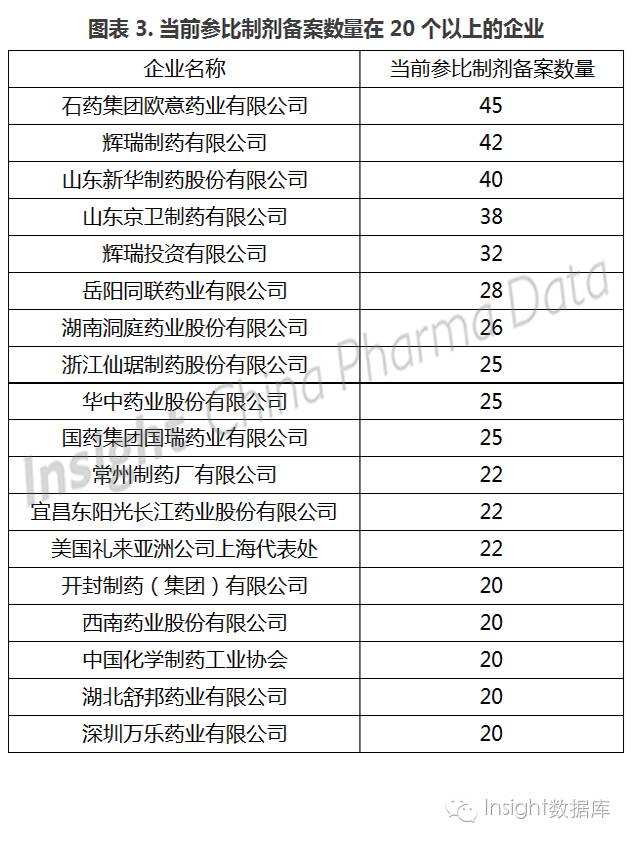
5、表现积极的企业:石药欧意、辉瑞制药、山东新华
截至目前,已公布参比制剂备案、推荐以及申报的企业共有 514 家,而首批需要做一致性评价的企业有 2038 家,仅有 25.22% 的企业参与进来。由于市场竞争和一致性评价费用等因素,65% 企业的备案数量仅为 1~5 个,仅 7% 企业的备案数达 15 个以上。其中,备案数量最多的企业为石药集团欧意药业有限公司,已有 45 个。
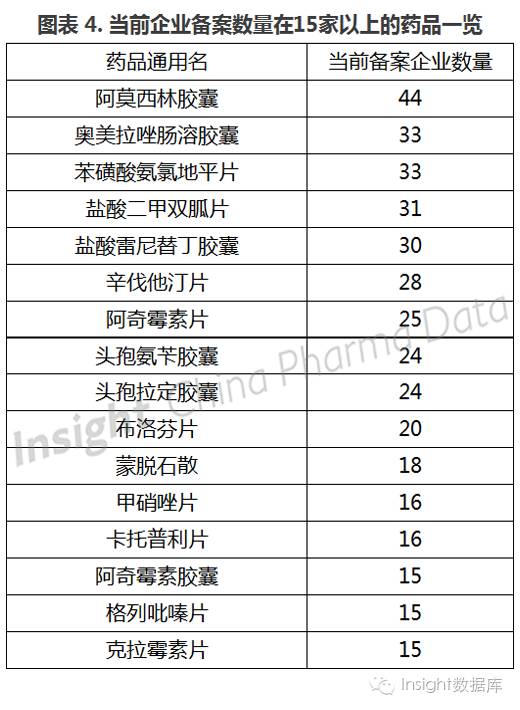
6、竞争最激烈的品种:阿莫西林胶囊、奥美拉唑肠溶胶囊、苯磺酸氨氯地平片
此次公布参比制剂备案、推荐以及申报的品种共有 612 个(按通用名计),其中,备案企业数量在 10 家以上的品种有 35 个,占比 5.7%,5 家以上品种 97 个,占比 15.8%,其中竞争最激烈的是阿莫西林胶囊,有 44 家左右的企业已经扎堆备案。
距离 289 目录品种一致性评价时间大限只有两年不到,越来越多的企业开始参与竞争,如何在一致性评价中节约更多时间和成本成为企业关心的问题,今日 CFDA 适时发布了《仿制药质量和疗效一致性评价品种分类的指导意见》的征求意见稿,看看自己的品种是否符合免除重新研究的条件,请移步第二篇文章查看征求意见稿全文。
责任编辑:小luan
转载请注明「作者:小luan,来源:Insight数据库」
- Insight 优选 -
中检院公示的企业参比制剂备案信息汇总名单为 pdf,不便于大家查询。因此 Insight 为大家准备了 Excel 版汇总名单,可任意筛选、查询和分析,进入公众号回复「 2609」即可下载 2609 个备案名单,请笑纳。

点击「阅读原文」,即可免费获取一个 Insight 账号哦,快来体验吧!
↓↓↓















