中文翻译:阿栗博士
2017年9月5日,葛兰素史克和ViiV公司发现了新的HIV整合酶变构抑制剂
2017年9月29日,FDA批准Verzenio用于治疗乳腺癌
2017年9月26日,化合物ODM-208有望用于治疗去势抵抗性前列腺癌
2017年9月19日,Ono Pharmaceutical发现新结构的Axl/Mer双重抑制剂
2017年9月18日,FDA批准Somatuline Depot用于治疗类癌综合征
2017年9月15日,FDA批准Aliqopa用于治疗复发性滤泡性淋巴瘤
2017年9月6日,提高了细胞靶向性的谷氨酰胺酶拮抗剂前药有望用于治疗血液恶性肿瘤
2017年9月12日,II型糖尿病药物Canalia在日本上市
2017年9月27日,日本批准Cedarcure SLIT用于治疗日本雪松过敏
2017年9月13日,两个苯甲酰胺类化合物有望用于治疗精神分裂症
2017年9月28日,新型的MABA支气管扩张剂CHF-6366具备体外和体内活性
2017年9月27日,Chiesi公司发现的新型可吸入皮质类固醇在气道炎症模型中具有活性
2017年9月19日,FDA批准TrelegyEllipta用于慢性阻塞性肺病
2017年9月5日,葛兰素史克和ViiV公司发现了新的HIV整合酶变构抑制剂
来自葛兰素史克和ViiV公司的科学家开发了一类新颖结构的HIV整合酶抑制剂,可以与其他逆转录酶抑制剂联用以治疗非交叉耐药性的HIV感染。经历了数代结构优化,研究人员探明了此类变构抑制剂的构效关系。最终得到的优选化合物GSK-7186对野生型酶的抑制活性达到3 nM。该化合物已申请专利保护(WO 2014009794)。(Velthuisen, E. 254th Am ChemSoc (ACS) Natl Meet (Aug 20-24, Washington, D.C.) 2017, Abst ORGN 65)
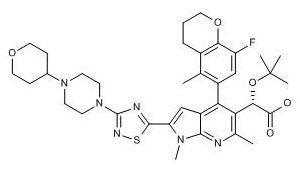
图为GSK-7186结构
2017年9月29日,FDA批准Verzenio用于治疗乳腺癌
FDA批准了礼来公司的Verzenio(abemaciclibmesylate)用于既往接受过内分泌疗法后病情进展的荷尔蒙受体(HR)阳性,HER2阴性的晚期或复发乳腺癌的治疗。Verzenio被批准与内分泌疗法药物fulvestrant联合用于治疗内分泌治疗后病情进展的患者;同时也被批准单独用于内分泌治疗和化疗无法控制的晚期或转移性乳腺癌患者。共有669名患者参与了Verzenio与fulvestrant联合疗法的安全性和有效性临床试验,包括了经内分泌治疗的HER2阴性的乳腺癌患者以及在癌症发生转移后未接受化疗的患者。数据显示,上述联合疗法的中位无进展生存期为16.4个月,而使用安慰剂+fulvestrant疗法的对照组为9.3个月。在另一项针对Verzenio独立疗法的单臂临床试验中,共有132名接受过内分泌治疗和化疗后肿瘤转移的HR阳性、HER2阴性的乳腺癌患者参与。在此项研究中,19.7%的患者出现了完全或部分的肿瘤萎缩,发生缓解的中位时长为8.6个月。Verzenio的常见副作用包括腹泻、中性粒细胞减少和白细胞减少症、恶心、腹痛、感染、疲劳、贫血、食欲下降、呕吐和头痛。严重副作用包括腹泻、中性粒细胞减少、肝脏学血测试指标升高和深静脉血栓/肺栓塞。(FDA新闻稿)
图为Bemaciclib结构
2017年9月26日,化合物ODM-208有望用于治疗去势抵抗性前列腺癌
由Orion Corporation开发的化合物ODM-208是一个新颖的胆固醇侧链裂解酶CYP11A1抑制剂,有望用于治疗去势抵抗性前列腺癌(CRPC)。体外实验显示,ODM-208能够显著抑制CYP11A1。在孕烯醇酮和睾酮的ELISA实验中,ODM-208的IC50分别为11 nM 和26 nM,IARA实验中的IC50为80 nM。对正常大鼠注射给药ODM-208剂量分别为3, 10, 30或50 mg/kg进行的体内研究结果显示,给药4小时后,3 mg/kg剂量组的大鼠体内的睾酮、孕烯醇酮和皮质甾酮激素浓度分别下降为原浓度的35%、15%和35%;10 mg/kg剂量组的上述结果分别为14%, 8%和25%;30 mg/kg剂量组结果分别为12%, < 5%和4%;50 mg/kg剂量组的结果分别为1%, < 5%和1%。CRPC的VCaP细胞模型被用于测试化合物的肿瘤抑制作用。数据表明,对去势大鼠给予每日两次的ODM-208(20 mg/kg)与强的松每日一次0.6 mg/kg持续42天后,与对照组相比,肿瘤的生长得到了显著的抑制。上述结果证实ODM-208是一个新颖有效的CYP11A1抑制剂,可以降低体内睾酮、孕烯醇酮和皮质甾酮激素的浓度,并可以在CRPC模型中抑制肿瘤的生长。目前,该化合物正在欧洲准备进行针对转移性CRPC患者的临床试验。(Oksala, R. et al. 41st EurSoc Med Oncol (ESMO) Congr (Sept 8-12, Madrid) 2017, Abst 28P)。
2017年9月19日,Ono Pharmaceutical发现新结构的Axl/Mer双重抑制剂
Ono Pharmaceutical公司开发并合成了一系列Axl/Mer酪氨酸蛋白激酶受体的双重抑制剂。研究者经过高通量筛选得到了一类吡咯并嘧啶类化合物,并进一步优化得到了先导化合物ONO-6990554。该化合物在Axl和Mer靶点的IC50均为0.002 mcM,在KDR和IGF-I受体的活性分别为1.3 mcM和1.2 mcM。在Ba/F3细胞中,化合物对Axl和Mer靶点的IC50分别为0.006和0.003 mcM。此外,研究人员还发现了一个共价抑制剂ONO-2170573,其Axl和Mer的细胞活性IC50分别为0.001和0.0007 mcM。上述化合物已申请专利保护(WO 2015068767)。(Inukai, T. et al. 254th Am ChemSoc (ACS) Natl Meet (Aug 20-24, Washington, D.C.) 2017, Abst MEDI 343)。
上图为ONO-2170573结构
上图为ONO-6990554结构
2017年9月18日,FDA批准Somatuline Depot用于治疗类癌综合征
FDA批准了Ipsen公司的Somatuline Depot(lanreotide acetate,120mg注射剂)的新适应症,用于治疗类癌综合征。使用该药可以降低短效生长激素抑制素的治疗频率。该药的获批基于一项名为ELECT的随机双盲有安慰剂对照的临床试验(ClinicalTrials.gov编号NCT00774930)。Somatuline Depot还被批准用于治疗不能手术切除的充分或中度分化的局部晚期或转移性胃肠胰腺神经内分泌肿瘤,改善患者的无进展生存期。(Ipsen公司新闻稿)
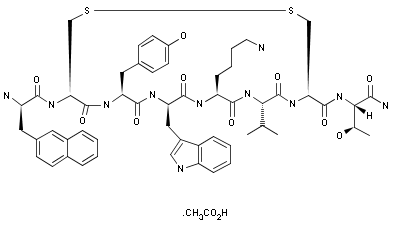
图为Lanreotide acetate结构
2017年9月15日,FDA批准Aliqopa用于治疗复发性滤泡性淋巴瘤
FDA批准了拜耳制药的Aliqopa(copanlisib hydrochloride)用于治疗罹患复发性滤泡性淋巴瘤,且已经接受了至少两次系统疗法的成人患者。Aliqopa将很快在美国上市销售。该药是一种PI3K小分子抑制剂,其获批经过了FDA的加速审批通道,并得到了一项名为CHRONOS-1的开放标签的单臂II期临床试验的数据支持(ClinicalTrials.gov编号NCT01660451)。该项试验招募了104名滤泡性B细胞非霍奇金淋巴瘤的复发患者,他们都已经接受了至少两次治疗。结果显示, 59%的患者(104名)出现了中位值为 12.2个月的完全或部分缓解,其中14%为完全缓解,肿瘤缓解率根据国际工作组的恶性淋巴瘤标准来统计。首要临床终点为独立检查委员会评估的客观缓解率。Aliqopa包含如下的安全性警告及预防措施:严重甚至致命的感染、3级或4级高血糖、3级高血压、非感染性肺炎、3级或4级中性粒细胞减少、3级或4级皮肤反应以及胚胎毒性。Aliqopa此前曾获得优先审查资格、孤儿药认证和快速通道资格。(拜耳制药公司新闻稿;FDA新闻稿)
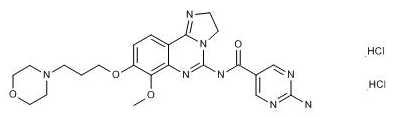
图为Copanlisib hydrochloride结构
2017年9月6日,提高了细胞靶向性的谷氨酰胺酶拮抗剂前药有望用于治疗血液恶性肿瘤
来自捷克科学院有机与生物化学研究所和约翰霍布金斯大学的研究人员致力于改善谷氨酰胺酶拮抗剂6-重氮-5-氧代-L-正亮氨酸(DON)的细胞选择性。DON有望用于治疗血液恶性肿瘤,但受制于其毒性,尤其是胃肠道毒性。研究人员合成了DON的前药,其中一个化合物JHU-292显示了良好的血浆稳定性,并在体外实验中相比于DON可以使药物在外周血单核细胞的浓度与血浆浓度比值提高10倍。在体内试验中,JHU-292的外周血单核细胞/血浆的浓度比DON提高了6到10倍。小猪的5天体内实验显示在同等的外周血单核细胞暴露量下,JHU-292比DON更少的进入胃肠道组织且显著减少了胃肠道症状。JHU-292在进入肿瘤细胞后会被代谢成为DON,其肿瘤细胞/血浆浓度的比例比DON显著提高了15倍。化合物JHU-292已申请专利保护(WO 2017023774)。(Zimmermann, S. et al. 254th Am ChemSoc (ACS) Natl Meet (Aug 20-24, Washington, D.C.) 2017, Abst MEDI 318)。

图为JHU-292结构
2017年9月26日,FDA批准了Keytruda及其联用的诊断方法用于治疗晚期胃癌
安捷伦科技公司透露,FDA批准了其Dako PD-L1 IHC 22C3 pharmDx assay检测试剂盒的一个新用途,用于胃或胃食管结合部腺癌患者的PD-L1表达量检测并帮助患者使用默克公司的PD-1疗法药物Keytruda(pembrolizumab)。默克公司同时宣布,Keytruda被FDA批准用于治疗罹患复发性局部晚期或转移性胃癌/胃食管结合部腺癌的患者。患者的PD-L1表达量须由一种FDA批准的检测方法进行检测。这些患者既往接受过两种或更多种系统治疗或治疗后疾病仍出现进展,其中,既往疗法包括含氟嘧啶及含铂的化疗方案,如果合适的话,还包括HER2/neu靶向药物治疗。(安捷伦科技公司新闻稿;默克公司新闻稿)
2017年9月15日,FDA批准bevacizumab的生物仿制药Mvasi
安进公司和艾尔建公司宣布FDA批准了Mvasi (bevacizumab-awwb)作为Avastin(bevacizumab)的生物仿制药上市,用于后者已被批准的全部适应症。Mvasi目前可用于5种类型的癌症治疗,包括非鳞状非小细胞肺癌、结直肠癌、胶质母细胞瘤、肾细胞癌和子宫颈癌。针对非鳞状非小细胞肺癌,Mvasi被批准与卡铂和紫杉醇联用,用于一线治疗不可切除的局部晚期的复发或转移性疾病。针对转移性结肠直肠癌,Mvasi被批准与5-氟尿嘧啶静注化疗联合用于一线或二线治疗;也可以与氟嘧啶-伊立替康或氟嘧啶-奥沙利铂用于贝伐珠单抗一线治疗后疾病进展患者的二线化疗。Mvasi还被批准在基于客观缓解率改善的情况下用于既往治疗后疾病进展的胶质母细胞瘤。此外,还被批准与干扰素α联用治疗转移性肾细胞癌;和与紫杉醇/顺铂或紫杉醇/拓扑替康联用治疗持续性复发或转移的宫颈癌。Mvasi的获批基于包括结构、功能、毒性、药代动力学性质、免疫原性、临床安全性和有效性在内的全部证据,证实了Mvasi与参比药物bevacizumab完全生物等效,且在临床试验中没有发生安全性、有效性和免疫原性的显著差别。上述临床数据包括了一个治疗非小细胞肺癌的III期临床的结果。该药于去年12月提交了欧盟的MAA申请,目前正在评审过程中。(安进公司新闻稿;FDA新闻稿)。
2017年9月12日,II型糖尿病药物Canalia在日本上市
三菱田边制药与第一三共制药宣布II型糖尿病药物Canalia(teneligliptin hydrobromide/canagliflozin,替格列汀/卡格列净复方片剂)在日本上市销售。该药由DPP-4抑制剂替格列汀和SGLT2抑制剂卡格列净组成,是日本市场批准的首个DPP-4/SGLT2复方药。该药的临床试验在接受替格列汀或卡格列净单药治疗但血糖控制不佳的日本II型糖尿病患者中开展,数据证实了Canalia的疗效、安全性和良好的耐受性。Canalia将由第一三共负责营销,田边三菱和第一三共共同推广。(三菱田边制药与第一三共制药新闻稿)。
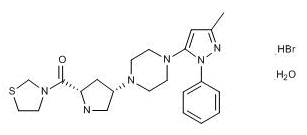
上图为Teneligliptin hydrobromide hydrate(替格列汀)结构
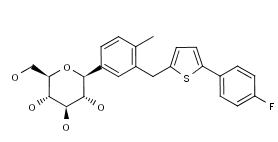
上图为Canagliflozin(卡格列净)结构
2017年9月13日,HT-074在胃溃疡实验模型中显示胃肠道保护作用
HT-074来自于Inulabritannica的花与Paeonialactiflora根部的提取物。这两种药物都是用于治疗消化系统疾病和促进血液循环的传统药物。研究人员测试了HT-074在3种大鼠胃溃疡模型中的活性,试图发现其对胃肠道保护作用的机制。3种模型的胃肠道损伤SD大鼠被分为5组进行实验,分别为安慰剂组、噢美拉唑20 mg/kg组(阳性对照),HT-074 30 mg/kg组,HT-074 100 mg/kg组和HT-074 300 mg/kg组。结果显示,HT-074对3种模型的大鼠均显示出胃肠道保护作用。在酸化乙醇损伤模型中,提前30min给予HT-074 300 mg/kg可以将损伤减少99.0%(对比安慰剂)。在吲哚美辛损伤模型中,HT-074 300 mg/kg可以将损伤减少78.5%。在水浸和约束应力模型中,提前1小时给予HT-074 300 mg/kg可以将损伤减少81.5%(对比安慰剂)。同时,HT-074还可以剂量依赖的增加胃黏液的生成。(Young-Sik, K. et al. 65th Int Congr Annu Meet Soc Med Plant Nat Prod Res (Sept 3-7, Basel) 2017, Abst PO-142)。
2017年9月27日,日本批准Cedarcure SLIT用于治疗日本雪松过敏
日本厚生省批准了用于治疗日本雪松花粉过敏的舌下免疫疗法药物Cedarcure片剂。该药由Torii Pharmaceutical公司研制并由ALK公司进行市场推广。Cedarcure已经被批准用于治疗日本雪松花粉症的成人和儿童的脱敏治疗,此次获批的舌下片剂也是首次用于成人和儿童的免疫疗法。该药的上市日期将由Torii公司在其价格和报销方式与国家健康保险达成一致后宣布。ALK公司将有权获得Cedarcure的销售版税。(ALK公司新闻稿)。
2017年9月22日,FDA批准了BioCryst公司的Rapivab用于儿科患者
FDA批准了BioCryst Pharmaceuticals公司的NDA补充申请,将治疗急性无并发症流感的神经氨酸酶抑制剂Rapivab(peramivir注射剂)的适用范围扩展至2岁及以上且症状不超过2天的儿科患者。该儿科用药的批准是基于对正在进行的儿科临床研究的阶段性数据分析,这些数据将在圣地亚哥举行的2017年感染病大会上发表。该药在2014年12月被首次批准用于18岁以上的成人(参见2014年12月22日的科睿唯安药物快讯;BioCryst Pharmaceuticals公司新闻稿)。
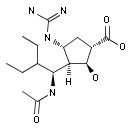
图为Peramivir结构
2017年9月8日,罗格斯大学发现可用于治疗肺结核的新化学实体。
罗格斯大学的科学家利用机器学习模型得到了具有结核分枝杆菌抑制活性的二氨基芳基-三嗪-硝基呋喃基腙类化合物,并经过优化后得到了一类嘧啶类化合物进行了体内活性实验。其中,化合物SF-331对结核分枝杆菌的MIC为0.11 mcM,MBC90为0.44-0.92 nM,对Vero 细胞的细胞毒CC50为280 nM。对小鼠进行5 mg/kg的静脉注射,其口服生物利用度为0.5%,半衰期为0.86小时。(Inoyama, D. et al. 254th Am ChemSoc (ACS) Natl Meet (Aug 20-24, Washington, D.C.) 2017, Abst MEDI 330)。
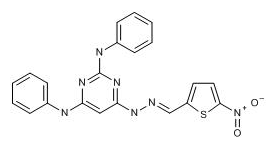
图为JSF-331结构
2017年9月13日,两个苯甲酰胺类化合物有望用于治疗精神分裂症
来自LB Pharmaceuticals公司和曼城斯特大学的研究人员发表了两个新颖的苯甲酰胺类化合物,LB-102和它的S-构型手性异构体LB-103,相比于现有的苯甲酰胺类抗精神病药物,它们具备更好透过血脑屏障的能力。研究人员制备他们的目的是为了研究化合物在与精神分裂症相关的受体上的活性、动物体内药效和口服药代动力学性质。在体外实验中,LB-102和LB-103对多巴胺D2受体的亲和力分别为2和0.5 nM,对多巴胺D3受体的亲和力分别为2.5和1.2 nM,与阳性药氨磺必利相当。在新事物认知实验中,两个化合物均和阳性药氨磺必利和利培酮表现相当;在自发活动实验中,30 mg/kg的LB-102可以抑制由D-安非他命诱发的自发活动增加,并能在更低的剂量达到更好的效果。LB-102口服后的血浆暴露量与氨磺必利相似,数据证实该药适合以口服方式使用。此外,在全身僵硬实验中,LB-102和LB-103与阴性对照一致,均没有显示作用。(Neill, J. et al. 30th CongrEurCollNeuropsychopharmacol (ECNP) (Sept 2-5, Paris) 2017, Abst P.3.c.005)。
2017年9月28日,新型的MABA支气管扩张剂CHF-6366具备体外和体内活性
Chiesi公司日前发表了一种在研的具有蕈毒碱性乙酰胆碱M3受体和beta-2肾上腺素受体(MABA)双功能拮抗活性的可吸入性支气管扩张剂CHF-6366,及其用于治疗慢性阻塞性肺病(COPD)的体内体外数据。在受体功能实验中,CHF-6366对人源M3, M2, beta2和beta1受体的亲和力pKi值分别为10.2,9.8,11.4和8.87,相比之下,阳性药batefenterol在上述受体的亲和力pKi值分别为9.2,9.1,9.6和7.2;AZS-2115在上述受体的亲和力pKi值分别为9.6,9.6,8.7和6.7。在离体的豚鼠气管上,CHF-6366能有效的抑制由卡巴胆碱诱导的组织收缩,在普萘洛尔参与或不参与的情况下,其对MABA和M3的抑制活性pIC50 分别为9.5和9.7;此外,CHF-6366也能抑制由组织胺诱导的组织收缩,对beta2受体的抑制活性pIC50值为10.1;相比之下,阳性药batefenterol在离体组织的pIC50分别为9.5, 9.1和9.8,AZD-2115的pIC50分别为8.8, 9.1和9.1。在离体豚鼠左心房组织中,CHF-6366可以微弱的抑制由卡巴胆碱诱导的心肌收缩抑制(M2受体拮抗活性pIC50为6.9)和收缩力增强(beta1受体激动活性pIC25为7.7),表明化合物具备心脏安全性。在由卡巴胆碱和组织胺诱导的人体支气管组织中,CHF-6366表现了对beta2受体和M3受体高活性和良好的平衡性,pIC50分别为9.0和9.2;相比之下,阳性药batefenterol的pIC50分别为8.4和8.1,AZD-2115的pIC50分别为8.8和8.8。在人体肺组织精细切片中,CHF-6366的pIC50为8.2,作用24小时后仍可维持60%的抑制率。CHF-6366在豚鼠和人体组织实验中显示出的长效支气管扩张作用,表明该化合物有望成为潜在的治疗慢性阻塞性肺病的药物。(Pastore, F. et al. 27th AnnuCongrEurRespirSoc (ERS) (Sept 9-13, Milan) 2017, Abst PA1805)。
在由乙酰胆碱诱导的麻醉犬支气管痉挛模型中,CHF-6366吸入给药后能够以比阳性药batefenterol高10倍的活性抑制支气管收缩。CHF-6366能够以1 mcg/kg的剂量对支气管起到保护作用,而要达到相同的作用,batefenterol的剂量需要30 mcg/kg,噻托溴铵需要2 mcg/kg。CHF-6366对心率和血钾含量的影响弱于batefenterol。在对支气管起到保护作用的24小时内,CHF-6366的剂量不会造成不良影响,CHF-6366和batefenterol全身性暴露量均很低。(Carnini, C. et al. 27th AnnuCongrEurRespirSoc (ERS) (Sept 9-13, Milan) 2017, Abst PA1804)。
在豚鼠支气管痉挛模型中,CHF-6366的药效比batefenterol更强且起效速度更快,两者起效均需要24小时以上的时间。CHF-6366表现了比batefenterol更好的对beta2受体的平衡性。该化合物仅在很高浓度下才会对血钾含量出现显著性的影响。此外,CHF-6366在上述动物的酰胆碱引起的流涎模型中均没有显示出抗毒蕈碱的潜在副作用。(Miglietta, D. et al. 27th AnnuCongrEurRespirSoc (ERS) (Sept 9-13, Milan) 2017, Abst OA4405)。
2017年9月27日,Chiesi公司发现的新型可吸入皮质类固醇在气道炎症模型中具有活性
在筛选了514个新结构化合物后,Chiesi公司的研究人员发现了一个糖皮质激素受体激动剂CHF-6162,其受体结合活性高于阳性药fluticasone和budesonide(三者IC50分别为0.24, 1.17和1.56 nM)。该化合物在由TNF-alpha诱导的人主动脉平滑肌的白介素-8释放实验和GR诱导的抗炎症GILZ基因表达实验,以及在外周血单核细胞中由LPS诱导的TNF-alpha释放实验中,均表现出与阳性药fluticasone相当的活性。CHF-6162在大鼠体内的暴露速度显示,其在肺组织中的浓度明显高于血浆(AUC分别为35.10和0.011 h•nmol/g;半衰期分别为12 h和0.61 h)。对大鼠给予CHF-6162后,检测支气管肺泡灌洗液的结果显示,其抑制卵清蛋白诱导的肺嗜酸性粒细胞增多症的活性高于阳性药fluticasone(EC50分别为4.0和59.0 nmol/kg)。在股骨生长板厚度的安全性评估中,经过7天的气管内给药后,CHF-6162的抑制率低于fluticasone。此外,在卵清蛋白诱导肺嗜酸性粒细胞增多的前24小时服用CHF-6162,可以抑制大鼠支气管肺泡灌洗液中肺嗜酸性粒细胞的增加(CHF-6162的抑制率为62.4%,fluticasone 为75.9%,fluticasone 为12.1%)。(Marchini, G. et al. 27th AnnuCongrEurRespirSoc (ERS) (Sept 9-13, Milan) 2017, Abst OA280)。
2017年9月19日,FDA批准TrelegyEllipta用于慢性阻塞性肺病
FDA批准了葛兰素史克公司的三联复方新药TrelegyEllipta(fluticasone furoate/umeclidinium bromide/vilanteroltrifenate)用于慢性阻塞性肺病(COPD)患者的每日1次长期维持治疗,还包括使用了固定剂量的fluticasone furoate和vilanterol来治疗气流阻塞和需要采用附加处理来减少病情恶化的慢性支气管炎或肺气肿患者,和已接受过umeclidinium治疗或固定剂量的fluticasone furoate和vilanterol治疗的慢性阻塞性肺病患者。TrelegyEllipta将很快在美国上市。TrelegyEllipta由3种成分组成,其中fluticasone furoate是可吸入的皮质类固醇,umeclidinium是一款长效的毒蕈碱拮抗剂,vilanterol则是一款长效的β2肾上腺素能激动剂,采用GSk的Ellipta干粉吸入给药器,每日给药一次。该药由GSK与Innoviva公司合作开发,且近期已经被欧盟推荐上市。(参见2017年9月15日的科睿唯安药物快讯;葛兰素史克和Innoviva公司新闻稿)
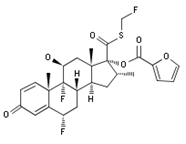
上图为Fluticasone furoate结构
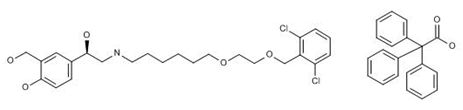
上图为Vilanteroltrifenate结构
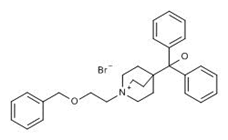
上图为Umeclidinium bromide结构
点击【阅读原文】可浏览中英文双语药物新闻
科睿唯安对本文的全部内容以及可能附带的全部资料拥有全部知识产权,并受法律保护。网络转载、编译及其他商业使用请联系市场部:[email protected]
■ 每周一至五, Clarivate Analytics药物新闻(Clarivate Analytics Drug News)精选最新、最重要的药物研发新闻在线发布,并以简明扼要的格式发送提醒邮件至您的邮箱,帮助您快速锁定重要的新闻事件。
■ 您可以在线检索我们所有的新闻资源,并设定检索条件(限定新闻发生的时间、药名、专利号、公司、大学、机构、治疗类别/分组、化合物类型、信息源)找到与您研究相关的内容。药物新闻(Drug News)内容可回溯至1996年,并可查看化学结构式。
■ 从海量信息源中总结出的摘要报告。
■ 在全球重要会议中披露的新闻信息。
■ 每周更新的邮件提醒服务,以表格的形式告知您进入临床前开发最有前景的化合物、lead compounds和最新的作用机制。
■ 每周更新的邮件提醒服务,告知您在研药物研发状态的变更。
















