
前言:肿瘤细胞分泌细胞因子,当然是为了获得生长优势并向远处转移...。拥有自己建立的“新生血管”,“自己的神经网络:
肿瘤构建自己神经网络的机制:轴突新生+神经新生
”,“分泌自己的抗体:
癌细胞分泌抗体与B细胞分泌抗体的差异
”...,抗击肿瘤的路上,还有很多事情要做...
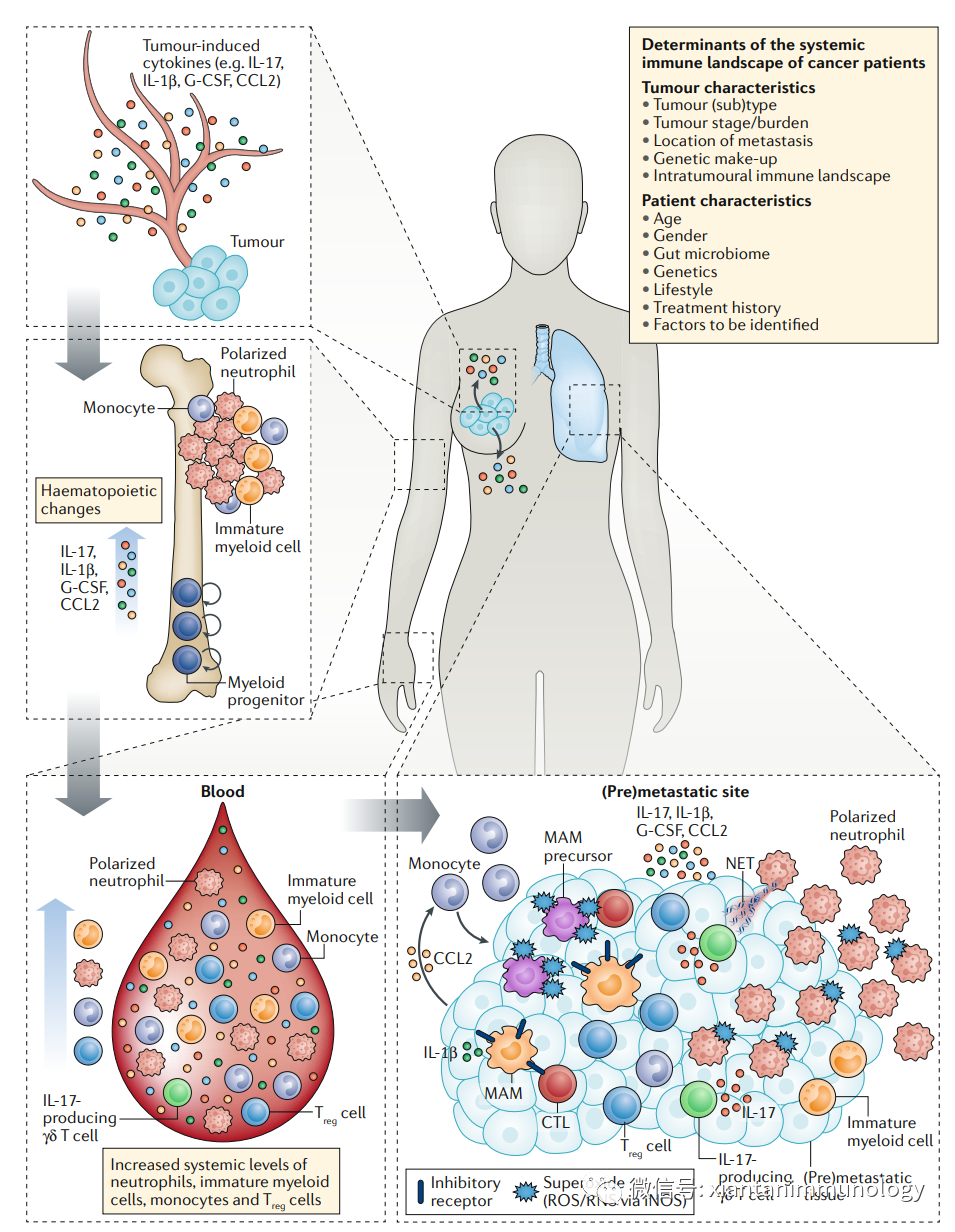
肿瘤患者的炎症不局限于肿瘤局部,而是全身系统性炎症,临床表现为
髓系细胞计数升高
。
肿瘤患者,循环中的高中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)与不良预后密切相关,临床前研究表明,中性粒细胞的全身动员促进了转移性扩散。在这个过程中,
肿瘤分泌的细胞因子“功不可没”
。
Nat Rev Immunol . 2020 Aug;20(8):483-497
在稳态下,健康的成人骨髓每天释放大约1-2×10^11成熟中性粒细胞。
在急性应激期间(如感染期间),骨髓开启一个动态的造血反应程序,以迅速和显著地增加髓系细胞的输出,
被称为
紧急或需求适应的造血
。这一过程的一个关键特征是在
外周血
中出现
未成熟的髓系细胞
(通常只存在于骨髓中),这种现象在临床上被称为“
左移”。
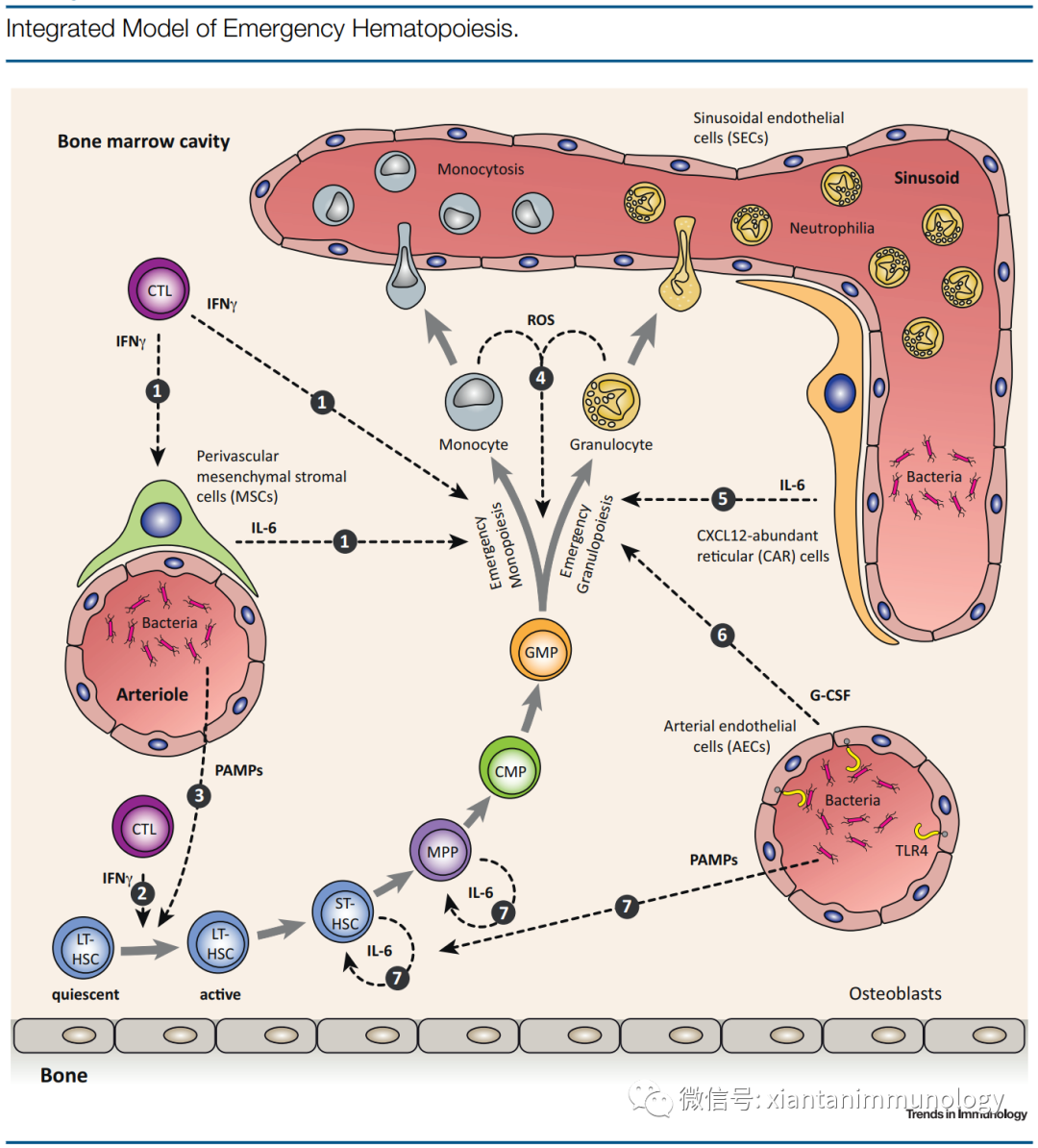
尽管中性粒细胞比例在小鼠和人不同(在人类,中性粒细胞占循环WBCs的60%,而在小鼠是20%),但是类似的髓系扩张和骨髓外检测到不成熟的髓系细胞,在癌症患者和临床前小鼠实体肿瘤模型都会出现。
肿瘤来源的
细胞因子(G-CSF,IL-1等)
,通过
迫使造血向髓系偏移
,
释放不成熟的髓系细胞
,产生免疫抑制表型,诱导免疫逃逸,为肿瘤转移创造一个有利的环境。
一项对小鼠和人类乳腺癌和胰腺癌的研究髓系祖细胞的后代,发现G-CSF驱动的免疫抑制髓系细胞的扩张,是以牺牲cDC1细胞为代价的,cDC1细胞是激活CD8+T细胞的关键DC亚群。
除了诱导造血向髓系分化,一些肿瘤来源的细胞因子和生长因子也调节来自骨髓的髓系细胞动员,例如,G-CSF动员中性粒细胞,CCL2动员炎症单核细胞。在稳态条件下,只有大约1%的成熟的中性粒细胞进入循环系统,大多数成熟的中性粒细胞被保留在骨髓中。G-CSF刺激骨髓释放中性粒细胞。
肿瘤产生的G-CSF水平的升高,有助于两个水平上的全身髓系细胞扩张:
通过使造血偏向中性粒细胞
和
加压骨髓以释放中性粒细胞
。在携带肿瘤的宿主中,这种压力可能是如此之大,以至于未成熟的髓系细胞也被释放。
循环中的中性粒细胞历来被认为只有非常短的半衰期;然而,肿瘤来源的趋化因子和细胞因子可以
延长中性粒细胞的存活时间
。这也是髓系扩张的另外一个因素。
系统扩张的中性粒细胞和单核细胞池向免疫抑制功能极化,通过
对抗抗肿瘤免疫反应来支持疾病的进展和转移的发展
。
促炎细胞因子
IL-1
可以由恶性细胞和肿瘤微环境中的细胞产生。肿瘤内和全身的高水平IL-1增加肿瘤分级和侵袭性,并与患者预后不良相关。(可以参考阅读:
IL-1促进肿瘤进展的机制
)
IL-1家族由一组细胞因子组成,其中IL-1α和IL-1β是被研究最多的成员。IL-1α或IL-1β与共享受体IL-1R结合,通过接头蛋白MyD88激活许多炎症信号通路,包括NF-κB、MAPK、AP-1和JNK通路。
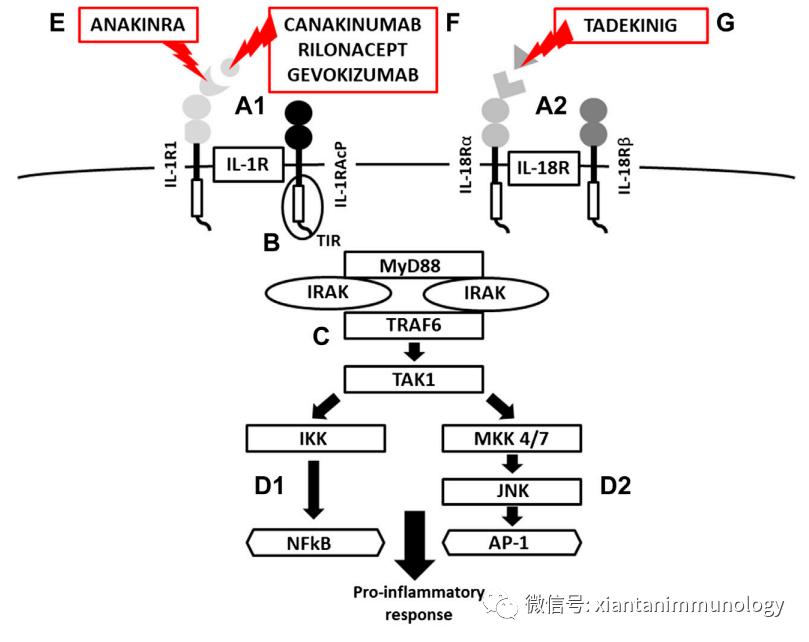
IL-1β可以通过直接诱导造血干细胞向髓系分化的偏倚,来增加循环中性粒细胞的数量,刺激TH17和γδT细胞产生IL-17,
IL-17水平的升高会刺激G-CSF的产生
。导致骨髓中中性粒细胞的释放增加。乳腺癌患者肿瘤组织中IL-17产生细胞数量的增加与预后不良有关,而癌症患者肿瘤内和血清中IL-17水平的升高被认为是预后不良的一个指标。
在自发性乳腺癌转移基因工程小鼠模型中,肿瘤来源的CCL2被证明通过刺激TAMs,增加的IL-1β产生,来启动这种系统性炎症级联反应。TAM来源的
IL-1β刺激
了γδT细胞中
IL-17的产生增加
,驱
动G-CSF依赖的中性粒细胞扩增
。此外,扩大的中性粒细胞数量通过产生iNOS来抑制抗肿瘤CTL反应,导致肿瘤转移增加。用靶向CCL2或IL-1β的中和抗体处理的小鼠显示,γδT细胞产生的IL-17减少,从而阻止了中性粒细胞的积累,而产生IL-17的γδT细胞和中性粒细胞的缺失减少了转移性肿瘤负荷。
CCL2–CCR2轴
趋化因子CCL2作为一种趋化引诱剂,引导Ly6C+单核细胞从骨髓到炎症部位。其在原发肿瘤中经常上调,其过表达与不良预后相关。














