主要观点总结
本文主要介绍了药品微生物检验中培养基的重要性及其适用性检查的相关内容。新版药典对培养基的适用性检查提出了更高要求。文章详细阐述了脱水培养基的质量控制,包括原料控制、制造工艺、质控放行、内部验收等方面的关键点和注意事项。同时,也提到了预制培养基的产类型及其质量控制挑战。最后介绍了石决明的背景和其在微生物领域的经验。
关键观点总结
关键观点1: 培养基在药品微生物检验中的重要性
培养基用于对药品中潜在的污染微生物进行计数和鉴定,其适用性检查是保证药品微生物检验质量的关键环节。
关键观点2: 新版药典对培养基的要求
新版药典提高了培养基适用性检查的频率,要求每批培养基配制灭菌后都要进行适用性检查。
关键观点3: 脱水培养基的质量控制
脱水培养基的质量控制包括原料控制、制造工艺、质控放行、内部验收等环节。其中,原料控制是关键,包括原料的凝胶强度和浓度调节。
关键观点4: 脱水培养基与预制培养基的区别
脱水培养基和预制培养基在产品形态和质量控制方面有所不同。脱水培养基需要自行配制和灭菌,而预制培养基则是商业化的成品。
关键观点5: 石决明的背景和微生物经验
石决明是微生物学领域的专家,具有多年的药品微生物检验经验。他提出的关于培养基质量控制的观点和建议具有很高的参考价值。
正文

培养基是药品微生物检验的重要组成部分,用于对药品中潜在的污染微生物进行计数和鉴定。按照中国药典中的要求,为了保证培养基的适用性,我们要对培养基的无菌性、促生长能力、抑制能力以及指示特性进行检查。一直以来,随着脱水培养基的大量使用,培养基适用性检查都是与灭菌锅的验证结合在一起进行培养基的质量控制。 2025年版中国药典通则1101、1105、1106和指导原则9203公示稿中明确修订“每批”培养基配制灭菌后都要进行适用性检查,表面上大幅提高了培养基适用性检查的频率。 
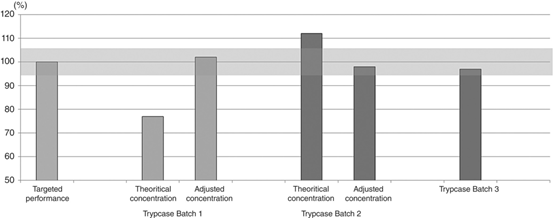
如果使用的是脱水培养基,每次微生物检验(无菌检查、微生物限度检查或其他)就意味着一次配制灭菌。而且如果不能提供内部存储的验证报告,培养基的适用性检查大概率是同步微生物检验进行,存在“一荣俱荣一损俱损”的风险。至于2020年版中国药典中刚刚修订收录的“商业化的预制培养基”,有区别于脱水培养基的产品优势。但是作为一个新的产类型,如果仅仅是参考药典中的内容进行内部质量控制还远远不够。 为了应对新版药典中培养基的变化冲击,我们需要加深对培养基的了解。接下来,石决明将针对脱水培养基和预制培养基的全生命周期进行讨论分析,期待为你形成一个全局的视野。 制作培养基的大多数化合物都来自生物来源(例如,琼脂来自石花菜及其他红藻类,蛋白胨来自动植物)。环境条件的变化将导致生物体新陈代谢的适应,并将改变所制造成分的最终性能,从而直接影响原材料的质量。国外一些老牌的培养基供应商几乎都是做原料起家的(相关链接:好的培养基从“卖肉”开始),由此可见一斑。 原材料成分的可变性直接影响脱水培养基的质量,为了保证每批脱水培养基的最佳性能,可能需要对原材料浓度进行调节。 例1:中美药典中的哥伦比亚琼脂培养基配方中的琼脂需要根据原料的凝胶强度的不同,调节琼脂浓度范围为10-15g/L。遍览国产的符合中国药典要求的哥伦比亚琼脂培养基配方,几乎都是15g/L,明显表现的是对于凝胶强度的不自信。而相应的符合美国药典的哥伦比亚琼脂培养基配方,却是10g/L。琼脂加的多固然能使最终的凝胶强度达标,但是琼脂浓度的高低也会对微生物的活动性能和菌落大小造成影响,尤其是浇注法的情况下。参考文献如下。例2:对不同批次的蛋白胨浓度进行的调整,以达到为培养基批次放行规定的目标性能,如下图。
培养基用酪蛋白胨的质量研究(下图)表明,促生长能力方面,国产酪蛋白胨与国外产品相当,回收率均大于80%;但是多个理化和微生物学指标分析结果表明,国产酪蛋白胨在工艺水平和批间质量稳定性方面还有提升空间。尤其是个别国产样品耐热菌数较高,达390cfu/g。 
原材料浓度调节是最优的方式,但是基于的是结果评价方式明确的情况下。而中国药典中规定了培养基的成分和具体重量,就没有了原材料浓度调节的可能。这样就需要培养基生产商对原料质量的波动性进行控制。这一点是脱水培养基生产商的关键参数,需要供应商审核时进行确认。 脱水培养基主要分为干粉培养基和颗粒培养基,制造工艺稍有不同。干粉培养基的制造工艺主要为球磨混合,按配方比例将原材料在一定转速下球磨混合均匀成干粉。颗粒培养基是将粉末混合物经过一种不含水和添加剂的辊压造粒工艺,使最终颗粒达到肉眼可见的1000μm以上。由于颗粒较大,在防止逸散和溶解性上有一定的优势。 脱水培养基的主要质量控制手段是原材料小量预实验,pH值需要在制造过程中调节好。干燥失重应控制在6%以下,只要保证好包装的密封性就可以在室温下运输保存。干燥失重或者水分含量都是水分控制的指标,随着水分活度概念的流行,更新为水分活度的控制更为合适。而且需要在稳定性检测项目中跟踪当前包装的密封程度下水分活度的变化。 脱水培养基生产完成之后需要取样进行理化检测和微生物检测。理化检测项目有外观色泽、初始pH值、透明度、凝胶强度(如含琼脂)和干燥失重(或水分活度)。微生物检测包括生物负载水平(尤其是耐热菌含量)、促生长能力、抑制能力和指示特性。具体检测结果最好都呈现在出厂报告(CoA)之上,并形成结论。 内部验收时确认包装密封后首先要核对脱水培养基的配方是否符合中国药典,检查脱水培养基的有效期以及贮藏条件,核对生产商提供的质控报告。然后按照中国药典的要求进行培养基适用性检查。 这只是基础要求,为了提高区分度,还要增加环境分离菌的检测。如下图的研究中,辅料中分离的人参土芽孢杆菌被用于辅料检测用TSA培养基的质量评价。这是非常明显的结果导向的评价方式。 
而对于用于药品的微生物检验用培养基来说,关注点应该是终产品的检验。增加的环境菌的选择应该遵循以下优先级(优先级由大到小): 产品中的污染分离菌
原辅料中的分离菌
生产环境中人源的分离菌
生产环境中设施设备的分离菌
如果环境分离菌太多,还可以引入水分活度的概念进行补充筛选:对药品的水分活度进行检测,筛选出相应的水分活度范围内微生物的类型。
从事微生物相关工作15年以上,做过体外诊断产品研发、成品培养基质量保证、产品仪器环境验证管理、药品微生物相关检验和洁净环境检测。一直在各个网络平台解读微生物基础知识的现代应用和微生物前沿知识的分享,致力于做接地气的微生物知识分享,说点不一样的微生物,对药品微生物检验技术有很多独到的见解和想法。 更多精彩内容也可关注:















