
1、
多个新型冠状病毒核酸检测试剂应急获批,现场快速检测产品(包括分子POCT和抗原/抗体POCT)有望加速上市。
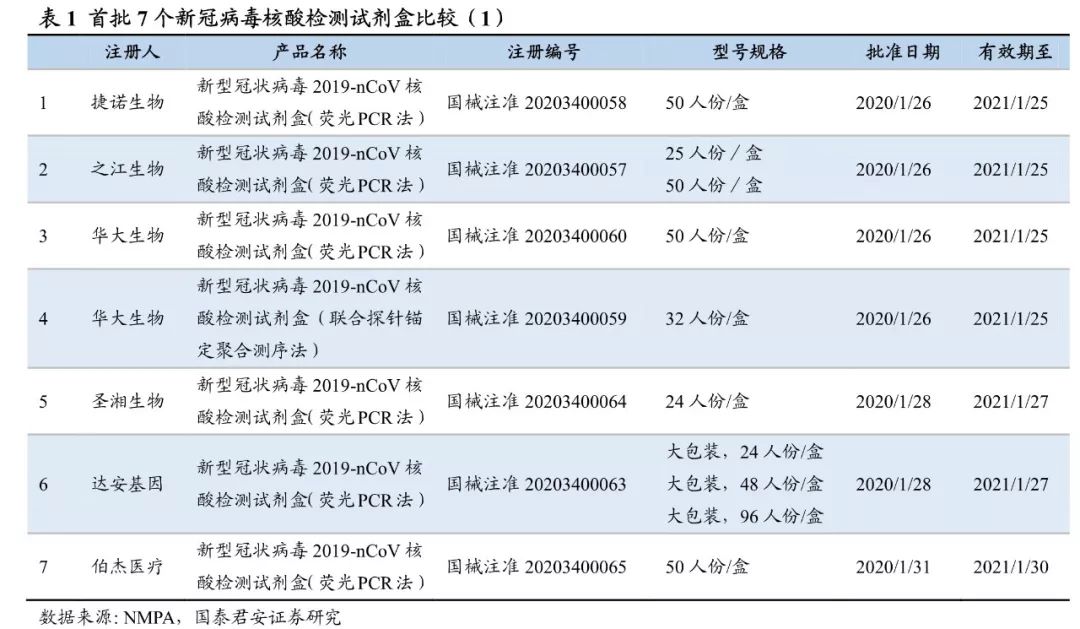
应对疫情CDC病毒病预防控制所发布毒株信息、核酸检测引物和探针序列,国家药监局启动应急审批程序,1月26日至2月1日共批准
7个核酸检测试剂盒上市
(包括之江、捷诺、华大、达安、圣湘、伯杰的荧光PCR产品和华大的测序产品),此外近百家企业亦研发成功
(仍需正式报批)。
普通实时定量荧光PCR核酸检测试剂的迅速上市和临床应用在患者临床诊断和疑似患者排查中发挥了重要作用,但是,受操作繁琐、耗时长、需要集中送检等限制,还不能满足当前快速增长的大量疑似患者、无症状感染者等排查诊断的检测需求。
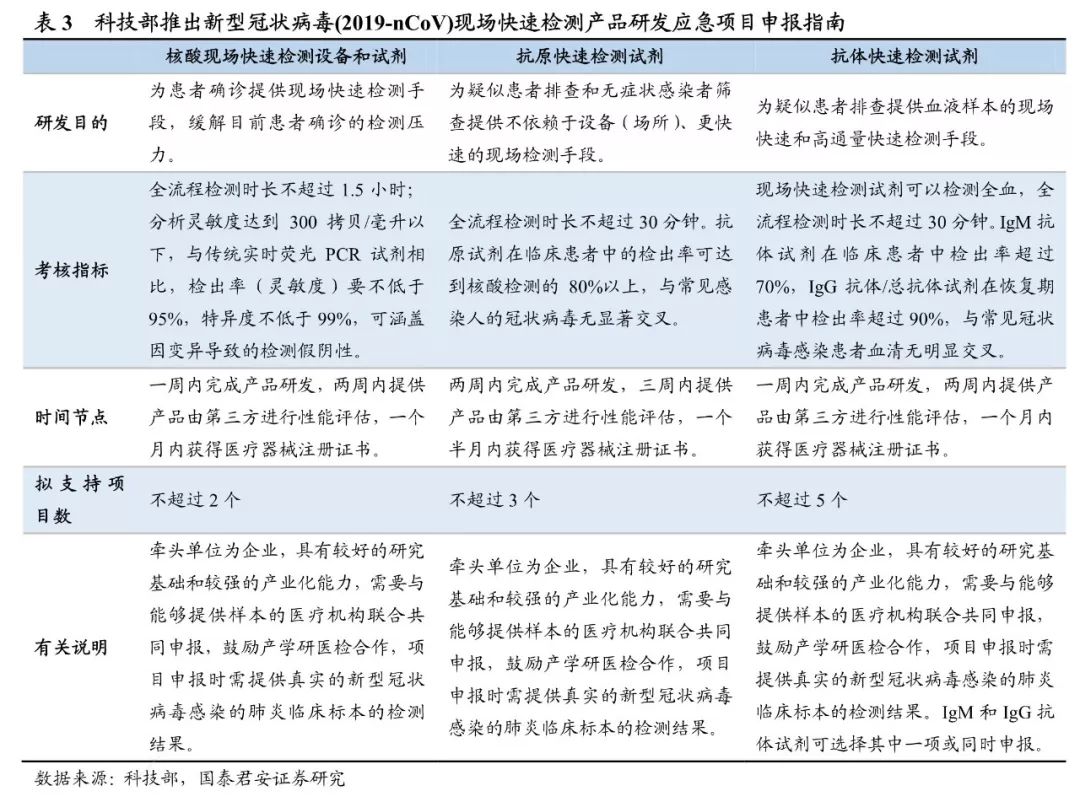
为此2月8日科技部发布新冠病毒现场快速检测产品研发应急项目申报指南,遴选项目择优支持,推动相关产品上市,突破现有检测技术对人员/场所的限制,缩短检测用时,提升便捷程度,推动诊断前移下移,实现疑似患者快速诊断和密切接触人群现场筛查,预计药监局将启动第二批相关检测试剂应急审批,目前万孚生物、热景生物等多家企业已完成抗原/抗体POCT(免疫层析法)、分子POCT产品的研发,其注册进程有望加快。
【如何理解目前媒体报道的核酸检测假阴性问题】
① 检验结果受病人疾病进程(感染早期病毒拷贝数可能较低、也有感染晚期虽未治愈检测为阴性的报道)、检测试剂(性能如灵敏度特异性、生产、质控、储存、运输)、样本处理(采集(新冠病毒多分布下呼吸道,而鼻咽拭子在上呼吸道采样)、保存、转运)、检验流程(
实验室和人员资质
要求较高,
核酸提取、加样、PCR扩增等操作技术要求高)多个环节影响,提升检测准确度可以通过多次检测、不同厂家验证、调整采样如肺泡灌洗液等方式。
②
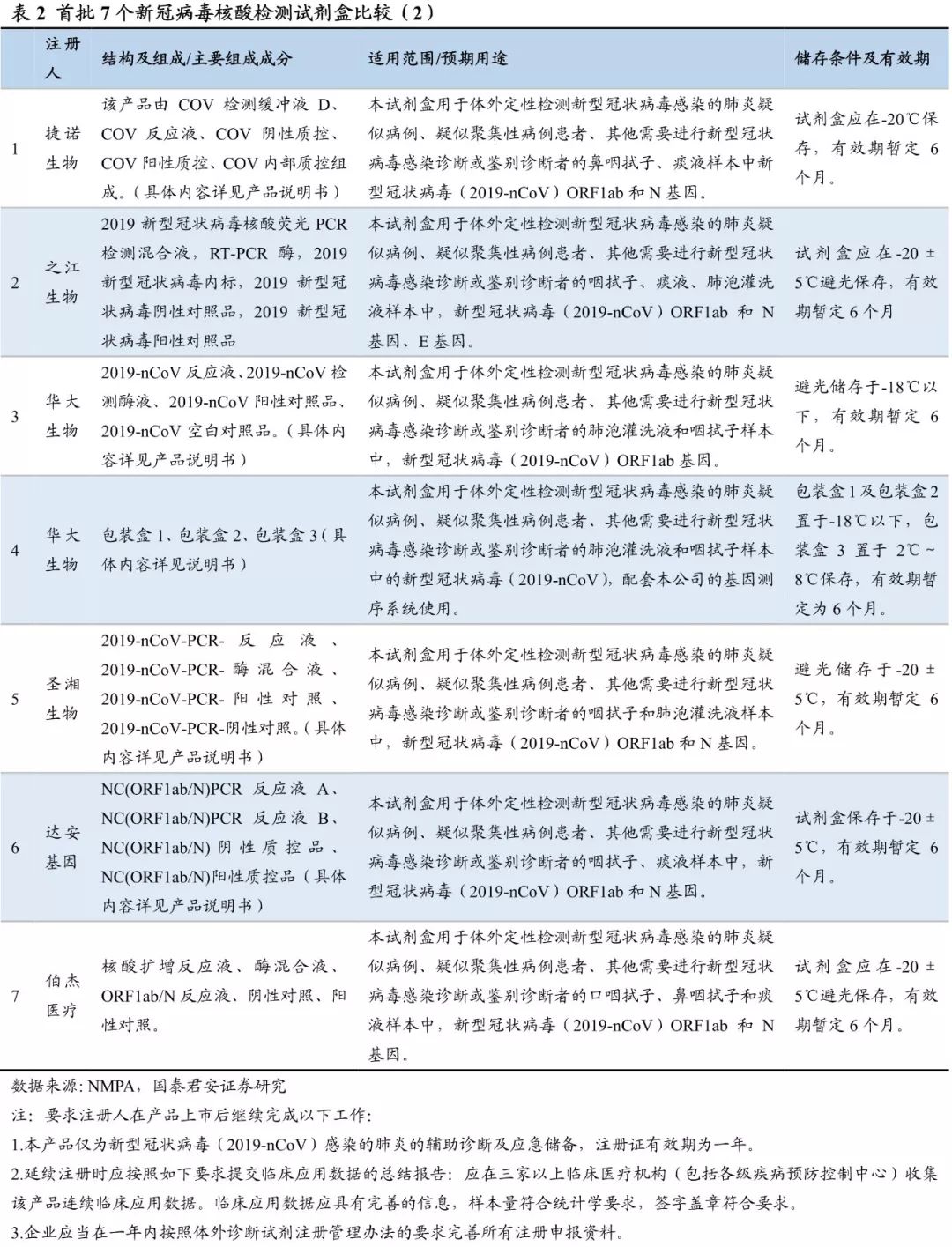
试剂本身研发难度不大,首批上市的7个核酸检测试剂由国家药监局应急审批,简化了部分流程(IVD三类试剂证研发上市通常需要3年时间,甚至更长)
,其产品注册信息显示:产品
注册证有效期为一年,
延续注册时应按要求提交临床应用数据的总结报告(
应在三家以上临床医疗机构收集该产品连续临床应用数据,
临床应用数据应具有完善的信息,样本量符合统计学要求,签字盖章符合要求)。目前上市试剂其优化、质控仍有较大提升空间,预计后续产品审批标准将进一步提高。
③
核酸诊断是传染病病原学检测的金标准(只要核酸检测阳性即提示具备传染性,以期做到早发现、早报告、早隔离、早治疗),但疾病诊断由临床医生结合病史、临床表现、实验室检查、影像学辅助检查等作出综合判断。此外快速检测产品,包括分子POCT、免疫学抗原、抗体POCT产品可以在
大量疑似患者、无症状感染者等排查诊断
中发挥重要作用。
2、
短期疫情相关的流感等呼吸道病原体检测和血液检测产品需求激增,长期看病原微生物分子诊断产品有望扩容。
与新冠病毒鉴别诊断的流感等呼吸道病原体检测、临床辅助诊断的血球、CRP、PCT等检测产品短期需求激增(有相关产品的包括万孚生物、安图生物、迈瑞医疗等)。
受疫情防控影响,医院其他科室门诊和检验量短期下降,后续有望逐步恢复。
疫情对公司短期影响是结构性的,产品线可能不同程度受终端需求、复工、排产、发货等影响,综合影响仍然有待观察。
长期看,CDC、医院和基层医疗机构病原微生物分子诊断检测能力有望进一步提升,带动相关诊断产品需求增长。
3、ICL全力支持各地战“疫”,弥补现有医疗体系检验能力不足,价值凸显。
目前全国各省市陆续发文允许和支持符合条件的第三方检测机构开展核酸检测,助力提升病毒感染确诊效率,为疫情防控提供保
障。
截至2月5日,金域医学共收到来
自广东、湖北、湖南、江苏、安徽、贵州、新疆、北京、重庆等9个省市区的授权或委托,陆续开展检测任务。公司
迅速整合集团资源,调动200多名PCR检验员、3000人医疗冷链物流团队,优化检测方法(速度提升5倍),全集团日检验样本能力可达7万人份,其中广东金域日产能1万例,武汉金域
单日检测能力逐步从当前的1000例提升到5000例以上。
短期看金域、迪安等公司新冠病毒核酸检测业务量
将明显上升,其他检测业务受医院门诊量下降影响(疫情结束后将逐步恢复),长期看,
ICL
在疫情防控工作发挥重要作用,有效弥补现有医疗体系检验能力不足,客户认可度和行业地位、影响力有望进一步提升。此外国家有望进一步加大医疗投入,尤其是感染性疾病防控工作,金域作为行业龙头,检验技术和人才储备丰富,有望发挥更大作用,长期价值凸现。
风险提示
:
产品放量不及预期;
部分产品需求短期受医院门诊量下降影响;部分产品可能受复工、排产、发货影响。
国君医药团队致力于专业、前瞻、深入研究,持续引领全市场医药研究!
|
特别声明:
本订阅号发布内容仅代表作者个人看法,并不代表作者所属机构观点。涉及证券投资相关内容应以所属机构正规发布的研究报告内容为准。
|















