摘要
行全髋关节置换术的患者多为老年人,且常合并心血管疾病、肺部疾病、高血压、糖尿病等,对麻醉和手术耐受能力较差。全髋关节置换术手术创伤大、失血量多,术中应用骨水泥可引起心血管不良反应,术后深静脉血栓和肺栓塞发生率高,手术麻醉风险较高。因此,术前应详细了解患者情况,对不同病情作出相应处理,并做好充分的术前准备。麻醉选择应视患者及手术情况而定。麻醉管理过程中加强呼吸与循环监测,密切观察手术操作步骤。在截除股骨头颈部,扩大股骨腔和修整髋臼时出血多而快,因此在此之前应适当予以补液扩容,如出现大量快速出血,则应及时回输自体血,必要时输注异体血。在应用骨水泥时增加吸入氧浓度,补足血容量,必要时给予升压药。
1. 病例介绍
患者男,78岁,主因“左下肢疼痛无力半年”入院。
既往史:高血压14年,最高达170/100 mm Hg(1 mm Hg=0.133 kPa),服用“卡托普利、硝苯地平缓释片”治疗,血压控制在140~150/80~90 mm Hg。冠心病5年,服用“硝酸异山梨酯、阿司匹林”治疗,控制尚可,日常生活轻度受限,平地步行500 m,缓慢上2楼,无静息性心绞痛。2型糖尿病10余年,使用胰岛素治疗,血糖控制良好。1年前在当地医院行“左侧股骨转子间骨折内固定术”。
辅助检查:轻度贫血,血红蛋白(Hb)116 g/L,空腹血糖8.6 mmol/L;超声心动图示主动脉瓣退行性变并轻度关闭不全,二尖瓣轻度关闭不全,左心房增大,心律失常,射血分数66%;心电图示心房纤颤,心室率98次/min,左心室高电压,ST-T改变,性质待定。
治疗:拟于全身麻醉下行空心钉取出术+左侧人工全髋关节置换术。
2. 麻醉管理
2.1 术前评估
2.1.1 实际麻醉术前评估
本例患者为老年患者合并高血压、冠心病、心房颤动、糖尿病,心功能Ⅱ级,高血压2级高危。根据2014年美国心脏病学会和美国心脏协会(ACC/AHA)发布的指南,考虑患者围术期发生主要不良心血管事件的风险升高。
手术方式为左侧股骨转子间骨折内固定物取出+左侧人工全髋关节置换术,预计手术时间为4 h,手术体位为右侧卧位。按照心脏风险分级,该手术为高危手术。
围术期可能发生的风险包括:心肌梗死、严重心律失常、血栓栓塞、脑出血及脑梗死、血电解质及酸碱平衡紊乱、高血糖、高渗性昏迷、低血糖及术后认知功能障碍。
2.1.2 术前评估分析
2.1.2.1 心血管风险评估
2014年ACC/AHA非心脏手术术前评估指南围术期心血管风险评估流程
第1步:若拟行手术的患者已经被确诊冠心病或具有冠心病危险因素,则应首先确定手术的急迫性。若需紧急手术,则应尽快确定可能影响围术期管理的临床危险因素,并根据患者的临床特征制定相应的监测与治疗方案;
第2步:若需尽快手术或择期手术,则需确定患者是否存在急性冠状动脉综合征。若存在,首先应根据现行指南原则予以最佳药物治疗,待病情稳定后再行手术风险评估;
第3步:若患者存在冠心病危险因素,则需根据其临床或手术危险水平评估发生主要不良心血管事件的风险。评估工具可采用美国外科医师学会手术质量改进项目(NSQIP)风险计算器,必要时辅以修订的心脏风险指数(RCRI)评估。若患者进行低危手术(如眼科手术),即便其存在多种心血管危险因素,术中发生严重不良事件的风险也很低;若患者进行大血管手术,即便其并存的心血管危险因素非常少,术中发生严重不良事件的风险仍较高;
第4步:若评估结果显示患者发生严重不良心血管事件的风险很低(
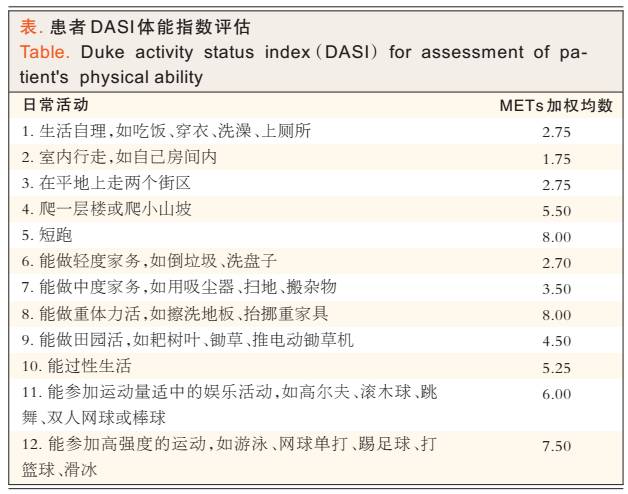
第5步:若患者发生严重不良心血管事件的风险增高,则需要进行客观检查或量表检测,如采用杜克活动度状态指数(DASI)(见表)对其进行功能耐量评估。若患者功能耐量为中等、良好或极好[≥4代谢当量(METs)],则无需进行更多检查,可直接考虑手术;
第6步:若患者功能耐量较差(
第7步:若进一步的评估性检查不会影响患者的决策,则在最佳药物治疗基础上实施手术,或采取替代治疗。
2014年ACC/AHA指南围术期心血管危险因素
① 冠心病:对于行非心脏手术的患者,其围术期与冠心病相关的并发症的处理较困难。冠心病的稳定状态和发生心肌梗死的时间,可影响围术期主要不良心血管事件的发病率和死亡率。建议未行介入治疗的患者应在心肌梗死发生后60 d以上再行非心脏手术。近期(术前6个月内)发生心肌梗死,是发生围术期脑卒中事件的一项独立危险因素,并且围术期死亡率将因此增高8倍。既往脑血管疾病病史的患者发生围术期主要不良心血管事件的风险增高。
② 心力衰竭:处于心力衰竭状态或者有心力衰竭病史是患者发生围术期并发症的重大危险因素。一项数据分析显示,非缺血性心力衰竭(9.3%)、缺血性心力衰竭(9.2%)和心房颤动(6.4%)患者术后30 d的死亡率明显高于冠心病患者(2.9%)[1]。左心室射血分数(LVEF)对接受高危手术的心力衰竭患者的术后转归和围术期死亡率有重要影响。LVEF≤29%的患者术后存活率显著低于LVEF>29%的患者[2]。
③ 心律失常和传导阻滞:一项使用连续心电图监护的研究表明,无症状的室性心律失常,包括成对的和非连续的室性心动过速,并不增加非心脏手术患者术后的心血管不良事件发生率[3]。但需辨别围术期心律失常是否由潜在的肺心病、持续的心肌缺血或心肌梗死、药物中毒或代谢紊乱所引起;对于临床情况稳定的心房颤动患者,围术期除了调整抗凝药物,无需纠正心房颤动也不需要进行特殊评估。但是对有形成左心房血栓风险的持续性心房颤动患者施行可能对心脏有物理刺激的手术操作,如胸内某些操作时,需慎重。完全性房室传导阻滞可能增加手术风险,需要安装临时或永久心脏起搏器。而室内传导阻滞,如无症状的左束支或右束支传导阻滞患者,围术期很少发展为完全性房室传导阻滞。
外科手术对心血管风险的影响
外科手术本身的危险性不同,必然会造成不同的心血管风险,许多资料都显示接受胸腹部及血管外科的重大手术患者,其心脏不良事件的发生率要远高于其他手术患者,这种情况在患者年龄超过70岁时尤为突出,Eagle等[4] 于1996年在循环医学杂志上将外科手术分级及其可能导致的围术期不良事件的发生率总结如下:① 高危手术(心脏风险发生率>5%):急症大手术、主动脉及大血管手术、长时间手术(>3 h)、大量失液失血手术;② 中危手术(心脏风险发生率
髋关节置换术创伤大,失血量多,特别是在截除股骨头颈部、扩大股骨腔和修整髋臼时出血多而快。老年患者常有血容量不足,加上心血管储备能力下降,容易出现失血性低血压和休克。因此,术前应对低血容量和电解质紊乱予以纠正,术中应加强监测,并及时补充血容量。全髋关节置换术中骨水泥植入后可引起不同程度的血流动力学紊乱,严重时可导致休克,甚至心功能衰竭,尤其是对于高龄患者。假体植入时,由于骨髓腔压力增加,会导致骨髓、脂肪和空气等进入静脉,从而导致呼吸循环障碍。据Woo等[5]统计,全髋关节置换术中心搏骤停发生率为0.6%~10%,而死亡率为0.02%~0.05%,且血流动力学的变化在注入骨水泥的即刻最明显,并持续15 min左右[6]。因此,在骨水泥注入前后应密切观察生命体征的变化,如出现低血压或心律紊乱,则应予及时处理。
综上所述,本例患者为高龄,有冠心病,劳力性心绞痛,心房颤动,拟行手术属于高危手术,预计术中可能出现大量失血。患者目前功能状态尚可,行麻醉及手术虽有一定的风险,但经妥善的准备和处理尚可耐受。
2.1.2.2 高血压患者的术前评估及危险分级
1999 年世界卫生组织制定的 《高血压联盟高血压治疗指南》指出,高血压病的风险除与血压水平相关外,还与心血管危险因素相关。主要的危险因素有吸烟、高血脂、糖尿病、年龄大于60岁、男性或绝经期女性、有心血管病家族史、靶器官损害(如左心室肥厚、心绞痛、心力衰竭及有冠状动脉重建术史)、脑血管意外、肾病、周围血管病和视网膜病等。参照以上原则,指南中将患者分为低危、中危和高危三组。因此术前访视时要对患者进行系统的体格检查和详细的病史询问,了解患者高血压的程度、当前的治疗情况以及慢性高血压导致的心、脑、肾等靶器官损害程度。
《2012中国高血压防治指南》指出了高血压的治疗目标:一般高血压患者,应将血压(收缩压/舒张压)降至140/90 mm Hg 以下;65岁及以上的老年人的收缩压应控制在150 mm Hg 以下,如能耐受还可进一步降低;对伴有肾脏疾病、糖尿病,或病情稳定的冠心病或脑血管病的高血压患者的治疗更宜个体化,一般可以将血压降至130/80 mm Hg 以下。对伴有严重肾脏疾病或糖尿病,或处于急性期的冠心病或脑血管病患者,应按照相关指南进行血压管理。对舒张压低于60 mm Hg 的冠心病患者,应在密切监测血压的情况下逐渐实现降压达标。对术前未经系统治疗、血压控制较差或高血压不稳定的患者,术中出现血压不稳定、心律失常、心肌缺血和暂时性神经系统并发症的风险较大。
本例患者合并糖尿病、冠心病,术前血压未达到治疗目标,应嘱患者继续应用降压药物至术晨,以避免突然停药引起的血压波动,利于维持术中血流动力学的稳定,减少术中心脑血管不良事件的发生。
2.1.2.3 合并糖尿病患者的麻醉前评估
轻型糖尿病或控制良好的糖尿病患者,无糖尿病并发症,这类患者对手术和麻醉的耐受性较好,围术期死亡率与常人无异。但病情较重或已出现糖尿病并发症的患者,如合并了心血管疾病,那么其病死率为常人5倍,手术和麻醉的风险增加[7]。所以,麻醉医师必须通过术前访视患者,充分了解病情。术前应详细了解患者的糖尿病类型,是否有低血糖、酮症酸中毒和高渗性非酮症昏迷等病史;了解病程的长短、血糖最高水平、当前控制血糖的方法(饮食、口服降糖药、胰岛素)及所用药物剂量;过去对麻醉和手术反应的病史及糖尿病慢性并发症状况,包括肾功能不全、感觉神经和自主神经病变、冠状动脉和外周动脉粥样硬化及缺血性心脏病,这些对麻醉处理影响很大,可增加麻醉危险性。
目前关于围术期糖尿病患者的血糖控制目标尚未达成共识,原则上应使血糖稳定在正常至轻度升高范围内,一般认为,糖尿病患者术前空腹血糖应控制在7.8 mmol/L以下,餐后血糖应控制在10 mmol/L以下。行眼科手术时则应控制在更接近于正常水平。行大、中型手术前一般应停止口服降糖药,长效磺脲类口服药应于术前48~72 h停药,短效磺脲类、胰岛素促泌素和二甲双胍可持续至术前一晚或手术当天,手术前是否停用噻唑烷二酮类药物尚无文献报告[8]。原已用胰岛素或原口服降糖药者于术前3 d改为三餐前短效胰岛素和睡前中、长效胰岛素或早晚餐前0.5 h预混胰岛素皮下注射方案。
2.2 术中管理
2.2.1 实际麻醉术中管理
选择气管内插管静吸复合全身麻醉。患者入手术室血压为165/97 mm Hg,心电图显示心房颤动,心室率105次/min,呼吸频率18次/min,脉搏血氧饱和度(SpO2)96%,以右美托咪定1μg∙kg-1 ∙h-1静脉泵注,10 min后,血压156/89 mm Hg,心率87次/min。局部麻醉下行桡动脉穿刺、置管,行有创动脉压监测。
2.2.1.1 麻醉诱导
采用依托咪酯14 mg,芬太尼0.3 mg,顺阿曲库铵14 mg,诱导后血压132/83 mm Hg,心率72次/min。可视喉镜辅助下用2%利多卡因行声门上、下表面麻醉,随后行气管内插管。诱导及插管过程中患者生命体征平稳。行右侧颈内静脉穿刺、置管,行中心静脉压监测,中心静脉压7 cm H2O(1 cm H2O=0.098 kPa)。
2.2.1.2 麻醉维持
术中以1%~2%七氟烷吸入复合0.05~0.15μg∙kg-1∙min-1瑞芬太尼持续静脉泵注维持麻醉,每隔40 min追加顺阿曲库铵4 mg。并以右美托咪定0.1 μg∙kg-1∙h-1持续静脉泵注至手术结束前1 h停止。术中血压91~152/58~93 mm Hg,中心静脉压5~10 cm H2O,心率61~83次/min。术中补液选用乳酸林格氏液和琥珀酰明胶注射液。
手术进行至1.5 h,出现急性失血,30 min内失血量达1500 mL,血压最低降至91/58 mm Hg,中心静脉压降至4 cm H2O,间断给予去氧肾上腺素将血压维持在120/65 mm Hg以上,根据中心静脉压快速输注乳酸林格氏液500 mL及琥珀酰明胶注射液1000 mL进行补液扩容,同时及时进行自体血回输,中心静脉压逐渐回升至6 cm H2O。血压趋于稳定,停用去氧肾上腺素可维持118~135/68~86 mm Hg。手术历时4 h,共输入乳酸林格氏液1500 mL,琥珀酰明胶注射液1500 mL,失血量2000 mL,回输自体血768 mL,输注悬浮红细胞2 U,尿量800 mL。术中多次进行血气分析,急性失血后Hb最低达73 g/L,血细胞比容(Hct)26.8%,进行自体血回输后Hb 89 g/L,Hct 28.2%,输注悬浮红细胞2 U后Hb10.1 g/L,Hct30.1%。术中未出现明显酸中毒及电解质紊乱。
2.2.2 术中麻醉管理分析
2.2.2.1 冠心病患者术中管理
冠心病患者行非心脏手术最危险的并发症是心肌缺血和心肌梗死,严重者可导致心源性猝死。因此麻醉的关键是保持血流动力学稳定,维持心肌氧供需平衡。心肌耗氧量的主要决定因素是心率、心室壁张力和心肌收缩力。心肌对血流中氧的摄取率较其他组织高,在安静时即可从冠状动脉中摄取70%~90%的氧,当心肌氧耗量增加时,进一步提高氧摄取率的能力有限,心肌氧供只能通过提高冠状动脉血流量来增加[9]。可从以下几方面降低心肌耗氧量:① 麻醉诱导及维持过程中应维持适当的心率:心率过快可导致心肌氧耗增加,还可因舒张期缩短而减少冠状动脉供血。尤其应避免插管刺激引起的血压升高,心率增快。插管前行咽喉部和气管内表面麻醉,同时应用足量的麻醉性镇痛药降低交感神经兴奋性,可取得良好效果,必要时可用β受体阻滞剂降低心率;② 降低室壁张力,可通过适当的液体管理,避免前负荷过高,也可应用硝酸酯类、钙通道阻滞剂降低前负荷;③ 降低心肌收缩力:可通过应用钙通道阻滞剂和吸入麻醉药抑制心肌收缩力。可从以下几方面增加心肌氧供:① 增加冠脉灌注压:冠心病患者心肌血流灌注的自动调节机制可能受到破坏,心肌的血流量呈压力依赖性,故围术期的血压应维持在较高水平,特别是合并高血压患者。但血压过高会增加心肌氧耗量,因此维持血压和心率的关系对维持氧供需平衡非常重要。应力争做到:血压变化不超过术前值的20%,平均动脉压(MAP)和肺毛细血管楔入压(PCWP)的差值(相当于冠状动脉灌注压)>55 mm Hg,MAP和心率的比值>l,维持收缩压在90 mm Hg以上,尤其应避免心率增快的同时血压下降;② 增加冠状动脉血流量:硝酸甘油和钙通道阻滞剂可扩张冠状动脉,防止冠状动脉痉挛,增加冠状动脉血流量;③ 增加氧含量:在维持足够血容量的同时,还应注意Hb的含量,及时输血[10]。
2.2.2.2 大出血患者术中血液保护
血液保护,首先要严格掌握输血指征,减少不必要的异体输血。国家卫生和计划生育委员会2000年发布的《临床输血技术规范》规定:Hb>100 g/L 时,可不输红细胞(RBC),Hb100 g/L 时不考虑输RBC,Hb 在60~100 g/L 之间时, 根据患者身体状况和血液丢失的速度综合考虑。
常用的血液保护策略有:
术前自体血储备 对于行择期手术的患者,在术前2周至4 周,分次采集患者自体血液并储存(通常为200~500 mL),术中根据情况将自体血液回输患者体内[11]。该方法可在患者行择期手术前诱发反应性RBC再生机制,并在术中为患者提供安全的血液制品。但术前自体血储备可诱发术前贫血,从而降低患者术中输血的阈值,因此该技术的应用仍存在争议。
血液稀释 使血液中有形成分相对或绝对减少,它可明显减少手术失血和异体输血,对缓解血源紧张有重要意义,包括急性等容性血液稀释(acute normovolemic hemodilution,ANH)和急性高容性血液稀释(acute hypervolemic hemodilution,AHH)。ANH 是在手术开始前预先从患者身上采集适当血量,同时输注等效容量的晶体液或胶体液维持循环,并于术中将采集的自体血回输给患者[12]。AHH 是通过麻醉后血管床容量扩张,行静脉输注一定量的晶体和胶体液(15~20 mL/kg)达到高血容量状态,使得血液稀释,从而减少出血时RBC的丢失,整个过程并不采集自体血液。
术中自体血回收 术中血液回收指通过血液回收装置收集术中失血,经滤过、洗涤和浓缩等步骤后回输患者体内,目前已广泛应用于预期失血量较多的手术。自体血回收能缓解血源紧张,可使60%~70%的患者避免异体输血[13],研究表明,在髋关节翻修手术中,应用术中自体血回输平均可以减少4个单位的异体血输入[14]。另外,自体血回收可避免异体输血引起的过敏、溶血和移植物抗宿主等不良反应,更突出的优点是能即刻提供完全相容的同型血液,快速恢复血容量和携氧能力,且比库血更安全有效[15]。
由于血液回收过程中丢弃了血小板和血浆成分,当出血量>3000 mL 时,血小板和纤维蛋白原将降低,需同时补充血小板和凝血因子,或输注新鲜冰冻血浆,以免发生凝血系统功能障碍。Kalra等[16]研究发现自体血回输后血小板及血浆纤维蛋白原水平明显下降,凝血酶原时间显著延长,但24 h后逐渐恢复至术前水平,一般回输血量少于3000 mL时虽血小板数量减少,但血小板功能基本正常。
总之,容量治疗是救治术中大出血及失血性休克最重要的措施[17]。容量治疗的首要目标是恢复正常的血容量,这样才能保证组织和器官的灌注,避免缺氧引起的酸性代谢产物蓄积。麻醉诱导前可以适当速度补充乳酸林格氏液或琥珀酰明胶注射液。术中监测中心静脉压、尿量、失血量、血压、心率以及皮肤状态指导输液、输血。当估计出血量达到全血容量的20%~25%时,应测定Hct和Hb,以便对失血量做出更加准确的评估,为输血输液和进一步治疗提供更可靠的依据。若出血量达到全血容量的35%~40%以上,或Hct
本例患者虽出现急性失血及Hb的迅速下降,由于麻醉后进行了适当的高容血液稀释,并在失血后及时以乳酸林格氏液和琥珀酰明胶注射液补充血容量,且采用自体血回输技术,及时将回收的红细胞回输,因此并未出现明显的缺氧,心电图亦未见心肌缺血或新发的心律失常表现。患者经自体血液回输后Hct已达到28%以上,但考虑到患者合并冠心病且髋关节置换术后引流量较大且存在隐性失血,所以给患者输注了2 U悬浮红细胞。
2.2.3 术中麻醉管理实践总结
老年患者合并冠心病、高血压且心电图示快速心房颤动,麻醉诱导前应用右美托咪定既可减慢患者心室率还可减轻患者的紧张情绪。麻醉诱导尽量选择对循环影响小的全身麻醉药物。气管内插管刺激较大,插管反应引起的心率增快、血压升高会增加心肌耗氧量,可能造成冠心病患者的心肌氧供失衡,插管前进行声门上、下表面麻醉,可以减轻插管反应。
行全髋关节置换术患者术前长期卧床,饮食量减少以及术前禁饮禁食,均可引起血容量相对不足,全身麻醉诱导后,术中髋臼及股骨上端髓腔扩大时失血较多,加上骨水泥的使用等,都可引起血压下降,从而影响心肌氧供需平衡。所以术中要及时纠正低血压和心律失常,避免心血管意外发生。早期主动扩容、适量补液,改善血液浓缩、尽可能减少麻醉药用量,将患者血压波动范围控制在术前基础值的20%以内。术中采用自体血回输技术及时将红细胞回输,必要时输注异体血,尽量维持Hct在28%以上,保证组织氧供。
老年人产热能力降低,若室温低、手术时间长、大量低温液体输注,加之血管扩张,很容易发生低体温。低体温可使药物代谢减慢,苏醒延迟,循环及凝血功能障碍,如果发生肌肉震颤时氧耗量增加,将尤其不利于冠心病患者。因此术中应积极采取保温和复温措施,防止体温下降。
2.3 术后管理
2.3.1 实际术后管理
手术结束前5 min停用七氟烷和瑞芬太尼,并将氧流量调至6 L/min。手术结束后,行气管内及口腔内吸痰,患者有轻微呛咳反射,10 min后患者自主呼吸恢复,潮气量150 mL左右,呼吸频率6次/min,呼之能睁眼,但不能按指令配合。手术结束25 min后,患者自主呼吸潮气量达400 mL,呼吸频率15次/min,能按指令举臂,拔除气管导管。予鼻导管吸氧2 L/min,SpO2可维持在99%,脱氧后SpO2可维持在96%,血压155/86 mm Hg,心率85次/min。术后40 min,将患者送回骨科监护室,予鼻导管吸氧,心电监护,给予患者自控静脉镇痛(PCIA)。术后第一天伤口引流量300 mL,查血常规Hb 92 g/L,Hct 28.5%,给予适当输液,患者生命体征平稳,精神状态可,未诉明显不适。术后第2、3天引流量约20 mL,于术后第3天拔除引流管,患者生命体征平稳,精神状态可,无胸痛、胸闷、呼吸困难等。
2.3.2 术后可能事件分析
术后可能事件包括凝血功能障碍、创面渗血、心肌梗死、脑出血、脑梗死、肺栓塞以及术后认知功能障碍,本例患者未出现上述事件,但应注意防范。
2.3.3 术后管理分析
2.3.3.1 围术期心脏并发症的术后危险因素
对于非心脏手术,术后心脏并发症的风险最高。术后心肌梗死一般发生在术后l周以内。尤其是术后3 d发生最多,症状常不明显,部分为无痛型。常表现为严重低血压,病死率较一般心肌梗死高,因此术后应加强心电图(ECG)、血压、心率监测,注意预防和及时发现术后心肌梗死的发生,并及时进行治疗,降低术后病死率。一方面防止心肌氧供不足,另一方面防止心肌氧耗增加。因此,应特别注意预防血容量不足或其他原因引起的低血压,一旦发生应针对病因及时纠正。防止高血压和心动过速。维持水电解质平衡,及时纠正脱水和低钾血症。充分给氧,预防肺部并发症。避免高热和寒战造成耗氧量增加。还应积极镇痛,消除患者紧张焦虑等因素。
2.3.3.2 术后肺栓塞的危险因素及预防
术后发生肺栓塞与下列因素相关:① 血液高凝状态:因禁食禁水、创伤修复凝血系统广泛激活以及应用止血药物引起;② 血流淤滞:长时间麻醉及术后制动导致下肢肌肉泵作用消失,术后局部组织水肿或微创手术人工气腹影响静脉回流;③ 血管内皮受损:术中牵拉、压迫和损伤血管。腹盆腔手术或骨科大手术更易造成上述三种情况,发生肺栓塞的风险更高。心房颤动患者不仅发生体循环栓塞的风险大大增加,也完全有可能在右心形成血栓并导致肺栓塞发生。
中华医学会骨科学分会率先在国内制定骨科大手术静脉血栓栓塞预防指南[19]。预防措施包括基本预防、物理预防和药物预防。基本预防包括手术操作轻柔、术后早期活动、适度补液等。物理预防(梯度加压弹力袜、间歇性充气压迫装置、足底静脉泵)仅用于有高出血风险的患者,一旦出血风险降低,应与药物预防联合应用。药物预防主要包括低分子量肝素、普通肝素、维生素K拮抗剂和Xa因子抑制剂[20],不推荐联合用药,否则可能增加出血风险。
2.3.4 术后管理总结
(此处内容略)
本文作者为郑州大学第一附属医院麻醉科杨晶晶、王艳萍、彭周全、张伟,本文已发表在《麻醉学大查房》上。
(《麻醉学大查房》原创作品,未经书面授权,其他公众号及网站等禁止转载。任何投诉、建议、投稿等事宜,请申请加微信号EBC0003为好友进行沟通!)

请长按上面图片,选择“识别图中二维码”,即可直接关注麻醉学大查房微信公众号(mazuixuedachafang)。

请长按上面图片,选择“识别图中二维码”,申请加医生及出版人YU为好友,会有意外收获。













