*仅供医学专业人士阅读参考


过去十多年,研究发现肠道菌群与人体健康及疾病有着复杂和紧密的关系[1]。
近年来的“明星肠道菌”——Akk菌,全称为嗜黏蛋白阿克曼氏菌(
Akkermansia muciniphila
),于2004年从人粪便中分离出来,是一种椭圆形革兰氏阴性细菌,名字就反映了它的习性,喜好黏蛋白[2,3]。
Akk菌虽然只占肠道菌群的3%,但其丰度与炎性肠病、肥胖和2型糖尿病风险呈现负相关性[4, 5],还与癌症免疫治疗中PD-1/PD-L1抑制剂的疗效有正相关性[6],有望成为下一代有临床应用前景的益生菌。
然而,Akk菌与人体互作机制仍未被解析清楚。已有研究发现,Akk菌通过调节宿主代谢起作用[7, 8],潜在的分子基础可能是Akk菌细胞外膜的一种蛋白[9],并且这种蛋白还可以调节宿主免疫应答[10]。小鼠研究表明,Akk菌能特异性地诱导T细胞的获得性免疫应答[11]。遗憾的是,这个研究没有找出Akk菌与T细胞作用的分子基础。但是,这些研究都强调了
Akk菌对宿主免疫系统的调节
。
近日,哈佛医学院的Jon Clardy和博德研究所的Ramnik Xavier教授领导的团队,通过细胞实验、基因组分析、光谱分析和化学合成等技术手段,发现
Akk菌通过细胞膜磷脂诱导人体免疫细胞对特定细胞因子的分泌,并且能重置树突状细胞的活化阈值,调控后续免疫刺激,从分子基础、作用途径和生物效应上阐明Akk菌的免疫调节作用。
该成果发表在
Nature
[12]。

文章截图
研究中使用的细胞实验技术是在3年前开发出来[13]。基本原理是在特定细菌提取物的刺激下,检测小鼠骨髓树突状细胞(mBMDC)分泌的细胞因子,以研究机体免疫细胞对不同分子物质的应答。树突状细胞是先天免疫系统的一部分,能识别病原体相关分子,并通过分泌细胞因子将信号传递到获得性免疫系统。
类似地,研究者将这套细胞检测技术用于研究Akk菌引起免疫应答的分子机制。在测试Akk菌培养液的多种成分(包括细胞团块和上清)后,研究者发现
一种有效成分能引发细胞产生促炎细胞因子——肿瘤坏死因子α(TNFα)。
质谱(MS)和核磁共振(NMR)的初步分析发现
有效成分中的主要物质是磷脂酰乙醇胺(PE)
。在细菌中,PE是细胞膜磷脂的主要成分。进一步的核磁共振分析确定了有效物质的分子结构如图1,在
标准脂质命名系统中的名称为a15:0-i15:0 PE
。典型的PE具有一个甘油核心,在sn-3位置上是磷酸乙醇胺,在sn-1和sn-2上分别有一个脂肪酸脂。
a15:0-i15:0 PE的特殊之处在于,两个脂肪酸支链上都有甲基,分别位于第12和13位置的碳原子。
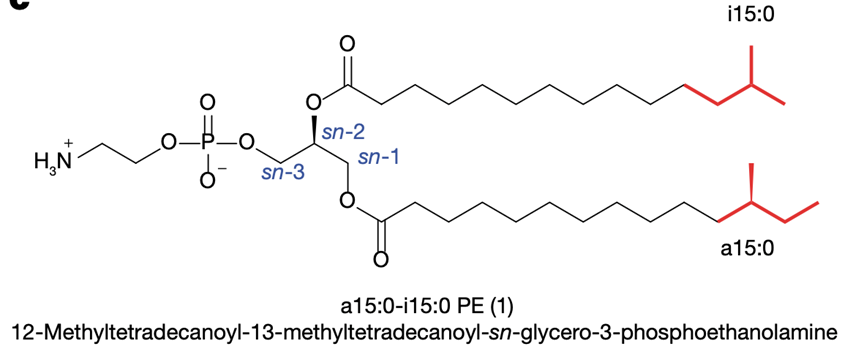
图1:有效成分a15:0-i15:0 PE的化学结构和化学名全称
功能强大的a15:0-i15:0 PE并不是随处可见!膜脂质能反映细菌的进化历史以及当前生存环境。在常见的肠道细菌中未发现a15:0-i15:0 PE,在能引起免疫反应的肠道细菌中也未找到。Akk菌隶属于疣微菌门(Verrucomicrobia),是肠道微生物中唯一一个来自疣微菌门的细菌[12]。在Akk菌中,a15:0-i15:0 PE是膜脂质的主要成分,占比约为50%。
这么有用的a15:0-i15:0 PE是否能被Akk菌合成呢?生物合成a15:0-i15:0 PE需要多个关联的生化反应,涉及多个反应酶。在Akk菌的基因组中,都能找到编码这些酶的基因,说明Akk菌具备合成a15:0-i15:0 PE的潜能。并且,在细菌培养实验中,研究者观测到Akk菌能合成a15:0-i15:0 PE,把“潜能”升级成了“硬实力”。
综上,从代谢分析、菌群系统发育位置、培养实验等多方面都揭示Akk菌能合成独特的生物膜磷脂。
免疫调控是个复杂而精细的过程,a15:0-i15:0 PE对细胞免疫应答是如何进行呢?在剂量-反应研究中,
a15:0-i15:0 PE除了能上调细胞TNFα的分泌水平,也能提升IL-6(白介素-6)的分泌水平,但不影响IL-10和IL-12p70的分泌水平
【图2】。
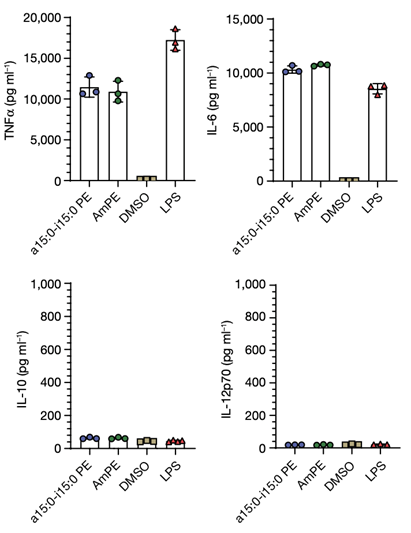
图2:a15:0-i15:0 PE能促进TNFa和IL-6的分泌,但不能促进IL-10和IL-12p70的分泌。AmPE表示Akk培养液中所有PE的混合物,DMSO和LPS是实验中的对照
树突状细胞对细菌代谢物的应答需要病原体相关分子模式(PAMP)受体,通常为Toll样受体2(TLR2)和Toll样受体4(TLR4)。通过小鼠基因敲除实验,研究者发现
TLR2是a15:0-i15:0 PE引起细胞应答的受体。
在既往研究中,TLR2也参与Akk膜关联蛋白(Amuc_1100)对宿主细胞的免疫应答[9]。
由于Akk培养液中存在污染物质,为进一步研究化学构效关系(SAR),研究者通过化学合成方法,人工制备a15:0-i15:0 PE。经测试,人工合成的a15:0-i15:0 PE具有与天然产物一致的光谱、色谱和生物特性。
既往化学构效关系研究指出,TLR2需要与TLR1或TLR6结合成异二聚体来产生免疫信号[14]。通过CRISPR-Cas介导的基因敲除技术,研究者发现
TLR2-TLR1异二聚体是a15:0-i15:0 PE引起细胞免疫反应的关键
【图3】。
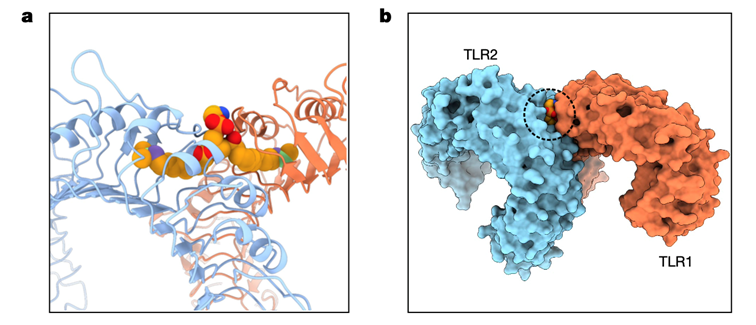
图3:TLR2-TLR1异二聚体复合物与a15:0-i15:0 PE的复合物结构
a)图基于PDB结构图展示,b)图中的圆圈标记出作用的脂质
以上实验是在小鼠来源细胞进行,在人源免疫细胞是否也能引发特异性反应呢?研究者从人外周血提纯的单核细胞,用天然和人工合成的a15:0-i15:0 PE分别刺激,发现了与小鼠细胞中类似的信号:TNFa和IL-6转录水平被显著上调, IL-23、IL-23A和IL-12B异二聚体的转录水平只有轻微变化。这表明,
Akk菌也能通过a15:0-i15:0 PE引发人体免疫细胞的特异性应答。
最后,研究者在人单核细胞衍生出的树突状细胞(MDDC)中测试a15:0-i15:0 PE对两种典型免疫原的作用:Pam3CSK4(激发TLR2-TLR1)、LPS(激发TLR4)。
当对实验过程的剂量和时间进行多次尝试和控制后,研究者发现
低剂量的a15:0-i15:0 PE处理能抑制18小时后Pam3CSK4和LPS引起的免疫应答,并且这个抑制作用在高剂量a15:0-i15:0 PE刺激和短间隔时间下不出现。
这表明低剂量a15:0-i15:0 PE能“钝化”细胞对其他免疫原的反应,一方面能忽略低剂量刺激,另一方面能缓和高剂量刺激,这可能是Akk菌对免疫调节的潜在机制[15, 16]。
该研究发现和合成Akk菌引发细胞免疫应答的分子物质基础,并揭示免疫应答需要的TLR2-TLR1异二聚体,还描述了低剂量刺激对细胞水平免疫应答的影响。
这为理解Akk菌对人体健康和疾病的影响提供了一个全景图:从分子物质基础、作用途径到生物效应。















