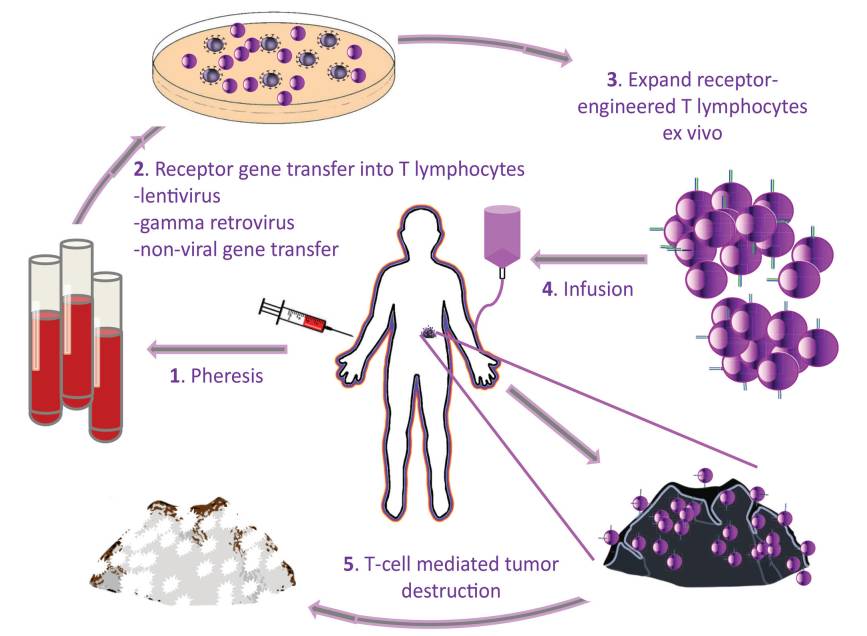
今天美国FDA正式批准诺华的CAR-T细胞产品CTL019上市,商品名是Kymriah,适应症是儿童或年轻患者的复发或难治性的急性B细胞型淋巴性白血病(ALL)。
FDA新任局长Scott Gottlieb表示:
我们进入了一个新时代,现在,我们可以通过改造肿瘤患者的免疫细胞来治疗这该死的癌症!
图片来源:网络
Kymriah的上市具有里程碑式的意义,标志着CAR-T细胞治疗的疗效、安全性和整个商业化流程都获得了FDA的正式认可,部分淋巴瘤患者迎来了靠谱的“活细胞治疗药物”;同时,还会对其它细胞治疗(比如我们大家关注的T-CRT/TIL等)产生积极的影响,加速更多细胞治疗产品的上市,造福肿瘤患者。
欢欣鼓舞的同时,大家也要注意价格,略震撼。据了解,Kymriah的价格是47.5万美元,人民币大概320万,好在美国人民有医保。其实,之前有人预测Kymriah的价格是60-70万美元,这个最终定价相当于内心预期价打了七折了呢,应该还是值得高兴的吧……
Kymriah用药剂量:
疗程包括首先进行淋巴细胞清除化疗:氟达拉滨(30mg/m2,静脉注射,每天一次,连续4天)联合环磷酰胺(500mg/m2,静脉注射,开始注射氟达拉滨时每天一次,连续2天)。淋巴细胞清除化疗完成后的2-14天内,静脉注射Kymriah。
Kymriah给药:
给药前准备:
Kymriah解冻后可在室温(20-25℃)保存30分钟,因此需在患者治疗准备全部完成后确定解冻时间。
给药前准备好托丽珠单抗及必要急救设备;
给药前30-60分钟先给患者术前用药对乙酰氨基酚和苯海拉明或者其他H1抗组胺药物;
由于Kymriah是自体T细胞疗法,包装袋是病人专用的。给药前应确认袋子上患者信息;
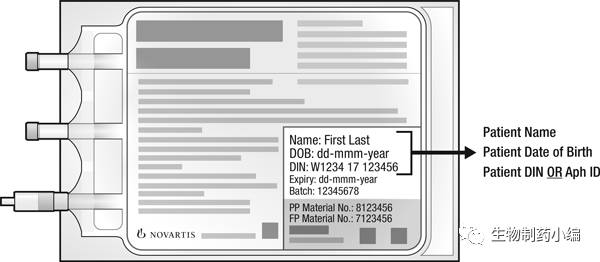
注射前要检查包装袋是否有破损,如有破损,不要给药。拨打诺华电话1-844-4KYMRIAH;
如包装袋有泄露,应转移到其他无菌袋中,避免污染;
37℃水浴或者干法解冻,知道无可见冰。切勿在37℃保存,一旦放置在室温条件(20-25℃),应在30分钟内给药;
肉眼观察解冻后有无细胞团,小的细胞团在手动轻摇后可消失,如果细胞团不消失,请勿给药。拨打诺华电话1-844-4KYMRIAH。
给药
副作用应对
CRS严重程度 | 应对措施 |
前驱症状: Low-grade的发热、疲劳、厌食
| 观察,避免感染,如中性粒细胞减少给予抗生素,对症治疗 |
明显的CRS: 高热、缺氧、轻微低血压
| 退烧药、给氧、静脉输液和/或低剂量升压药物(如有必要) |
危及生命的CRS: 使用升压药物血液动力学仍不稳定; 不断恶化的呼吸困难, 快速的临床恶化进展。 | 高剂量或多次升压药物、给氧、机械通气及其他必要措施。
给药托利珠单抗: 30kg以下,12mg/kg,超过一小时时间内静脉注射给药; 30kg以上,8mg/kg,超过一小时时间内静脉注射给药(最大剂量800mg) |
难治性CRS: 使用前述方法12-18小时内无改善或恶化 | 高剂量或多次升压药物、给氧、机械通气及其他必要措施。
2mg/kg甲泼尼龙起始剂量,随后2mg/kg每天给药,直到不再需要升压药物,迅速减量。
如果24小时内激素无响应,重复给药托利珠单抗: 30kg以下,12mg/kg,超过一小时时间内静脉注射给药; 30kg以上,8mg/kg,超过一小时时间内静脉注射给药(最大剂量800mg)。 如果第二次托利珠单抗24小时内不响应,考虑第三次给药托利珠单抗或寻求其他应对CRS的治疗措施。 |
Kymriah制剂
Kymriah除了T细胞以外,可能存在部分其他单核细胞,如NK细胞、B细胞等。Kymriah制剂处方如下:
成分 | 体积比例 |
Plasma-Lyte A | 31.25% |
5%葡萄糖/0.45%氯化钠 | 31.25% |
葡聚糖40(LMD)/5%葡萄糖 | 10% |
25%人血白蛋白 | 20% |
DMSO | 7.5%
|

西比曼成立于2009年,专注于打造多元化细胞治疗技术平台——肿瘤免疫细胞治疗技术平台和干细胞技术平台,2014年在美国纳斯达克挂牌上市,成为首个在纳斯达克上市的中国细胞治疗生物医药科技公司。
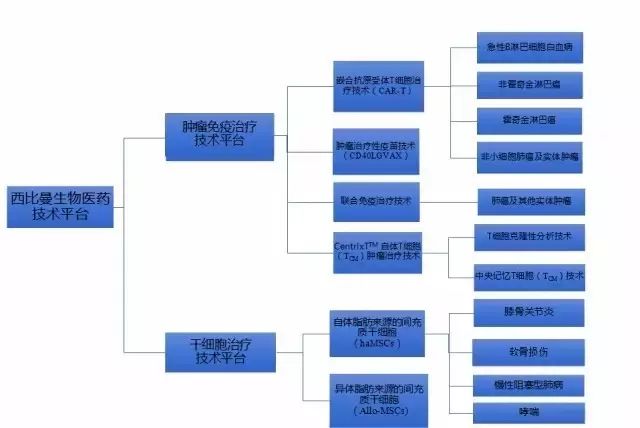
西比曼在CAR-T疗法的临床试验主要集中在I/II期,涉及产品有:
CBM-C19.1:急性B淋巴细胞性白血病
CBM-C20.1:非霍奇金淋巴瘤
CBM-C30.1:霍奇金淋巴瘤
CBM-EGFR.1:实体肿瘤
2015年2月,西比曼以1200万收购了解放军总医院(301医院)韩为东教授组的4项CAR-T产品,并保留后续产品的优先收购权。公司目前主要与与中国人民解放军总医院(301医院)合作开发嵌合受体T细胞(CAR-T)治疗血液瘤及实体肿瘤的临床研究。
南京传奇生物科技有限公司是今年ASCO年上的黑马,这家低调的公司成立于2014年,是南京金斯瑞生物科技有限公司的全资附属公司,专注于研究和发展CAR-T免疫治疗,在多发性骨髓瘤的治疗上展现了非常优异的成绩。
图片来源:南京传奇生物科技有限公司
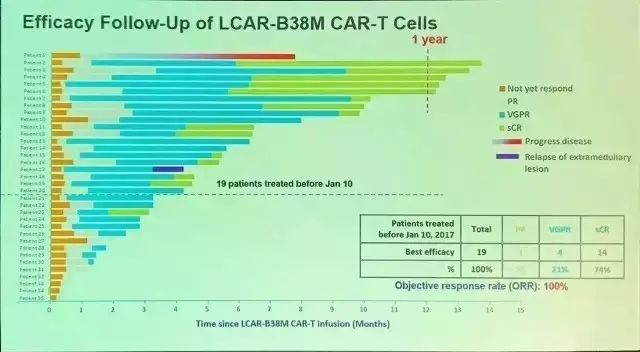
LCAR-B38M是南京传奇研发的一款靶向BCMA的CAR-T疗法。根据数据显示,在一项35例复发性或耐药性多发性骨髓瘤患者参与的临床试验中,该疗法的客观缓解率达到100%。在最早接受治疗的19例患者中,南京传奇对其观察随访4-14个月以上。其中14名患者持续达到严格完全反应诊断标准,5位出现部分缓解。

科济生物医药成立于2014年,已开发出针对多种恶性实体肿瘤的CAR-T免疫疗法。公司拥有一整套人源化抗体及全人抗体筛选平台,从杂交瘤平台和噬菌体文库筛选得到的抗体通过进一步的优化提高特性。
针对CAR-T在实体瘤中遭遇的肿瘤组织的浸润屏障与复杂的免疫微环境对CAR-T杀死癌细胞的影响,科技生物医药通过结合诸如IL-12趋化因子受体或细胞因子弥合先天和适应性免疫增加对实体瘤的杀死疗效。
科济生物医药目前拥有大量在研项目,大部分已经处于临床Ⅰ期阶段,并且已将全世界第一个针对肝细胞肝癌(HCC)以及针对多形性脑胶质瘤(GBM)推上临床研究阶段。
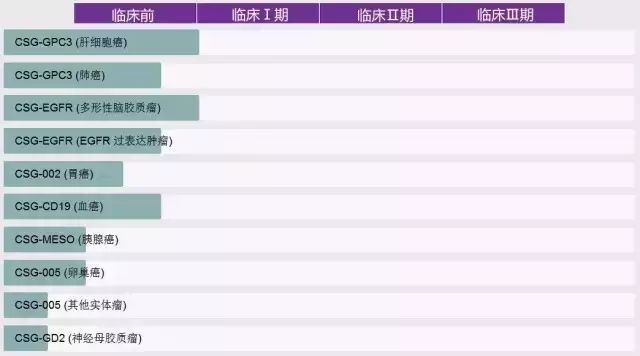
科济生物医药候选产品管线
创新技术、多管齐下的研发管线以及经验丰富的创始团队,使得科济生物医药深受资本市场的青睐。2014年11月科济生物医药完成A轮融资。2016年1月25日再次获得3000万美元的B轮融资,由韩国最早的风险投资公司KTB Ventures以及Jolly Innovation Ventures领投,Kaitai Capital和JIC Genesis Fountain Healthcare Ventures等参投。

博生吉作为先行的国内免疫细胞疗法开发公司,拥有国内首家CAR-T细胞/CAR-NK细胞技术服务平台。2015年6月,安科生物拟出资2000万增资博生吉,增资完成后将持有博生吉15%的股份,并受让博生吉拥有的部分细胞免疫治疗技术、产品及相关技术成果。
目前,博生吉已经成功构建了CD19、CD138、CEA、HER-2等多个靶点的CAR,博生吉产品与技术主要包括:(1)细胞治疗技术与产品:CAR-T技术、CAR-NK技术、CTL技术、DC-CTL技术;(2)抗体靶向药物:免疫检验点抗体、纳米抗体等。据了解,博生吉目前已经有3个CAR-T项目处于临床II期,研发进度在国内处于领先位置。

吉凯基因成立于2002年,专注于疾病关键基因研究的综合服务。近年来吉凯基因将CAR-T细胞免疫治疗作为重点发展战略,以“CAR-T细胞免疫治疗技术”的临床转化为目的,提供CAR-T细胞制备工具、临床前体外细胞实验、临床前体内验证实验等服务,后期也为联合申请临床试验提供技术支持。
吉凯基因的CAR-T技术平台涵盖了从一代CAR到四代CAR的构建技术,目前主要以临床试验效果最好的二代CAR结构为主,构建了从血液肿瘤到实体肿瘤多种不同的靶标scFv-CAR库。

吉凯基因的研发管线
此外,吉凯基因已与长海医院血液科合作开展CD19-CART治疗复发难治B-ALL, CLL和B-NHL的临床试验研究,美国clinical trial注册的临床试验号为:NCT02672501,已招募受试者14名,其中12例患者完全缓解至今无一例病人出现严重并发症而死亡。

恒润达生以肿瘤免疫治疗技术研发为主业,同步转化国内外最新的肿瘤免疫治疗的进展。这家由顶级海归和本土精英共同创办的研发企业已经形成了CAR-T技术为主导,CAR-NK,新型DC疫苗和iNKT等多个研发项目并行推进的研发格局。
目前,恒润达生已布局多项CAR-T细胞研发产品线,涉及适应症主要在多发性骨髓瘤、成人及儿童B细胞白血病,B细胞淋巴瘤等。

恒润达生的研发产品线及进度
2016年2月,恒润达生在ClinicalTrial上成功注册3个CAR-T治疗B细胞淋巴瘤临床试验。其中,MatchCAR (NCT02685670)试验已在国内临床试验基地入组复发难治性B细胞白血病患者共15例,11例回输患者均达到完全缓解。MeCAR (NCT03652910)试验也已在国内临床试验基地入组复发难治性B淋巴瘤患者10例,完成回输的患者8例。

波睿达生物成立于2014年9月,致力于CAR-T技术的临床应用,目前已拥有CD19、CD20、 CD22、CD30、CD33等多项自主研发的CAR-T免疫细胞治疗技术,在CAR基因工程载体制备、病毒包装、CAR-T制备、临床应用等方面有完整工艺和流程,并已成功开展临床应用。
公司建立了完整的CAR-T技术转化医学研发平台,积极进行的下一代CAR-T技术研究开发,包括新特异靶点的CAR-T(如CD123、BCMA、TIM3等),免疫增强型CAR-T,可调控型CAR-T等。同时,公司还致力于免疫细胞对其它疾病的治疗研究,如I型糖尿病、强直性脊柱炎、特发性血小板减少性紫癜、红斑狼疮等。
2016年12月30日,波睿达生物宣布获得北京惠诚基业投资管理有限公司2000万元的投资。

斯丹赛由“国家杰出青年基金”获得者肖磊博士创建于2009年8月,清晰定位CAR-T细胞治疗领域,在细胞治疗、干细胞和基因编辑等领域申报了30余项美国、中国、以及PCT发明专利。
截止2016年8月,斯丹赛在国内多家三甲医院开展的多中心临床试验的26例入组急淋白血病患者中,有21例获得完全缓解并达到微小疾病残留阴性,完全缓解率为80.8%,病人6个月整体存活率为69.0%。
淋巴瘤方面,斯丹赛近期开展的两例复发难治淋巴瘤临床试验的患者经过CAR-T治疗也都取得了完全缓解。
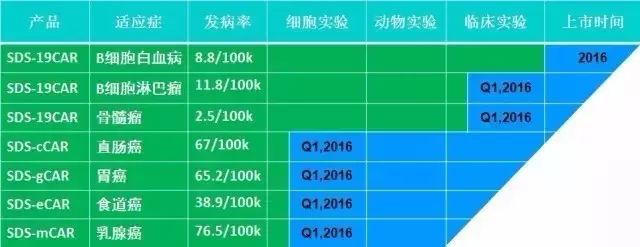
斯丹赛的研发管线
结语:除上述的几家公司之外,国内还有一些布局CAR-T免疫疗法的公司,例如复星医药、药明巨诺、中源协和、深圳市合一康生物科技股份有限公司、上海宇研生物技术有限公司、深圳源正细胞医疗技术有限公司等。
来源:咚咚癌友圈、生物制药小编、火石创造
识别微信二维码,添加抗体圈小编,符合条件者即可加入抗体圈微信群!
请注明:姓名+研究方向!















