
胰腺中的胰岛结构,是关键性内分泌器官,其中β细胞通过分泌胰岛素,调节体内葡萄糖稳态。II型糖尿病(T2D)主要发病因素之一就是糖代谢紊乱,而β细胞功能及胰岛素分泌异常是其中的重要因素。近年来,研究发现mRNA的m
6
A甲基化修饰能够调节mRNA的亚细胞定位、稳定性、和翻译效率,从而参与调控一系列生物学过程。目前为止,m
6
A修饰在胰岛中β细胞的生物学功能及调控机制尚未被发现。本研究中,研究者通过进行mRNA的甲基化组测序,分析了糖尿病患者和健康人群胰岛中m
6
A甲基化差异;此外利用体外EndoC-βH1 β细胞模型以及小鼠β细胞Mettl14 特异性敲除模型进行验证,揭示了m
6
A通过调节Insulin/IGF1-AKT-PDX1信号通路基因表达进而调节胰岛中β细胞的细胞周期、胰岛素分泌等生物学功能。
N6-methyladenosine:
m
6
A,N6位腺嘌呤甲基化
Type 2 diabetes:
T2D,II型糖尿病
METTL3/14:
m
6
A甲基化催化酶-methyltransferase like 3/14
1:RNA m6A测序分析T2D患者胰岛修饰差异
通过转录组测序,研究者首先发现T2D患者甲基转移酶METTL3、ALKBH5和YTHDF1表达水平下调(Fig 1a-b)。m
6
A测序进一步肯定T2D患者转录组中的m
6
A修饰水平同样较低(Fig 1c-d)。同时分析证明,存在m
6
A修饰的mRNA在T2D中水平相对较高,相反的不存在修饰的mRNA则无明显差异(Fig 1e)。分析这些包含m
6
A修饰的差异基因,发现主要富集在胰岛素分泌和响应等糖尿病相关通路(Fig 1g)。Insulin/IGF1-AKT-PDX1 信号通路上多个关键基因都出现了甲基化的下调(Fig 1h-i)。
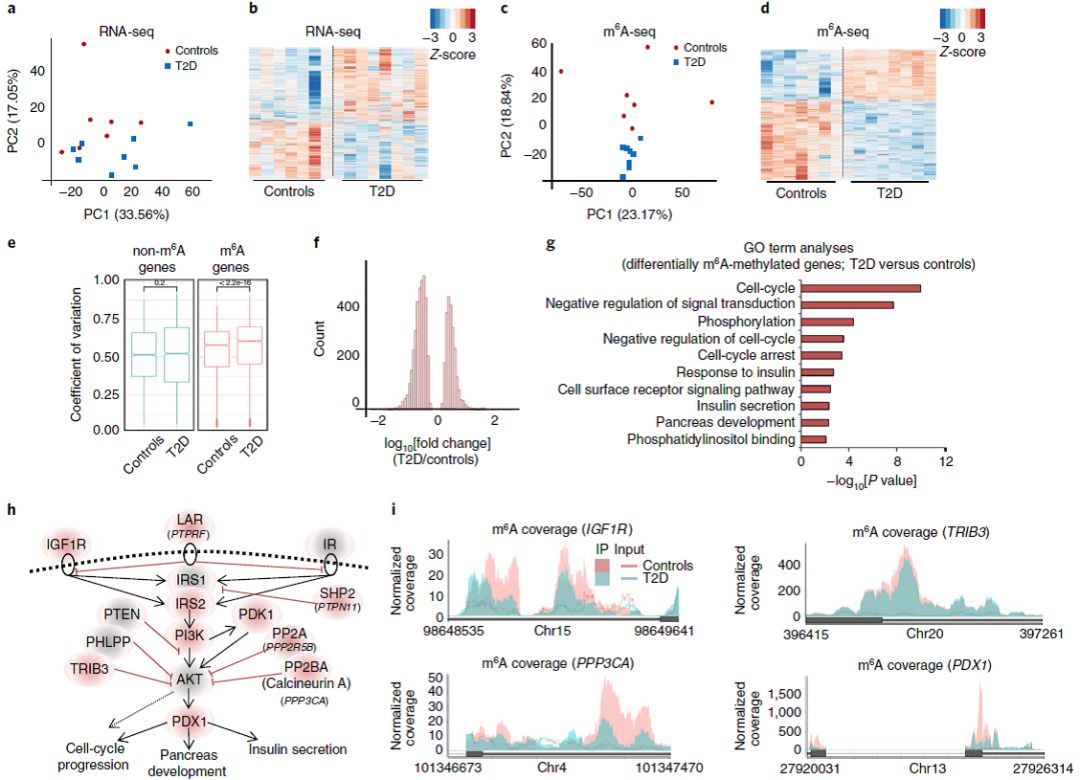
Figure 1
2:m
6
A修饰调节PDX1表达、以及insulin/IGF1刺激的AKT磷酸化
研究者在EndoC-βH1细胞中敲低了METTL3和14,进行转录组测序,发现475个与T2D的m
6
A测序的交集基因(Fig 2a)。通路分析发现这些基因同样与细胞周期、胰岛素分泌等生物学过程相关(Fig 2b)。此外METTL3/14的敲低都会降低IGF1、以及Insulin诱导的AKT磷酸化(Fig 2c-j)。Insulin/IGF1-AKT-PDX1是跟糖尿病高度相关的信号通路,AKT磷酸化激活能够促进下游基因PDX1的稳定性。PDX1是胰腺发育和功能最重要的基因之一,在胰岛中可以调控β细胞的细胞属性、细胞周期以及胰岛素的分泌。研究者证明METTL3/4敲低影响PDX1 m
6
A修饰,进而减少PDX1 mRNA(Fig 2k-m)。
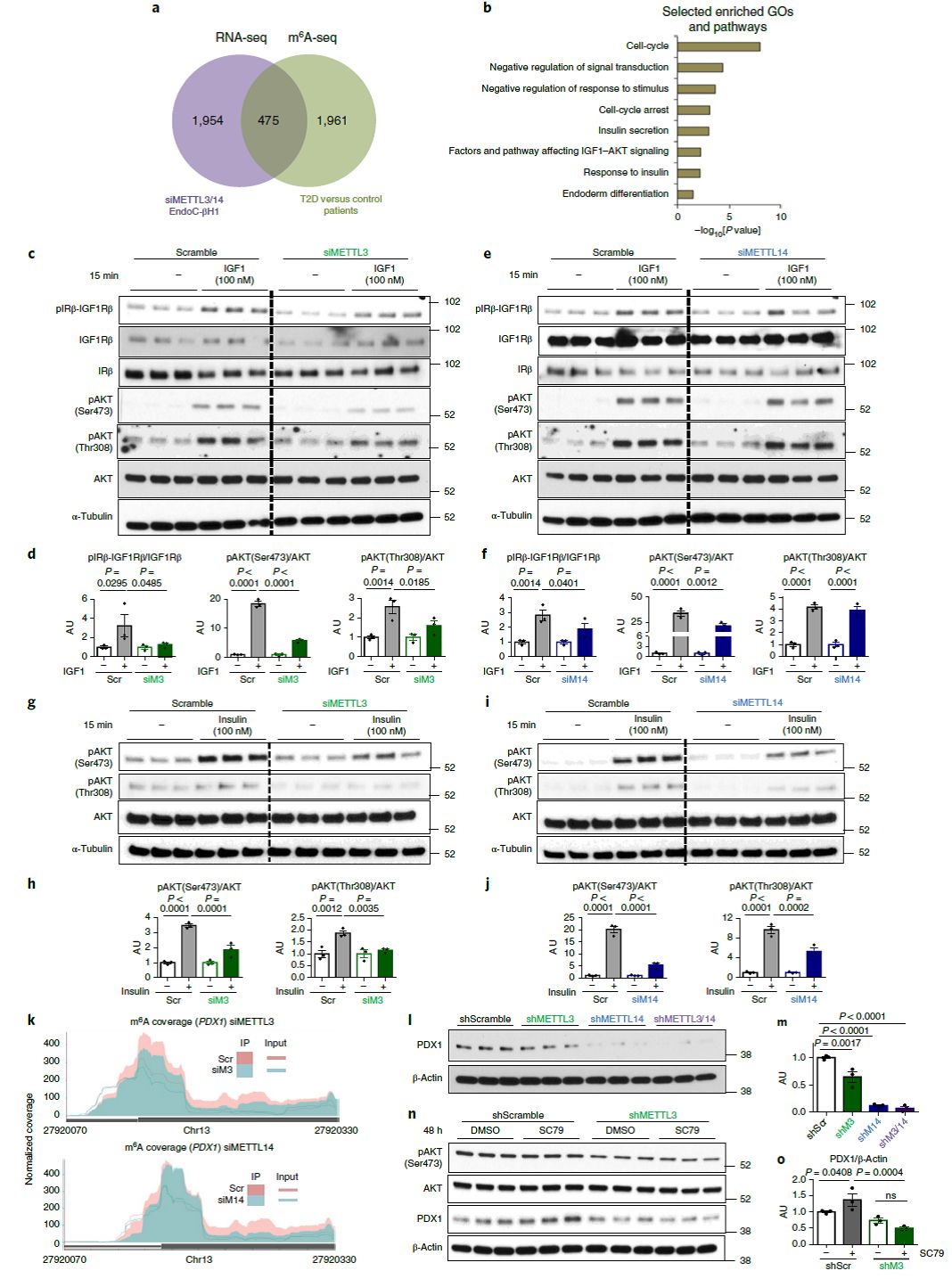
Figure 2
3:β细胞中特异性敲除Mettl14会抑制Pdx1表达,导致糖尿病
研究者进一步构建了β细胞特异性敲除Mettl14小鼠
(M14KO),发现其出生时体重正常,但3月龄即开始体重相对下降(Fig 3a);血糖从1月龄即开始相对升高,且愈加严重(Fig 3b),糖耐受更差(Fig 3c),胰岛素水平降低(Fig 3d-e),但对胰岛素的敏感性则没有差别(Fig 3f)。形态学观察则发现M14KO鼠的胰岛和β细胞都显著减少(Fig 3g-h),源于细胞增殖的降低和凋亡增加(Fig 3i-j)。此外随着年龄增加,一部分PDX1+ INS+细胞子代却失去β细胞性质(Fig 3k-l)。表达分析证实细胞周期正调节基因Ccnd1/2、Cdk4等下调,抑制基因p21上调,β细胞早期marker上调而成熟marker下调(Fig 3m-n)。IGF1R水平下降,而AKT抑制基因上调(Fig 3o-p)。
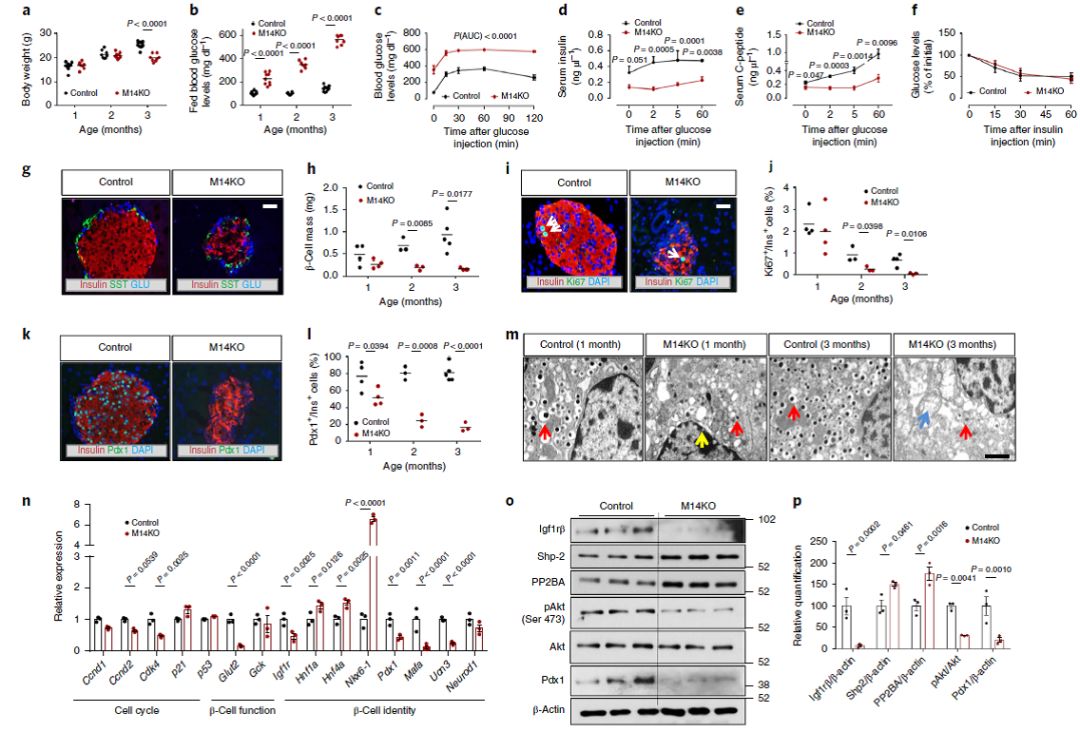
Figure 3
4:AKT通路是调控Mettl14在β细胞功能中的关键因素
研究者进一步分选出β细胞并分析M14KO小鼠表达谱(Fig 4a),发现PI3K-AKT、胰岛素分泌、T2D等通路富集(Fig 4b);G0/G1检验点相关基因Ccnd1/2和Cdk4,β细胞基因Igf1r等同样表达下调;而自噬、凋亡相关基因则上调(Fig 4c)。分离胰岛进行磷酸化蛋白芯片分析,发现胰岛素、PI3K-AKT、细胞周期、IGF1R等信号途径磷酸化下降(Fig 4d-f),例如AKT相关ERBB3等。通过STRING工具分析蛋白互作网络,发现两大事件:1)AKT/IGF1R/PTEN,以及2)细胞周期(Fig 4g)。这些结果表明了血糖升高是由于葡萄糖刺激胰岛素分泌受损而非胰岛素不敏感导致小鼠出现血糖不耐受。
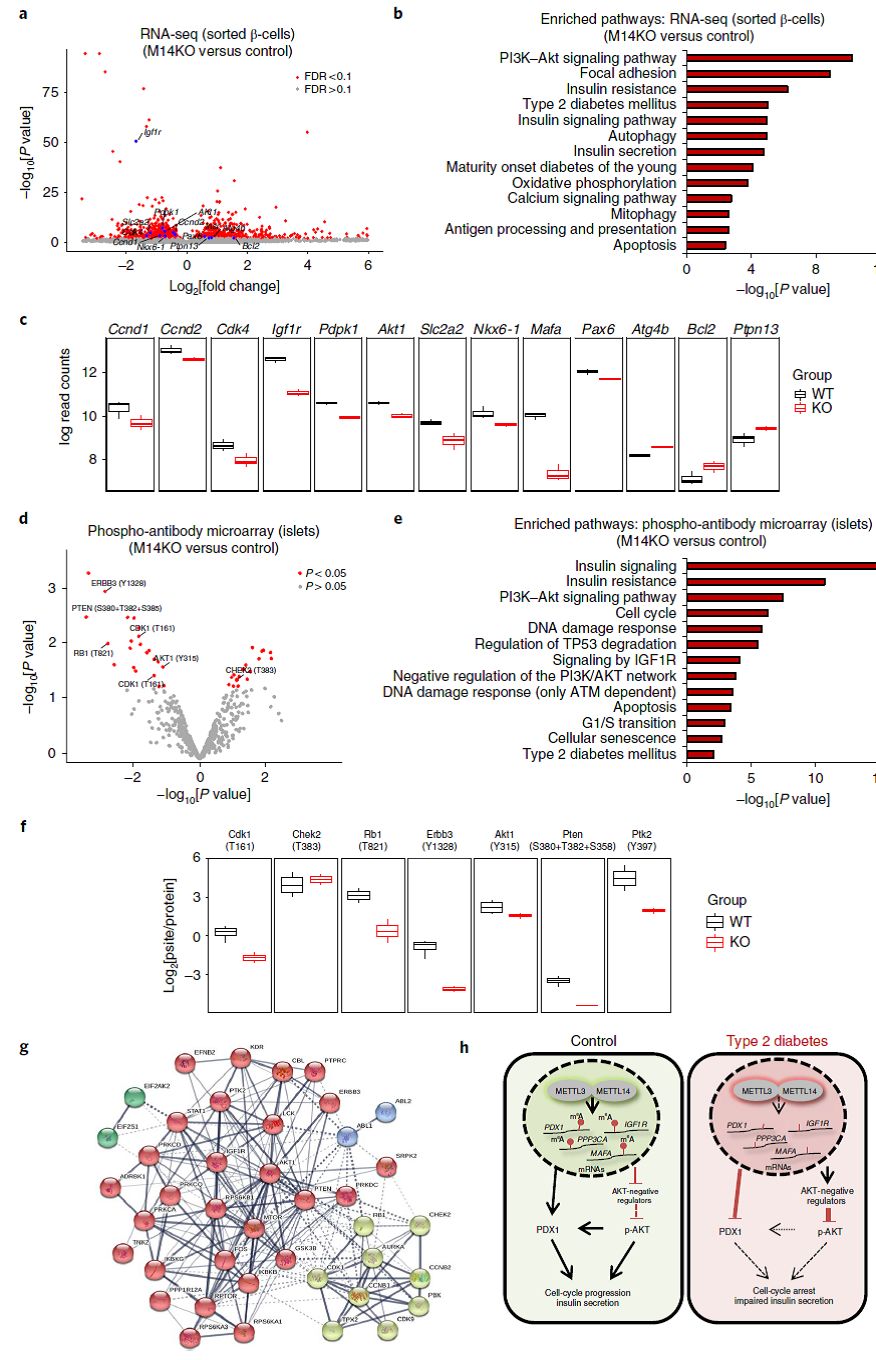
Figure 4
本研究开创性的分析了胰岛β细胞在正常和T2D患者中的m
6
A甲基化组、配合转录组;并通过模式细胞和动物模型构建,证实了m
6
A调控的Insulin/IGF1-AKT-PDX1信号转导通路,通过影响细胞周期及胰岛素分泌,影响β细胞及其胰岛的功能。本研究提示了胰岛中关键基因的m
6
A甲基化水平变化对胰岛素分泌代谢通路的影响,并对糖尿病形成有重要贡献。m
6
A通路对胰岛稳态的调控也为未来以m
6
A调控通路为靶向,寻找治疗糖尿病的途径提供了新的思路。此外,胰岛m
6
A甲基化组相较于转录组可更好的作为糖尿病分子标记。
Dario F. De Jesus. et al. m
6
A mRNA methylation regulates human β-cell biology in physiological states and in type 2 diabetes. Nature Metabolism, July 29 (2019),
https://doi.org/10.1038/s42255-019-0089-9
1. Stoffers, D. A., et al. Pancreatic agenesis attributable to a single nucleotide deletion in the human IPF1 gene coding sequence. Nature Genetics 15, 106 (1997).
5. Wang, X. et al. N6-methyladenosine-dependent regulation of messenger RNA stability. Nature 505, 117 (2013).
3. Frye, M., Harada, B. T., Behm, M. & He, C. RNA modifications modulate gene expression during development. Science 361, 1346-1349 (2018).
4. Guo, S. et al. Inactivation of specific β cell transcription factors in type 2 diabetes. The Journal of Clinical Investigation 123, 3305-3316 (2013).














