▎药明康德/报道
安斯泰来制药(Astellas Pharma)今日宣布,治疗急性骨髓性白血病(AML)的新药gilteritinib的3期临床试验MORPHO正式启动。MORPHO旨在评估gilteritinib作为在患有FLT3内部串联重复突变阳性(FLT3 / ITD +)的急性骨髓性白血病和诱导治疗后得到缓解的患者中,接受造血干细胞移植(HCT)两年之内的维持治疗的疗效。主要终点为无复发生存期(RFS),这项研究是与血液和骨髓移植临床试验网络(BMT CTN)合作进行的。

急性骨髓性白血病是一种骨髓性造血芽细胞异常增殖的血液恶性肿瘤。其特点是骨髓内异常芽细胞的快速增殖而影响了正常造血细胞的产生。急性骨髓性白血病是成年人最常见的急性白血病,其发病率随着人的年龄增长而增加。根据美国国家癌症研究所(National Cancer Institute)估计,全美今年将有超过21000个新病例,并有超过10000名患者死于该疾病。
Gilteritinib对FLT3 ITD和FLT3酪氨酸激酶域(TKD)有抑制作用,在AML患者中大约有三分之一的患者出现了这两种常见类型的FLT3突变。此外,gilteritinib还显示了对AXL的抑制作用。
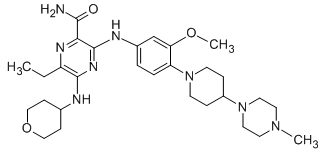
▲Gilteritinib的分子结构式(图片来源:Chemietek)
MORPHO是一项随机、双盲、安慰剂对照、多中心的3期临床试验,由346例诊断为FLT3 / ITD突变的AML患者参与。在移植前,参与者的骨髓中必须没有发现急性白血病的任何形态学特征,并且没有任何额外的骨髓外的白血病迹象。在接受移植后的两年期间内,参与者将随机接受gilteritinib (120毫克)或安慰剂。这项研究正在北美、欧洲和包括日本在内的亚太地区进行。
在之前进行的gilteritinib 1/2期临床试验中,研究人员发现gilteritinib能够有效抑制FLT3的突变以及活性,同时能够使患者的寿命获得显著的延长。在2017年7月,FDA向gilteritinib颁发了孤儿药资格。Astellas目前正在通过几个不同的3期临床试验,来研究gilteritinib在不同的AML患者人群中的治疗效果。其中包括在复发性难治性的FLT3 + AML患者中的ADMIRAL临床试验。

▲Mark J . Levis博士对这项研究感到兴奋(图片来源:约翰·霍普金斯大学医学院)
“我们知道,FLT3 + AML患者的预后可能比其他突变的患者更糟,一些患者在干细胞移植后可能会经历缓解,然而很多患者会不幸复发,” 约翰·霍普金斯大学(Johns Hopkins University)Sidney Kimmel综合癌症中心的临床试验研究员,BMT CTN研究副主席Mark J . Levis博士说:“考虑到这一现实,在干细胞移植后的患者中研究gilteritinib疗效令人感到兴奋。”
“对治疗选择非常有限的FLT3 + AML的患者人群以及Astellas公司来说,MORPHO试验的开始是另一个重要的里程碑,” Astellas主管肿瘤药物研发的高级副总裁兼全球治疗分区主任Steven Benner博士说:“我们致力于对FLT3 + AML患者进行治疗,目前有4项3期临床试验正在进行中,以探索gilteritinib对治疗患有这种侵袭性、具有遗传和耐药性突变特征的血液癌症患者的潜在疗效。”
我们衷心祝愿Gilteritinib的3期临床试验能够顺利进行,早日为白血病患者带来康复希望!
参考资料:
[1] Astellas (ALPMY) Release:First Patient Dosed In Phase III MORPHO Trial Evaluating Gilteritinib As Maintenance Therapy Following Hematopoietic Stem Cell Transplant In Patients With FLT3 Mutation-Positive Acute Myeloid Leukemia
[2] Astellas官网

















