
注:文末有研究团队简介 及科研思路分析
近年来,单分子荧光技术得到了快速发展,广泛应用于生命科学、化学和材料科学领域。然而传统的基于全内反射荧光显微镜(TIRF)的单分子荧光技术只能在溶液中浓度不超过50 nM荧光标记物种的条件下进行测量。该浓度限制远低于许多生物大分子的生理浓度和许多生化过程的结合常数,制约了单分子荧光技术的应用。近日,清华大学生命科学学院的陈春来研究组利用光激活的荧光团代替传统荧光团,发展了突破全内反射荧光显微技术中荧光浓度屏障的通用方法,将标记物种的最高浓度限值提高了2-3个数量级,从而可以在接近生理条件的μM浓度下进行单分子FRET测量。
单分子荧光技术可以在复杂体系内实时观测生物分子的动态过程,并揭示隐藏在传统系综平均测量中的重要信息,包括生物分子之间的差异性以及反应过程中的瞬时中间态等。基于全内反射荧光显微镜的单分子荧光共振能量转移技术(FRET)已广泛应用于研究生物大分子的自身构型变化和分子间的相互作用等动态过程。然而,基于全内反射荧光显微镜的单分子FRET技术仍然存在着缺陷和不足。全内反射荧光显微镜中最高可使用的荧光标记样品浓度,即荧光浓度屏障在50 nM左右,远低于许多生化反应的结合常数,也远低于许多生物分子在生理条件下的浓度(μM量级)。
清华大学的研究团队基于光激活染料开发了光激活单分子FRET(sm-PAFRET)的新方法,有效突破了单分子FRET技术中的荧光浓度屏障(图1)。他们利用激活光源(紫色)将玻片表面附近的光激活荧光团(黑色)都转变为可发射荧光的激活态(绿色)。待激活光源关闭后,在溶液中自由扩散的激活态荧光团会快速扩散离开玻片表面,而只有固定或与表面生物大分子反应的激活态荧光团标记分子才会被随后照明的激发光源(绿色)激发产生荧光。通过激活和激发光源的交替照明,他们可以不断地激活实验观测过程中结合到表面的荧光团,并测量其单分子FRET,实现在高浓度荧光标记物种的条件下进行基于全内反射荧光显微镜的单分子FRET实验。该方法简单易行,商业化可光激活的荧光团可通过购买获得,而显微镜的硬件和控制方面也只需在全内反射荧光显微镜(TIRF)上装配激活光源和激发光源,并可对其进行控制和快速切换。
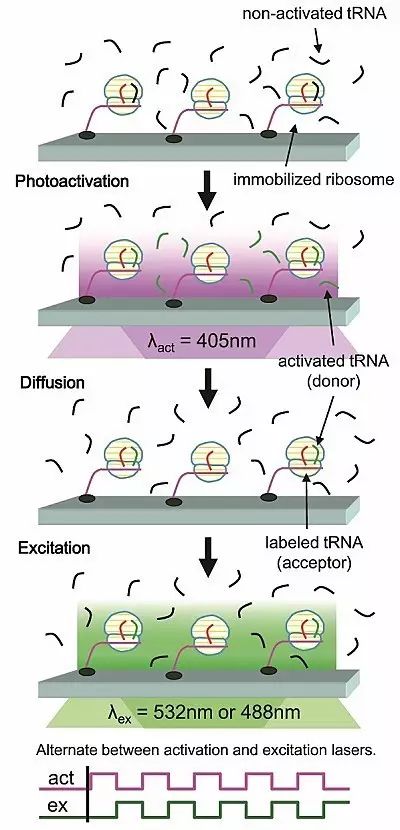
图1. 光激活单分子FRET(sm-PAFRET)的原理示意图
这一新方法可广泛应用于生物大分子的动态研究,例如原核核糖体的翻译延伸过程中,延伸因子G (EF-G)可以催化转运RNA (tRNA)和信使RNA (mRNA)在核糖体上移动。利用sm-PAFRET,他们首次发现当延伸因子G (EF-G)的浓度从14 nM增加至接近生理浓度1.4 μM时,核糖体会采取不同的翻译延伸途径。因此,在低浓度下捕捉到生物大分子的动态变化有可能无法代表生理条件下生物大分子实际的状态。因此,在接近生理浓度的条件下的单分子实验有望揭示更多未知的分子机制。
这一成果近期发表在Angewandte Chemie International Edition 上,文章的第一作者是清华大学生命科学学院的博士研究生彭思佳。
该论文作者为:Sijia Peng, Ruirui Sun, Wenjuan Wang, Chunlai Chen
原文(扫描或长按二维码,识别后直达原文页面):

Single-Molecule Photoactivation FRET: A General and Easy-To-Implement Approach To Break the Concentration Barrier
Angew. Chem. Int. Ed., 2017, DOI: 10.1002/anie.201702731
研究团队简介

陈春来,博士,研究员,博士生导师;2003年本科毕业于北京大学化学与分子工程学院,2008年获得北京大学化学生物学博士学位;2008年7月至2015年2月在美国宾夕法尼亚大学医学院生理系从事博士后研究,2015年3月起任清华大学生命科学学院研究员。
教育和工作经历
1999-2003,学士,北京大学化学与分子工程学院
2003-2008,博士,北京大学化学与分子工程学院
2008-2015,博士后/研究员,University of Pennsylvania
2015至今,研究员,清华大学生命科学学院、清华大学-北京大学生命科学联合中心(CLS)
主要研究方向
1)发展单分子荧光方法和技术;
2)核糖体在蛋白质合成过程中翻译和调控机制的研究;
3)CRISPR系列蛋白靶向和剪切机制的研究。
http://www.x-mol.com/university/faculty/45877
科研思路分析
Q:该研究的想法是怎么产生的?
A:我们一直致力于发展单分子荧光的新方法和技术,并利用单分子荧光技术研究和揭示生物大分子的动态过程和分子机制。如上所述,目前单分子FRET技术的浓度屏障是50 nM,远低于许多生化反应的结合常数,也远低于许多生物分子在生理条件下的浓度(μM量级)。而现有的突破单分子成像浓度屏障的方法操作复杂、难度大,系统难以建立、使用和维护,因此我们希望可以找到一种简单易行的方法。基于光激活的荧光染料,激活和激发光源交替照明可以不断地激活实验观测过程中结合到表面的荧光团,进而发展出这一较为简便的突破浓度限制的单分子FRET成像新方法
Q:研究过程中遇到哪些难点?
A:该研究中的难点是光激活荧光染料对生物大分子的标记。商业化的光激活荧光染料可选种类较少,染料的发光性能不如传统的荧光染料,水溶性差。因而不同样品需要寻找合适的标记条件以及标记后样品的纯化条件,以最大的可能性提高标记效率和产率。在这一过程中,我们团队在荧光染料标记方面的经验积累起到了重要的作用。
Q:突破单分子荧光成像浓度屏障有哪些未来发展方向?
A:1)现有技术的优化使这些技术更加简便易行,可广泛被许多实验室使用。2)新技术的开发:针对研究对象开发特定的技术,如利用线性的零模波导技术对分子马达蛋白的迁移进行观测等。3)样品制备:包括设计和制备具有独特性质的荧光团进行高浓度下的单分子荧光成像以及发展更加简单有效的方法来大规模制备标记的生物样品。


本文版权属于X-MOL(x-mol.com),未经许可谢绝转载!欢迎读者朋友们分享到朋友圈or微博!
长按下图识别图中二维码,轻松关注我们!
点击“阅读原文”,查看所有收录期刊


















