常规抗体
常规的抗体或者是完整大小的抗体是被称为免疫球蛋白的糖蛋白,是浆细胞对外来分子或者抗原反应后产生的。抗体最基础的功能是结合特异性抗原并激发免疫反应,从而保护机体免于感染。抗体包括好几种亚型,这里主要是介绍IgG和IgM亚型的抗体。IgG和IgM亚型的抗体被广泛应用于科研、诊断和治疗等方面。
常规抗体的结构
一个完整的抗体的基础单元结构有四条肽链组成,包括两条重链和两条轻链,并通过二硫键结合在一起。抗体的形状像一个Y字母,Y结构的铰链区具有弹性。每条肽链就有一个恒定区(在所有的抗体中都非常的保守)和一条可变区(在一个种抗体中都是特异性的)。轻链可变区的标示符号是VL,而轻链恒定区的标示符号是CL(图一左)。 类似的,重链的可变区和恒定区分别被标示为(VH)和(CH)。碳水化合物通常和重链的CH2区域结合。Fc段只包括重链的恒定区(CH), 但是和抗原结合的Fab段(Fab)包括一个恒定区和重链的可变区以及轻链的可变区(VH and VL)。 Fv区域(variable fragment) 只包含两个可变区(图一)。 见 用小鼠抗体为例讨论免疫球蛋白的亚型,分类以及免疫球蛋白结构域的数量。
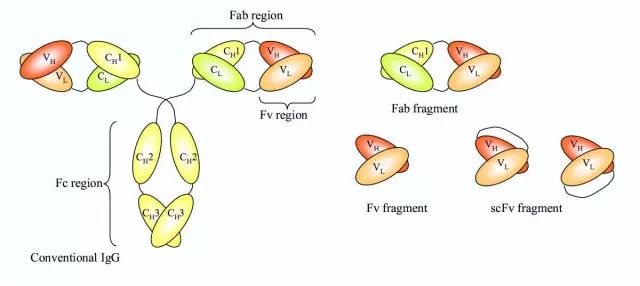
图 1. 一个完整的常规抗体(左)和通常的抗体片段(右)的基本结构。来自于 [1] 。
常规抗体的应用
常规抗体在科研中用于通过蛋白质印迹、免疫组织化学 [2] 以及酶联免疫吸附法 [3] 等方法检测目的蛋白已经有十年了。完整大小的抗体还被应用于临床的检测,比如妊娠试验以及用ELISA检测血液中HIV病毒。另外,常规的完整的抗体还被应用于疾病的治疗。例如,英利昔单抗是一个可以识别肿瘤坏死因子的抗体,被用于治疗肠道疾病和类风湿性关节炎 [4, 5] 。 曲妥珠单抗或者赫赛汀是一种可以结合上皮生长因子二的抗体,被用于治疗转移的乳腺癌 [6] 。 另外,还有好多抗体,包括Muromomab,被用于器官移植后的基础治疗来防止发生移植物排斥反应 [7] 。
用常规抗体的优点包括Fc区域能够激活机体的免疫反应并结合到目标分子上使之被破坏。用完整抗体的缺点包括由于其分子太大不能被渗入到某些组织中 [8] 。 Fc段能够激活一些有害于病人的免疫反应是临床上应用完整抗体治疗的一个缺点。Fc区域通常能引起一些非特异性的结合,对抗体的检测的应用不利。
抗体片段
一个抗体的片段可以通过化学试剂和基因工程的方法获得。化学试剂片段通过是通过打断铰链区的二硫键或者是用蛋白酶,包括胃蛋白酶和木瓜蛋白酶,消化抗体后产生的。基因工程产生的片段提供大量的片段,每一个都能有特异性的结合区和功能特质。
Fab, Fab', (Fab')2, 和 Fv
抗体经过化学试剂处理的和蛋白酶消化可以得到抗原结合片段(Fab), 其来源于IgG 和 IgM 亚型抗体的可变区(图一右)。 去掉Fabs片段的抗体部分就是Fc片段了,由重链的恒定区组成。 抗原结合片段包括了Fab, Fab', (Fab')2, 和 Fv。 这些片段能够结合抗原,但是它们缺少Fc段,其包括重链的恒定区2和3。当抗体被木瓜蛋白酶消化后,两个独立的F(ab)片段从Fc区域分离下来。然而用胃蛋白酶消化后,一个带有小部分的Fc铰链区的 F(ab')2 片段从抗体中分离下来。尽管利用化学试剂的方法分离抗体的片段能够产生很多有用的诊断和治疗的工具,但是是非常费时的而且需要大量的抗体作为原材料。
单价的F(ab) 片段只有一个抗原结合区,然而多价的F(ab')2 片段有两个抗原结合区,它们通过二硫键结合在一起。F(ab')2 片段产生2个单价的Fab' 片段和一个游离的硫基,其能够用于其他分子的结合。
Fv 片段是IgG和IgM类型抗体通过酶法分析后产物中最小的片段。Fv片段抗原结合区,其由VH和VC区域组成,但是他们缺少CH1和CL区域(Figure 1 right panel)。VH 和VL 通过非共价键在Fv 片段里结合在一起。
ScFv, 双特异抗体,三特异抗体,四特异抗体,双-scFv,mimi抗体,Fab2,Fab3
基因工程方法能够产生单链可变区(ScFv),它是Fv类型片段,其包括了通过易弯曲多肽链接在一起的VH和VL区域(图一右) [9] 。如果结合区至少有12个残基的长度,ScFv片段就是单抗 [10] 。 通过操作V-结构域和铰链区的长度可以创作不同形式的Fv分子 [10] 。 连接体是3-11残基的产生的scFv分子不能折叠成有功能的Fv结构域。这些分子和其他的scFv分子一起可以创作出一个双价的双特异性抗体 [11] 。 如果连接体的长度小于3个残基,scFv 分子相互作用后能够产生三特异性或者四特异性抗体。多价的scFvs与对应的单价的抗体相比具有更强的结合抗原的亲和力 [12] 。 Mini抗体是scFv-CH3融合蛋白,被装进到双价的二聚体中。 Bis-scFv 片段是双特异性的 [13] 。 小型化的ScFv片段能够通过两个不同的可变区产生,能够让这些Bis-scFv分子同时结合两个不能的表位。基因学方法能够用来产生双特异性的Fab 二聚体(Fab2)和三特异性的Fab 三聚体(Fab3)。这些抗体片段同时能够结合2 (Fab2)或者3(Fab3)不同的抗体。
抗体片段的应用
在一些应用中,片段比完整的抗体更加有优越性。这个话题最近被Nelson写了综述 [14] 。 其中一个优越性是片段比完整的抗体要小,能够进入完整抗体进不去的组织中发挥治疗作用和进行免疫组织化学染色 [8] 。 抗体片段比常规的抗体更小,通常没有被糖基化,可以使它们的产物在原核表达系统中表达,从而节省时间和资金消耗。然而, 缺少Fc结构域的片段在体内比常规抗体降解的速度要快 [15] ,而且不能够激发Fc介导的细胞毒性进程,除非它们结合一个为了达到更好治疗目的的有效的原件 [16] 。然而,缺少Fc结构域对于免疫组织化学和其他的检测又是有利的,因为减少了抗体与Fc受体的非特异性结合。没有Fc区域的抗体片段具有能够减少非特异性结合的优点。抗流感的神经氨酸酶抗体 NC10 是一个在诊断中被广泛应用的一个ScFv。抗上皮细胞粘附分子Ep-CAM抗体MOC-31 是一个用于癌症治疗的ScFv。 双特异性抗体,三特异性抗体和四特异性抗体在放射免疫治疗和体内的影像学诊断方面都有潜在的应用价值 [17] 。
参考文献
Robinson M, Shaller C, Garmestani K, Plascjak P, Hodge K, Yuan Q, et al. Effective treatment of established human breast tumor xenografts in immunodeficient mice with a single dose of the alpha-emitting radioisotope astatine-211 conjugated to anti-HER2/neu diabodies. Clin Cancer Res. 2008;14:875-82 pubmed publisher
Renart J, Reiser J, Stark G. Transfer of proteins from gels to diazobenzyloxymethyl-paper and detection with antisera: a method for studying antibody specificity and antigen structure. Proc Natl Acad Sci U S A. 1979;76:3116-20 pubmed
Matthews J. Immunocytochemical methods: a technical overview. J Oral Pathol. 1987;16:189-95 pubmed
Lequin R. Enzyme immunoassay (EIA)/enzyme-linked immunosorbent assay (ELISA). Clin Chem. 2005;51:2415-8 pubmed
Keyashian K, Annunziata M, Sakuraba A, Hanauer S. Management of inflammatory bowel disease: past, present and future. Expert Rev Clin Immunol. 2012;8:303-5pubmed
Miller A, Ranatunga S. Immunotherapies in rheumatologic disorders. Med Clin North Am. 2012;96:475-96, ix-x pubmed publisher
Shepard H, Jin P, Slamon D, Pirot Z, Maneval D. Herceptin. Handb Exp Pharmacol. 2008;:183-219 pubmed
Goldstein G. Overview of the development of Orthoclone OKT3: monoclonal antibody for therapeutic use in transplantation. Transplant Proc. 1987;19:1-6 pubmed
Jain R. Physiological barriers to delivery of monoclonal antibodies and other macromolecules in tumors. Cancer Res. 1990;50:814s-819s pubmed
Bird R, Hardman K, Jacobson J, Johnson S, Kaufman B, Lee S, et al. Single-chain antigen-binding proteins. Science. 1988;242:423-6 pubmed
Hudson P, Kortt A. High avidity scFv multimers; diabodies and triabodies. J Immunol Methods. 1999;231:177-89 pubmed
Holliger P, Prospero T, Winter G. "Diabodies": small bivalent and bispecific antibody fragments. Proc Natl Acad Sci U S A. 1993;90:6444-8 pubmed
Kortt A, Lah M, Oddie G, Gruen C, Burns J, Pearce L, et al. Single-chain Fv fragments of anti-neuraminidase antibody NC10 containing five- and ten-residue linkers form dimers and with zero-residue linker a trimer. Protein Eng. 1997;10:423-33 pubmed
Holliger P, Hudson P. Engineered antibody fragments and the rise of single domains. Nat Biotechnol. 2005;23:1126-36 pubmed
Nelson A. Antibody fragments: hope and hype. MAbs. 2010;2:77-83 pubmed
Cumber A, Ward E, Winter G, Parnell G, Wawrzynczak E. Comparative stabilities in vitro and in vivo of a recombinant mouse antibody FvCys fragment and a bisFvCys conjugate. J Immunol. 1992;149:120-6 pubmed
Sanz L, Cuesta A, Compte M, Alvarez-Vallina L. Antibody engineering: facing new challenges in cancer therapy. Acta Pharmacol Sin. 2005;26:641-8 pubmed
(来源:比比生物科技 2015-09-20 )















