作者:北重楼 来自:蒲公英
数据可靠性从20世纪90年代初现端倪,至21世纪之后开始逐步成为各国药监部门关注重点。近几年来,印度和我国药企吃尽“数据可靠性”的苦头,就连不少欧美企业也中标。
2017年6月1日儿童节,CFDA发布的《2016年度药品检查报告》,在这份37页共9607个字的报告中共37处提到“数据”,15处提到“数据可靠性”,这些都说明了数据可靠性问题如阴霾一样散布于药品行业中,在今后一段时期内数据可靠性仍将是监管机构的检查利器。
数据可靠性存在原因很多,说明了有其适合生长的土壤气候。
一方面是企业内部文化和管理造成,虽然药品是特殊商品,但是首先是商品,既然是商品,就可以产生交换的价值,意味着存在利益,这个利益在某种程度就会使一些企业铤而走险,剑走偏锋,以更低的成本赚取更高的利润,当成本降低到不合理的程度,意味着可能以违反规范为代价……
另一方面是气候,比如早期国内临床试验百分百成功,郑筱萸时代的买卖批文无疑为数据可靠性埋下了炸药,2015年07月22日发布《关于开展药物临床试验数据自查核查工作的公告》,公告发布后,引发行业震动,此举掀开了临床试验数据不真实、不规范等数据可靠性问题,打破了我国临床试验百分百成功的潜规则。从某种意义来说解释了部分药企生产工艺与注册工艺不一致,数据造假、不规范等问题缘由。自2015年CFDA开展了一系列医药审评审批制度改革,说明了气候正在回暖,越规范的企业越吃亏、不规范的企业反而获利的时代正在过去……
当然,数据可靠性不仅仅是存在我国,在欧美国家一样存在,CFDA审核查验中心在官网发布的《对美国FDA 2016财年发布的GMP警告信的分析》一文中第四部分涉及数据可靠性缺陷的警告信:提到美国境外企业涉及数据可靠性(data integrity)缺陷的警告信的百分比始终保持在大约80%,美国境内企业的警告信也达到了相同的百分比。
今年,美国FDA警告信中涉及数据可靠性缺陷的警告信数量显著增加(表4和图4)。表4显示在美国FDA境内外发布的警告信数量,包括数据管理和数据可靠性问题。该部分分析不包括发给调配药房的警告信。
警告信中的数据可靠性缺陷可以继续识别哪些企业没有遵守规则。FDA发给美国境内与境外生产场地的涉及数据可靠性缺陷的警告信的百分比基本相同,但绝对数不同。
表4.涉及数据可靠性缺陷的警告信(调配药房除外)
警告信数量
| 2013
| 2014
| 2015
| 2016
|
总数
| 38
| 22
| 19
| 46
|
数据可靠性(境内)
| 0/13
(0%)
| 0/4
(0%)
| 1/3
(33%)
| 8/11
(73%)
|
数据可靠性(境外)
| 10/25
(40%)
| 12/18
(67%)
| 13/16
(81%)
| 29/35
(81%)
|
数据可靠性总数
| 10/38
(26%)
| 12/22
(55%)
| 14/19
(74%)
| 37/46
(79%)
|
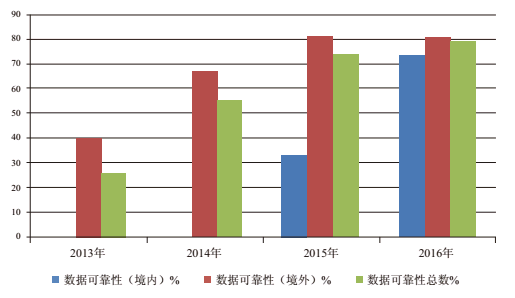
图4. 数据可靠性警告信的百分比
CFDA审核查验中心在官网发布的《EMA因CRO公司数据可靠性问题建议暂停销售和批准相关仿制药》说明临床试验数据可靠性问题也存在于欧美国家中。
这些都说明了数据可靠性将在未来很长一段时间内成为监管部门的检查重点,制药企业已不能“太任性、为所欲为”了……
距离蒲公英第九届(广州)年会开幕还有6天
蒲公英(广州)年会延续:6月11号下午,晚宴神秘大奖
2017 医药产业供应链安全追溯技术论坛邀请函(第二轮)
















