阿达木单抗(Adalimumab)是第一个由美国FDA批准的全人源单克隆抗体。FDA于2002年批准阿达木单抗(Adalimumab)治疗类风湿性关节炎后,雅培制药并没有放弃对阿达木单抗新适应症的开发,经过几年的不断努力,2005年又获得了FDA批准用于银屑病关节炎。一药治多病,一直是制药行业的不懈追求,在雅培科学家的不懈努力下,2006到2008两年时间里,陆续获得了FDA批准用于强直性脊柱炎、克罗恩病、斑块型银屑病和幼年特发性关节炎等多种病症,真可谓是老药开新花!阿达木单抗(Adalimumab)2010年在中国上市,已获批两个适应症,分别为类风湿关节炎和强直性脊柱炎。而最近中国国家食品药品监督管理总局(CFDA)药品审评中心(CDE)又批准了成年中重度慢性斑块型银屑病的适应症,真是人类的福音!
通用名:阿达木单抗注射液
英文名:Adalimumab Solution for injection
商品名:修美乐(Humira)
上市时间:2002(在美国)、2010(在中国)
生产企业:艾伯维(AbbVie)
成份:活性成分:阿达木单抗,在中国仓鼠卵巢细胞中表达的重组全人源化肿瘤坏死因子(TNF) α单克隆抗体。
分子量:148,108±8Da
辅料:甘露醇、柠檬酸一水合物、柠檬酸钠、磷酸二氢钠二水合物、磷酸氢二钠二水合物、氯化钠、聚山梨酯 80、氢氧化钠、注射用水。
性状:本品为预填充于注射器中的澄明液体。
1993年由巴斯夫子公司 - 巴斯夫生物科技公司和剑桥抗体技术(Cambridge Antibody Technology,CAT)合力研究。首先剑桥抗体技术以TNFα为抗原使用它们特有的噬菌体展示技术在体外筛选中得到了全人抗体D2E7。在随后的研究中,BASF Knoll进一步对全人抗体D2E7进行了完善,并完成了前期的生产工艺开发和临床申报。2002年6月,美国雅培制药公司(Abbott)以69亿美元收购巴斯夫诺尔(BASF Knoll),获得了全人抗体D2E7的开发生产和销售权。最终将阿达木单抗(Adalimumab)推向市场。2013年1月2日,雅培制药(Abbott)因发展需要将公司拆分为雅培制药(Abbott)和艾伯维(AbbVie)两家公司,艾伯维(AbbVie)负责阿达木单抗后期的生产开发和销售。
1)类风湿性关节炎(RA)
本品与甲氨蝶呤合用,用于治疗:对改善病情抗风湿药(DMARDs),包括甲氨蝶呤疗效不佳的成年中重度活动性类风湿关节炎患者。
本品与甲氨蝶呤联合用药,可以减缓患者关节损伤的进展(X线显示),并且可以改善身体机能。
2)强制性脊椎炎(AS)
用于常规治疗效果不佳的成年重度活动性强直性脊柱炎患者。
3)斑块型银屑病(Ps)
需要进行系统治疗或光疗,并且对其它系统治疗(包括环孢素、甲氨蝶呤或光化学疗法)不敏感、或具有禁忌症、或不能耐受的成年中重度慢性斑块型银屑病。
4)幼年特发性关节炎(JIA)
在4岁和以上儿童患者中减轻中度至严重活动性多关节JIA的征象和症状。
5)银屑病关节炎(PsA)
在活动性PsA成年患者中减轻征象和症状,抑制结构损伤进展和改善机体功能。
6)克罗恩氏病(CD)
患有中度至严重活动性克罗恩氏病,且对常规治疗后病情控制不佳的成年患者,以减轻疾病征象和症状,并实现和维持临床缓解。如这些患者还对英夫利昔单抗[infliximab]丧失反应或不能耐受的亦可减轻征象和症状,并实现和维持临床缓解。
7)中重度溃疡性结肠炎
Humira被批准当免疫抑制药物如皮质激素类、硫唑嘌呤[azathioprine]和6-巯基嘌呤[6-mercaptopurine]不起作用时控制溃疡性结肠炎。
8)儿科克罗恩病、脱髓鞘病、血细胞减少或全血细胞减少,心脏衰竭以及狼疮样综合征等14种病症。
Humira是通过皮下注射给药。
类风湿样关节炎,银屑病关节炎,强直性脊柱炎
40mg每隔周。有些患者有RA未接受甲氨蝶呤[methotrexate]增加频数至40mg每周可能有效益。
幼年特发性关节炎
(1)15kg (33lbs)至<30kg (66lbs):20mg每隔周
(2)≥30kg (66lbs):40mg每隔周
克罗恩氏病
初始剂量第一天是160mg(4次40mg注射在一天或2次40mg注射每天连续2天),接着80mg两周以后(第15天)。两星期以后(第29天)开始维持剂量40mg每隔周。
斑块性银屑病
80mg初始剂量,接着40mg每隔周初始剂量开始一周后。
剂型和规格
(1) 40mg/0.8mL在一支单次使用预装笔(HUMIRA笔)中
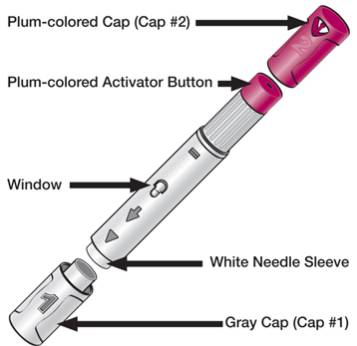
修美乐预装笔
(2) 40mg/0.8mL在一支单次使用预装玻璃注射器中
(3) 20mg/0.4mL在一支单次使用预装玻璃注射器中
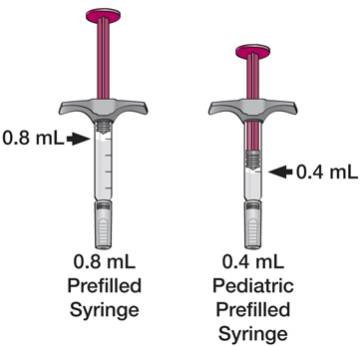
修美乐预装注射器
1. 作用机制
阿达木单抗特异性结合至TNF-α并阻断它与p55和p75细胞表面受体的相互作用。体外在存在补体时阿达木单抗也溶解表面表达TNF细胞。阿达木单抗不结合或无活性淋巴毒素(TNF-β)。TNF是一种天然存在的细胞因子,涉及正常炎症和免疫反应。类风湿样关节炎,包括幼年特发性关节炎,银屑病关节炎和强直性脊柱炎患者的滑膜也中发现TNF水平升高和在病理性炎症和关节破坏均起重要作用,是这些疾病的特点。在银屑病(Ps)斑块中也发现TNF水平增高。在斑块性银屑病中,用Humira治疗可能减低表皮厚度和炎症细胞浸润,不知道这些药效学活性和Humira发挥其临床效应机制间的相互关系。
阿达木单抗还调节TNF诱导或调节的生物学反应,包括负责白细胞迁移的粘附分子的水平(ELAM-1,VCAM-1和ICAM-1其IC50为1-2 × 10-10M)。
2. 药效学
在类风湿样关节炎患者中,用Humira治疗后,观察到炎症的急性期反应物水平比基线减低(C-反应蛋白[CRP]和红细胞沉降率[ESR])和血清细胞因子(IL-6)。在克罗恩氏病患者中也观察到CRP水平减低。Humira给药后生成组织重建负责软骨破坏的血清基质金属蛋白酶水平(MMP-1和MMP-3)也减低。
3. 药代动力学
健康成年受试者单次皮下给予Humira 40mg后最大血清浓度(Cmax)和达峰时间(Tmax)分别是4.7±1.6μg/mL和131±56小时。三次单次皮下给药后研究估算的阿达木单抗绝对生物利用度为64%。单次静脉给药后,在剂量0.5至10.0mg/kg范围阿达木单抗的药代动力学为线性。
在类风湿样关节炎(RA)患者中几项研究用静脉剂量范围0.25至10mg/kg测定阿达木单抗单次给药药代动力学。分布容积(Vss)范围4.7至6.0L。阿达木单抗的全身清除率接近12mL/hr。跨越研究均数末端半衰期接近2周,范围10至20天。来自5例类风湿样关节炎患者滑膜液中阿达木单抗浓度范围为血清的31至96%。
RA患者每隔周接受40mg Humira,在无和有甲氨蝶呤(MTX)时分别观察到阿达木单抗平均稳态谷浓度接近5μg/mL和8至9μg/mL。在RA患者中单次和多次给药后MTX分别减低阿达木单抗表观清除率29%和44%。 每隔周和每周皮下给予20,40和80mg后,在稳态时,平均血清阿达木单抗谷水平与剂量成接近正比例增加。在长期给药超过两年研究中没有清除率随时间变化的证据。
在银屑病关节炎患者中每隔周用40mg Humira治疗(无和有MTX分别为6至10μg/mL和8.5至12μg/mL)与在RA患者中用相同剂量治疗后浓度比较时阿达木单抗平均稳态谷浓度略微较高。
在强直性脊柱炎患者与RA患者中阿达木单抗的药代动力学相似。
在克罗恩氏病患者中,在第0天负荷剂量160mg Humira,接着在第2周80mg Humira,在2周和4周时达到平均血清阿达木单抗谷水平接近12μg/mL。在克罗恩氏病患者中每隔周接受维持剂量40mg Humira后观察到在24周和56周时平均稳态谷水平接近7μg/mL。
在斑块性银屑病患者中,每隔周阿达木单抗40mg单药治疗,治疗期间平均稳态谷浓度接近5至6μg/mL。
在RA患者中,群体药代动力学分析揭示存在抗-阿达木单抗抗体时,阿达木单抗的表观清除率趋向于较高,而在患者年龄40至>75岁时,较低清除率随年龄增加。
在RA患者中接受剂量低于推荐剂量和在RA患者中有高类风湿样因子或CRP浓度也预测到表观清除率次要增加,这些增加可能无重要临床意义。
在校正患者体重后,未观察到性别-相关的药代动力学差别。健康志愿者和类风湿样关节炎患者显示相似的阿达木单抗药代动力学。
没有可供利用的肝或肾受损患者药代动力学资料。
在幼年特发性关节炎(4至17岁)受试者中,对体重<30kg受试者每隔周皮下接受20mg Humira作为单药治疗或同时甲氨蝶呤平均稳态血清阿达木单抗谷浓度分别是6.8μg/mL和10.9μg/mL。The对体重≥30 kg受试者每隔周皮下接受40mg Humira作为单药治疗或同时甲氨蝶呤平均稳态血清阿达木单抗谷浓度分别是6.6μg/mL和8.1μg/mL。
癌发生,突变发生,生育力受损。
未曾进行Humira长期动物研究评价致癌性潜能或其对生育力的效应。在体内小鼠微核试验或沙门-大肠杆菌(Ames)试验分别未观察到Humira的染色体断裂或致突变效应。
(1)严重感染 – 活动性感染期间不开始用Humira。如发生感染,仔细监视,如感染变得严重停止Humira
(2)侵袭性真菌感染 – 对用Humira发生全身性疾患的患者,对居住或在霉菌病流行区域患者考虑经验性抗真菌治疗
(3)恶性病 –Humira - 治疗患者比对照恶性病发生率更高
(4)过敏反应或严重性过敏反应:可能发生
(5)乙型肝炎病毒再激活 – 治疗期间和其后几个月监视HBV携带者。如发生再激活,停止Humira和开始抗病毒治疗
(6)脱鞘性疾病:可能加重或新发生
(6)血细胞减少,全血细胞减少 – 建议如发生症状患者立即求医并考虑停止Humira
(7)可能发生心衰,恶化或新发生
(8)狼疮样综合征 – 如发生症状停止Humira
最常见不良反应(发生率 >10%):感染(如上呼吸,窦炎),注射部位反应,头痛和皮疹。
(1)阿巴西普[Abatacept] – 增加严重感染风险
(2)阿那白滞素[Anakinra] – 增加严重感染风险
(3)活疫苗 – 不应与Humira同时给予
艾伯维的老将修美乐(阿达木单抗、Humira)在单抗领域可谓是一枝独秀,自2002年12月美国上市以来,开发了14种适应症,据报道还会有新的适应症会被开发出来。在全球有超过20个国家进行市场销售。毋庸置疑,艾伯维通过扩大临床试验和长期追踪,已经有足够充分的临床数据证明修美乐临床使用安全,修美乐从研发、实验、扩展新适应症,创造了一个难以复制和超越的记录,故也有业界誉为有望与阿司匹林相媲美,成为历史性的药物!因此Evaluate Pharma就发布一份报告预测修美乐或将有望在2022年再次夺得全球“药王”的宝座,但从目前来看,不确定性还很强,仿制药、在研新药等劲敌环伺。生物仿制药一旦上市,将会导致销售额的下降超出预期。无论如何这款年销售额接近150亿的全球最畅销处方药,未来的市场前景应该还是值得期待!
参考文献
[1]Bornadata Bain & Melanie Brazil. Nature Reviews Drug Discovery 2,693-694 (September 2003)
[2]DEF,MHS,RMF,VS,CAB,DC,SAF,EKC. J Rheumatol,vol. 30 (2003) pp. 2563-2571.
[3]https://www.drugs.com/cdi/adalimumab.html
[4]http://www.medicalnewstoday.com/articles/248215.php
[5] Kelley B. Industrialization of mAb production technology: the bioprocessing industry at a crossroads. MAbs,2009, 1(5):443-452.
[6] https://www.accessdata.fda.gov/drugsatfda_docs/label/2012/125057s0278lbl.pdf
[7] Jespers LS,Roberts A,Mahler SM,Winter G,Hoogenboom HR (September 1994). "Guiding the selection of human antibodies from phage display repertoires to a single epitope of an antigen". Biotechnology (N.Y.). 12 (9): 899–903.
声明:
本文由药渡头条投稿作者撰写,观点仅代表作者本人,不代表药渡头条立场,欢迎交流补充。联系方式:010-82826195 转8048
如需转载,请务必注明文章作者和来源
投稿详情请点击“4月-5月 | 王牌写手获奖名单”