申请成为专栏作者,或原创投稿
请联系:[email protected]
相关阅读:
2017年CDE药审咨询会盘点(一)
本文由HEROIV根据公开信息整理,如有疑问,欢迎留言交流。
今年2-9月,CDE每月召开了药审咨询会。
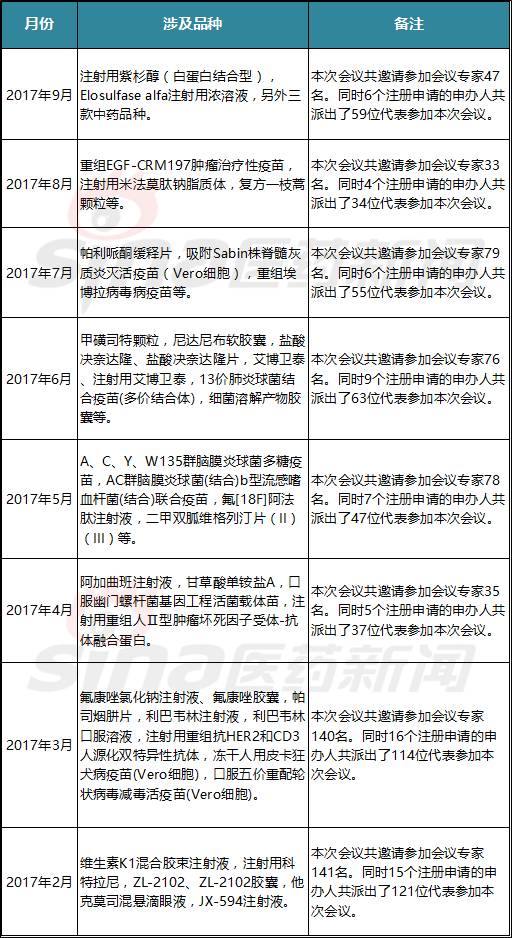
品种盘点:
目前国内上市的为日本原研千寿制药(Senju Pharmaceutical)的塔克司。本品适用于抗过敏治疗效果不明显的春季角结膜炎患者。应在观察到眼睑结膜巨大乳头增殖时使用。
国内药企中只有沈阳兴齐药业申请。目前本品IND申请仍在审评审批中,进入CDE申请中心时间是2016年4月,申请类别属于化药2类,猜测用于术后免疫排斥反应(项目代号:SQ-708(Ⅰ))。
目前兴齐眼药市值27亿元左右,公司产品包括眼用抗感染药、眼用抗炎/抗感染药、散瞳药和睫状肌麻痹药、眼用非类固醇消炎药、缩瞳药和抗青光眼用药等,覆盖十个眼科药物细分类别,拥有眼科药物批准文号44个,其中25个产品被列入国家医保目录(2017年版),占公司所获批生产产品总数的56.82%。
10口服五价重配轮状病毒减毒活疫苗(Vero细胞)
本品由默沙东研发(中国)有限公司申报,受理号为JXSS1600001,目前在审评审批中,属于优先审评品种。
先前被纳入优先审评程序药品注册申请第十二批,申请事项:新药上市,入选理由:儿童用药(2016.12.2),属于药物临床试验数据自查核查品种(2016.12.30);属于药物临床试验数据现场核查品种(2017.3.3)。
该疫苗国内由智飞生物代理,相关品种国内有兰州生物所的单价轮状病毒疫苗。
轮状病毒疫苗是预防轮状病毒肠炎的疫苗,主要接种对象为2月龄至3岁儿童。轮状病毒感染性腹泻是婴幼儿急诊和死亡(除呼吸道感染之外)的第二位病因。我国每年大约有1000万婴幼儿患轮状病毒感染性胃肠炎,占婴幼儿总人数的1/4。
本品由辽宁依生生物制药申报IND,属于特殊审批品种,同时是重大专项品种,CDE在2017年6月办理,目前在审评审批中。
2017年1月,依生生物宣布,FDA正式批准其正在临床开发阶段的皮卡狂犬病疫苗在预防狂犬病病毒感染的孤儿药资格。该产品是由依生生物的科研人员自主开发,具有独立知识产权的疫苗制剂。该疫苗采用了新型的皮卡佐剂技术,能够与Toll样受体3(TLR-3)结合,通过其信号转导通路激活免疫系统。该疫苗已于2013年列为“重大新药创制”项目,目前即将在新加坡完成临床二期实验。
狂犬病是一种目前已知的最致命的急性传染病,一旦出现临床症状,感染死亡率几乎达100%,据不完全统计,2013年全球有60,000人因此丧生,在中国、印度和许多其他发展中国家是一个严重的公共健康威胁。
常州康普药业生产申请目前已完成审批;岳阳新华达制药不批准;国内市场有河南辅仁制药获批该品种。儿童用药,本品适用于病毒性上呼吸道感染,皮肤疱疹病毒感染。
口服后很快被吸收,在60-90分钟内血药浓度达到高峰。进入体内经磷酸化后生成活性的代谢产物—利巴韦林单磷酸。消除半衰期约24小时。本品能滞留于红细胞中,主要由肾脏排泄,仅有少量从粪便中排出。
来自南京前沿生物申请上市(NDA),一款长效注射抗艾滋病药物。
对已完成24-48周治疗的208例患者的中期数据分析显示,每周注射一次艾博卫泰联合洛匹那韦/利托那韦治疗“一线配方治疗失败的HIV感染者”的疗效与世界卫生组织(WHO)推荐的二线配方(三药组合,对照组)相当或更优,与对照组含有替诺福韦的配方相比显示出有统计意义的更优肾脏安全性。
艾博卫泰III期临床试验按国际标准设计,主要终点指标为治疗48周血液中HIV 病毒载量小于50拷贝/毫升的患者百分比。中期数据显示,艾博卫泰组有80.4%的患者达到主要终点指标,而对照组仅有66.0% (差别14.4%, 95% CI –3.0 to 31.9),非劣性检验合格。其他次要终点指标也全部达到,包括1)患者治疗48周血液HIV 病毒载量小于400拷贝/毫升的百分比;2)患者治疗48周血液HIV 病毒载量相对基线值变化;以及3)患者治疗48周血液CD4+ 细胞数与基线相比的变化。安全性指标方面两组类似,但对照组服用替诺福韦患者血清肌酐水平比艾博卫泰组患者有显著升高。
该项目为厦门大学分子影像暨转化医学中心与美国NIH生物医学影像与生物工程研究所陈小元教授实验室联合研发,国内由江苏施美康药业和泰州启瑞医药。经核医学影像技术,不仅能够检测肿瘤的发展情况以及药物治疗反应,而且能够用于肿瘤的早期治疗,且对于人体有良好的安全性。
江苏施美康药业是一家沙坦类抗高血压原料药及高效环保特色农药中间体为主的企业。公司积极响应国家产业结构调整,率先实施由精细化工向原料药、成品药、制剂生产的战略转型,企业有过一些环保罚款等历史。
据CFDA网站信息,目前国内仅芜湖康卫和中国人民解放军军事医学科学院生物工程研究所两家涉足研发幽门螺杆菌疫苗。
岳阳兴长参股子公司芜湖康卫研发的1类新药“口服重组幽门螺杆菌疫苗”已于2009年4月已获批新药证书,但由于技术交接原因该产品至今尚未实现产业化。
总局2017年3月发布UCB停止进口瑞士OM Pharma SA 细菌溶解产物胶囊的公告,检查发现该品种的发酵工艺变更、发酵条件变更、裂解步骤混合工艺变更未按照《药品注册管理办法》附件4的规定申报,不符合《药品生产质量管理规范》第一百八十四条的要求等。
最新的注册申请中显示,申请备案事宜:OM Pharma SA公司的细菌溶解产物胶囊(注册证号:S20150041)申请变更事宜如下:1、外盒(10粒/盒、30粒/盒):公司logo的图案变化,外盒外观的微小变动(仅蓝色底衬部分由“蓝色底衬”变为“蓝色底衬叠加白色底纹”),文字内容均未发生改变;2、铝箔:仅公司logo的图案变化。
2017年4月,申请人(中国人民解放军军事医学科学院生物工程研究所,康希诺生物)按预防用生物制品1类申报注册。药审中心根据总局《关于解决药品注册申请积压实行优先审评审批的意见》,经审核公示,于6月初将其纳入优先审评程序。
目前根据CDE官方消息,专家认为,重组埃博拉病毒病疫苗是基于埃博拉病毒病特殊流行时期的研发产品,在该病流行间歇期,难以提供大样本量人群有效性数据,仍需进一步开展相关研究,但根据现有研究得到的安全性和免疫原性数据,建议可以作为国家储备有条件批准,用于疫情发生时的应急处理,并开展Ⅲ期临床试验。
撰文:HEROIV
编辑:Holly
▷ 诺和诺德——糖尿病巨头还在继续增长
▷ 国内同靶点首个 众生药业创新药ZSP1603获批临床
▷ 因甲状腺药物Levothyrox丑闻 默克法国总部遭警方“突袭”















